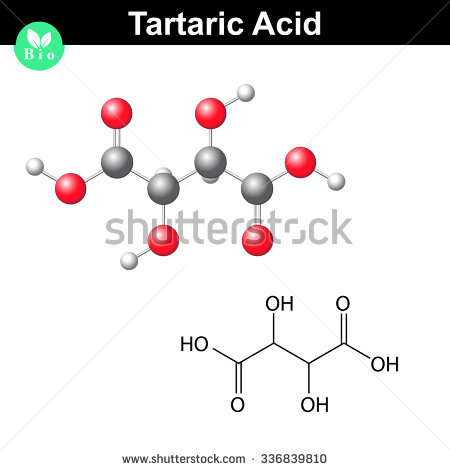
Ik denk dat je de empirische formule van wijnsteenzuur al hebt, en dat je de molecuulformule moet vinden aan de hand van de molaire massa.
Aannemend dat het uitgangspunt hier de empirische formule van wijnsteenzuur is, ziet die er als volgt uit
#”C”_2 “H”_3 “O”_3 -># empirische formule
Nu, de empirische formule van een verbinding vertelt je de kleinste gehele getalsverhouding die bestaat tussen de atomen van de samenstellende elementen ervan.
In dit geval weet u dat de molecuulformule, die u het exacte aantal atomen vertelt waaruit een molecuul van deze verbinding bestaat,
#color(black)(“2 atomen van C” color(red)(” for every “) {(“3 atomen van H”),(“3 atomen van O”) :}#
In wezen bent u op zoek naar een veelvoud van de empirische formule.
Wijnsteenzuur heeft naar verluidt een molaire massa van #”150 g mol”^(-1)#. Je doel hier is om de molaire massa van de empirische formule te bepalen en vervolgens deze waarde te gebruiken om de molecuulformule van de verbinding te bepalen.
In dit geval heb je
#2 xx “12.011 g mol”^(-1) “”color(blue)(+)#
#3 xx “1,00794 g mol”^(-1)#
#3 xx “15,9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> #de molaire massa van de empirische formule
Dus, als de empirische formule een molaire massa heeft van #”75.044 g mol”^(-1)#, en de molaire massa van wijnsteenzuur is #”150 g mol”^(-1)#, dan volgt hieruit dat je de empirische formule moet vermenigvuldigen met
#(150 color(red)(cancel(color(black)(“g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(“g mol”^(-1))))) = 1,999 ~~ color(red)(2)#
om de molecuulformule te krijgen. Dit betekent dat de molecuulformule van wijnsteenzuur zal zijn
#(“C”_2 “H”_3 “O”_3)_kleur(rood)(2) impliceert kleur(groen)(|bar(ul(kleur(wit)(a/a) “C”_4 “H”_6 “O”_6kleur(wit)(a/a)|))#
Hier ziet een molecuul wijnsteenzuur eruit