Supunerea mea aici ar fi că aveți deja formula empirică a acidului tartric și că trebuie să găsiți formula sa moleculară folosind masa sa molară.
Să presupunem că punctul de plecare aici este formula empirică a acidului tartric arată astfel
#”C”_2 „H”_3 „O”_3 -># formula empirică
Acum, formula empirică a unui compus vă spune cel mai mic raport de numere întregi care există între atomii elementelor sale constitutive.
În acest caz, știți că formula moleculară, care vă spune numărul exact de atomi care alcătuiesc o moleculă a compusului respectiv, va conține
#color(black)(„2 atomi de C” color(red)(” pentru fiecare „) {(„3 atomi de H”),(„3 atomi de O”) :}#
În esență, căutați un multiplu al formulei empirice.
Se spune că acidul tartric are o masă molară de #”150 g mol”^(-1)#. Scopul tău aici va fi să determini masa molară a formulei sale empirice, apoi să folosești această valoare pentru a determina formula moleculară a compusului.
În acest caz, vei avea
#2 xx „12.011 g mol”^(-1) ” „color(blue)(+)#
#3 xx „1.00794 g mol”^(-1)#
#3 xx „15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaaaaaaa)#
##”75.044 g mol”^(-1) -> #masa molară a formulei empirice
Atunci, dacă formula empirică are o masă molară de #”75.044 g mol”^(-1)#, iar masa molară a acidului tartric este de #”150 g mol”^(-1)#, rezultă că va trebui să înmulțiți formula empirică cu
#(150 color(red)(cancel(color(black)(„g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(„g mol”^(-1))))) = 1,999 ~~ color(red)(2)#
pentru a obține formula moleculară. Aceasta înseamnă că formula moleculară a acidului tartric va fi
#(„C”_2 „H”_3 „O”_3)_color(red)(2) implică color(green)(|bar(ul(color(white)(a/a) „C”_4 „H”_6 „O”_6color(white)(a/a)|))#
Iată cum arată o moleculă de acid tartric
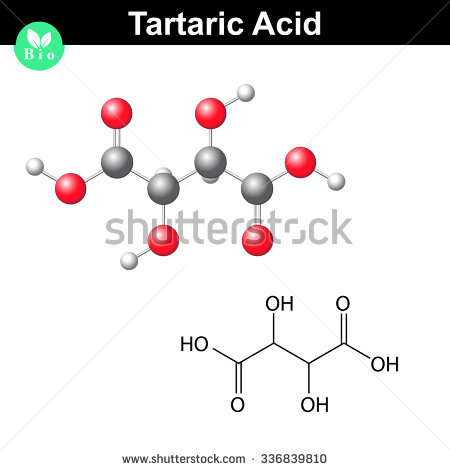
.