Celule fotovoltaice (galvanice)
Pentru a ilustra principiile de bază ale unei celule galvanice, să considerăm reacția zincului metalic cu ionul cupric (Cu2+) pentru a da cupru metalic și ionul Zn2+. Ecuația chimică echilibrată este următoarea:
\
Potem provoca această reacție introducând o tijă de zinc într-o soluție apoasă de sulfat de cupru(II). Pe măsură ce reacția are loc, tija de zinc se dizolvă și se formează o masă de cupru metalic. Aceste schimbări au loc în mod spontan, dar toată energia eliberată este sub formă de căldură și nu sub o formă care poate fi folosită pentru a efectua lucru.
Aceeași reacție poate fi realizată cu ajutorul celulei galvanice ilustrate în figura \(\PageIndex{3a}\). Pentru a asambla celula, se introduce o bandă de cupru într-un pahar care conține o soluție 1 M de ioni Cu2+, iar o bandă de zinc se introduce într-un alt pahar care conține o soluție 1 M de ioni Zn2+. Cele două benzi metalice, care servesc drept electrozi, sunt conectate printr-un fir, iar compartimentele sunt conectate printr-o punte de sare, un tub în formă de U introdus în ambele soluții care conține un electrolit lichid concentrat sau gelificat. Ionii din puntea de sare sunt selectați astfel încât să nu interfereze cu reacția electrochimică prin oxidarea sau reducerea lor sau prin formarea unui precipitat sau a unui complex; cationii și anionii utilizați în mod obișnuit sunt Na+ sau K+ și, respectiv, NO3- sau SO42-. (Ionii din puntea de sare nu trebuie să fie aceiași cu cei din cuplul redox din oricare dintre compartimente). Când circuitul este închis, are loc o reacție spontană: zincul metalic este oxidat în ioni Zn2+ la electrodul de zinc (anodul), iar ionii Cu2+ sunt reduși în Cu metalic la electrodul de cupru (catodul). Pe măsură ce reacția avansează, banda de zinc se dizolvă, iar concentrația de ioni Zn2+ în soluția de Zn2+ crește; simultan, banda de cupru câștigă masă, iar concentrația de ioni Cu2+ în soluția de Cu2+ scade (figura \(\PageIndex{3b}\)). Astfel, am realizat aceeași reacție ca și în cazul în care am folosit un singur pahar, dar de data aceasta semi-reacțiile oxidativă și reductivă sunt separate fizic una de cealaltă. Electronii care sunt eliberați la anod trec prin sârmă, producând un curent electric. Prin urmare, celulele galvanice transformă energia chimică în energie electrică care poate fi apoi folosită pentru a efectua muncă.
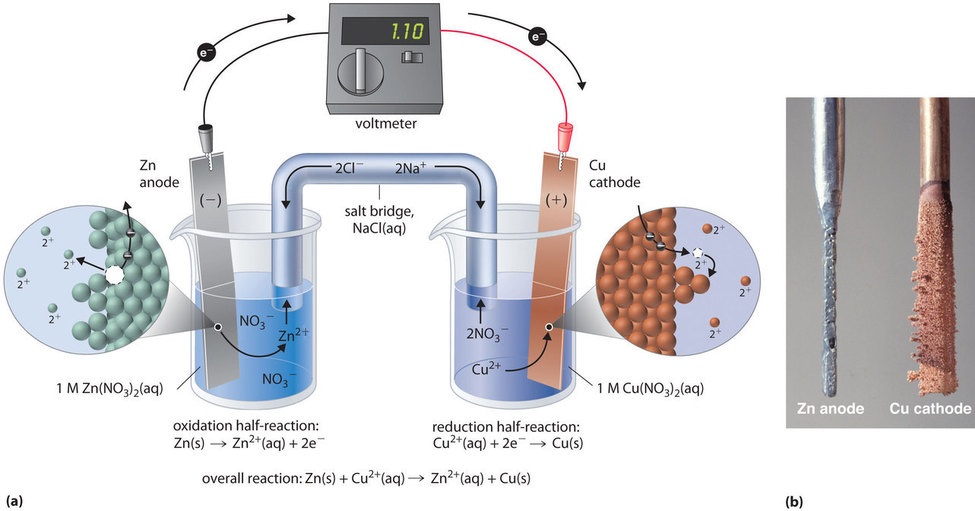
Electrolitul din puntea de sare are două scopuri: completează circuitul prin transportul sarcinii electrice și menține neutralitatea electrică în ambele soluții permițând ionilor să migreze între ele. Identitatea sării dintr-o punte salină nu este importantă, atâta timp cât ionii componenți nu reacționează sau nu suferă o reacție redox în condițiile de funcționare a celulei. Fără o astfel de conexiune, sarcina pozitivă totală în soluția de Zn2+ ar crește pe măsură ce zincul metalic se dizolvă, iar sarcina pozitivă totală în soluția de Cu2+ ar scădea. Puntea de sare permite ca sarcinile să fie neutralizate printr-un flux de anioni în soluția de Zn2+ și un flux de cationi în soluția de Cu2+. În absența unei punți saline sau a unei alte conexiuni similare, reacția ar înceta rapid, deoarece neutralitatea electrică nu ar putea fi menținută.
Se poate folosi un voltmetru pentru a măsura diferența de potențial electric dintre cele două compartimente. Deschiderea comutatorului care conectează firele la anod și catod împiedică trecerea unui curent, astfel încât nu are loc nicio reacție chimică. Cu toate acestea, dacă întrerupătorul este închis, circuitul extern este închis și un curent electric poate trece de la anod la catod. Potențialul [\(E_{celula}\)] al celulei, măsurat în volți, reprezintă diferența de potențial electric dintre cele două jumătăți de reacție și este legat de energia necesară pentru a deplasa o particulă încărcată într-un câmp electric. În celula pe care am descris-o, voltmetrul indică un potențial de 1,10 V (figura \(\PageIndex{3a}\)). Deoarece electronii din semi-reacția de oxidare sunt eliberați la anod, anodul dintr-o celulă galvanică este încărcat negativ. Catodul, care atrage electronii, este încărcat pozitiv.
Nu toți electrozii suferă o transformare chimică în timpul unei reacții redox. Electrodul poate fi realizat dintr-un metal inert, foarte conducător, cum ar fi platina, pentru a preveni reacția acestuia în timpul unui proces redox, unde nu apare în reacția electrochimică globală. Acest fenomen este ilustrat în exemplul \(\PageIndex{1}\).
O celulă galvanică (voltaică) transformă energia eliberată de o reacție chimică spontană în energie electrică. O celulă electrolitică consumă energie electrică de la o sursă externă pentru a conduce o reacție chimică nespontană.
Exemplu \(\PageIndex{1}\)
Un chimist a construit o celulă galvanică formată din două pahare. Un pahar conține o bandă de staniu scufundată în acid sulfuric apos, iar celălalt conține un electrod de platină scufundat în acid azotic apos. Cele două soluții sunt conectate printr-o punte de sare, iar electrozii sunt conectați cu un fir. Curentul începe să circule, iar la electrodul de platină apar bule de gaz. Reacția redox spontană care are loc este descrisă de următoarea ecuație chimică echilibrată:
\
Pentru această celulă galvanică,
- scrieți reacția de înjumătățire care are loc la fiecare electrod.
- indicați care electrod este catodul și care este anodul.
- indicați care electrod este electrodul pozitiv și care este electrodul negativ.
Date: celula galvanică și reacția redox
Se cere: semireacțiile, identitatea anodului și a catodului și atribuirea electrodului ca fiind pozitiv sau negativ
Strategie:
- Identificați semireacția de oxidare și semireacția de reducere. Apoi identificați anodul și catodul din semi-reacția care are loc la fiecare electrod.
- Din direcția fluxului de electroni, atribuiți fiecărui electrod ca fiind pozitiv sau negativ.
Soluție
A În semi-reacția de reducere, nitratul este redus la oxid nitric. (Oxidul nitric ar reacționa apoi cu oxigenul din aer pentru a forma NO2, cu culoarea roșie-brună caracteristică). În semi-reacția de oxidare, staniul metalic este oxidat. Semireacțiile care corespund reacțiilor reale care au loc în sistem sunt următoarele:
reducere: \
oxidare: \
Astfel, nitratul este redus la NO, în timp ce electrodul de staniu este oxidat la Sn2+.
Pentru că reacția de reducere are loc la electrodul de Pt, acesta este catod. Invers, reacția de oxidare are loc la electrodul de staniu, deci acesta este anodul.
B Electronii trec de la electrodul de staniu prin sârmă la electrodul de platină, unde se transferă la nitrat. Circuitul electric este completat de puntea de sare, care permite difuzia cationilor spre catod și a anionilor spre anod. Deoarece electronii circulă de la electrodul de staniu, acesta trebuie să fie negativ din punct de vedere electric. În schimb, electronii curg spre electrodul de Pt, astfel încât acel electrod trebuie să fie pozitiv din punct de vedere electric.
Exercițiu \(\PageIndex{1}\)
Considerați o celulă galvanică simplă formată din două pahare conectate de o punte de sare. Un pahar conține o soluție de \(\ce{MnO_4^{-}}\) în acid sulfuric diluat și are un electrod de Pt. Celălalt pahar conține o soluție de \(\ce{Sn^{2+}}\) în acid sulfuric diluat, de asemenea cu un electrod de Pt. Când cei doi electrozi sunt conectați printr-un fir, circulă curent și are loc o reacție spontană care este descrisă de următoarea ecuație chimică echilibrată:
\
Pentru această celulă galvanică,
- scrieți semi-reacția care are loc la fiecare electrod.
- indicați care electrod este catodul și care este anodul.
- indicați care electrod este pozitiv și care este negativ.
Răspundeți la
\ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}}. \end{align*}\}]
Răspuns b
Electrodul de Pt din soluția de permanganat este catodul; cel din soluția de staniu este anodul.
Răspuns c
Catodul (electrodul din paharul care conține soluția de permanganat) este pozitiv, iar anodul (electrodul din paharul care conține soluția de staniu) este negativ.