- Ce este aciditatea?
- Ce este pH-ul?
- De ce este importantă aciditatea?
- Simptomele unui pH prea scăzut (substratul este prea acid)
- Simptomele unui pH prea ridicat (substratul este prea alcalin)
- Ce determină pH-ul?
- Măsurarea valorii pH-ului
- Prelevarea de probe
- Valorile corecte ale pH-ului pentru fiecare mediu
- Corectarea valorii pH-ului
Ce este aciditatea?
Aciditatea este esențială pentru viața pe pământ. Aciditatea determină adesea caracteristicile, calitatea, absorbția și solubilitatea multor substanțe. Așa funcționează enzimele, care sunt responsabile pentru aproape toate procesele biologice din organisme, dar numai cu o aciditate corectă. O mică fluctuație a acidității sângelui este mortală.
Ce este pH-ul?
Ph-ul (pondus Hydrogenii) indică aciditatea sau alcalinitatea unei soluții. Valoarea pH-ului variază de obicei între 0 și 14. O soluție cu o valoare a pH-ului între 0 și 7 este acidă, iar una între 7 și 14 este alcalină. Oțetul și cola au o valoare a pH-ului mai mică de 3. Soda și săpunul au o valoare a pH-ului mai mare de 8. O valoare a pH-ului de 7 este considerată neutră. Apa pură la temperatura camerei are un pH de 7. pH-ul apei de la robinet este, în general, puțin mai mare datorită prezenței calciului.
Multe medii naturale, cum ar fi pielea noastră, substraturile plantelor și mediile nutritive, sunt ușor acide și au o valoare a pH-ului cuprinsă între 5 și 6,5. Dacă ne uităm la lucrurile care le plac oamenilor, observăm că acestea sunt, în general, substanțe ușor acide sau neutre, cum ar fi apa. De asemenea, plantele preferă substanțele ușor acide. O valoare a pH-ului de aproximativ 5,5 se întâlnește atât de des în natură încât unii experți în plante consideră această valoare ca fiind „neutră”.
De ce este importantă aciditatea?
Aciditatea are o influență substanțială asupra absorbției și solubilității unui număr de elemente alimentare (a se vedea figura 1).
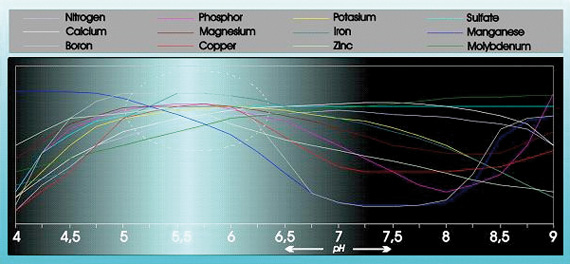
Fig. 1
În plus, aciditatea are o influență considerabilă asupra structurii, descompunerii substanțelor organice și a micro viețuitoarelor din sol. pH-ul influențează, de asemenea, modul în care elementele alimentare, metalele grele, pesticidele și alte microorganisme din mediul de cultură sunt eliminate din sol.
O valoare a pH-ului prea mică sau prea mare poate fi dăunătoare pentru plantele dumneavoastră, așa că este important să o alegeți corect. Dar cum știți când pH-ul este greșit? Prin experiență! Așadar, pentru a vă ajuta, am stabilit câteva dintre simptomele pe care le puteți observa:
Simptomele unui pH prea scăzut (substratul este prea acid)
- Majoritatea nutrienților pot fi dizolvați cu ușurință, ceea ce poate cauza un exces de mangan, aluminiu și fier;
- Deficiențele de fosfor, potasiu, magneziu și molibden pot fi cauzate de clătirea excesivă;
- Deficiența de magneziu, în special în substraturile reci;
- Solul este în general sărac;
- Viața solului este inhibată.
Simptomele unui pH prea ridicat (substratul este prea alcalin)
- Majoritatea substanțelor nutritive se dizolvă mai greu, determinând precipitarea compușilor de calciu, fier și fosfați;
- Absorbția redusă a manganului, fosfatului și fierului în special, dar și a cuprului, zincului și borului. Acest lucru va cauza deficiențe, în special în mediile de cultură umede și reci.
- În solurile nisipoase, descompunerea substanțelor organice crește considerabil dacă pH-ul este ridicat.
Ce determină pH-ul?
Unul dintre cei mai importanți factori care determină valoarea pH-ului într-o soluție sau în substrat este capacitatea de tamponare. Capacitatea de tamponare, în acest caz, înseamnă că există un fel de echilibru prezent care se restabilește continuu. De exemplu, dacă se pune o picătură de acid în 1 litru de apă de la robinet care are un pH de 7, aceasta va avea o influență redusă asupra acidității. Cu toate acestea, dacă se pune o picătură de acid în 1 litru de apă demineralizată (apă de baterie), pH-ul va scădea imediat în mod dramatic. Acest lucru se datorează faptului că apa de la robinet conține bicarbonat, în timp ce apa demineralizată nu. Bicarbonatul este cea mai importantă substanță tampon pentru valorile pH-ului între 5,5 și 7,5 în apă.
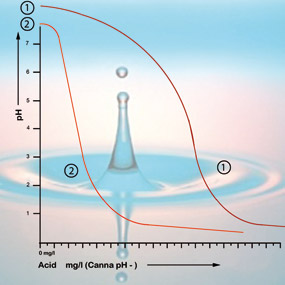 Bicarbonatul se leagă de acidul din soluție, care eliberează dioxid de carbon în atmosferă. Acesta este modul în care acidul este neutralizat, iar schimbările în aciditate vor fi doar minore atâta timp cât încă mai există bicarbonat prezent.
Bicarbonatul se leagă de acidul din soluție, care eliberează dioxid de carbon în atmosferă. Acesta este modul în care acidul este neutralizat, iar schimbările în aciditate vor fi doar minore atâta timp cât încă mai există bicarbonat prezent.
Cu o valoare a pH-ului de 5,3, tot bicarbonatul a fost consumat și soluția nu mai are amortizoare. pH-ul este acum instabil și se va schimba imediat dacă se adaugă acid (vezi figura 2). Prin urmare, cantitatea de acid necesară pentru ca o soluție de hrănire să aibă aciditatea corectă poate fi calculată pe baza conținutului de bicarbonat. Conținutul de bicarbonat al apei de la robinet este în general dat de compania de apă în miligrame pe litru.
Capacitatea de tamponare și aciditatea substratului depind de compoziția și prospețimea acestuia. Prezența materiei organice, a calciului și a bicarbonatului determină, în general, pH-ul. Argila conține întotdeauna carbonat de calciu și are o valoare relativ ridicată a pH-ului, care este greu de modificat, în timp ce turba și solurile nisipoase sunt acide.
Planta însăși are, de asemenea, o mare influență asupra acidității. Rădăcinile vor secreta substanțe acide sau alcaline în funcție de stadiul de dezvoltare al culturii, de hrana disponibilă, de diferențele de temperatură a rădăcinilor și de intensitatea luminii. Astfel, înțelegeți de ce pH-ul mediului radicular poate fluctua în mod constant. Un echilibru sofisticat al alimentației în timpul diferitelor faze de dezvoltare va menține pH-ul din mediul radicular în limite acceptabile.
Microviața, nivelurile de CO2 și creșterea algelor pot avea, de asemenea, un efect asupra acidității mediului radicular și a rezervorului de nutrienți.
Măsurarea valorii pH-ului

Este destul de ușor să măsurați pH-ul – aveți nevoie de niște indicatori de pH, cum ar fi hârtia de turnesol sau un set de testare a pH-ului. Aceștia sunt relativ ieftini, dar nu sunt întotdeauna exacți și uneori pot devia cu 1 sau 2 unități de pH. Toate pH-metrele sunt, în general, mai scumpe, iar precizia depinde de tipul de aparat și de calibrarea regulată cu lichid de calibrare.
Prelevarea de probe

Ph-ul apei folosite pentru irigarea plantelor este important, dar aciditatea din jurul rădăcinilor este esențială. Așadar, atunci când măsurați pH-ul este foarte important să luați proba în mod corect pentru a obține rezultate bune. Proba are aciditatea vârstei în mediul rădăcinilor.
Este ușor să luați probe și să măsurați pH-ul într-un sistem de recirculare, pur și simplu măsurați soluția de hrănire recirculată.
În sistemele de substrat fără recirculare, soluția de hrănire este extrasă din substrat (lână de piatră, agrofoam etc.) în mai multe locuri. Experții au discutat timp de un an și o zi problema locului de unde se prelevează probele. Noi recomandăm, la fel ca o serie de laboratoare de renume, să se preleveze probe din locurile în care se află rădăcinile, adică de sub și din jurul picurătoarelor. Luați probe mici din cât mai multe locuri posibil. Luați întotdeauna toate probele în același timp și, de preferință, după cea de-a doua picurare, în timpul ciclului lumină – zi – zi.
 În cazul substraturilor de sol, cocos și turbă, luați doar o cantitate mică de substrat din mai multe locuri.
În cazul substraturilor de sol, cocos și turbă, luați doar o cantitate mică de substrat din mai multe locuri.
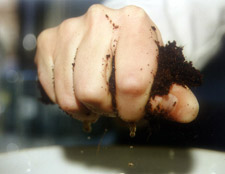
Puteți măsura cel mai bine aciditatea probei folosind metoda „extractului de volum 1:1,5”. Puteți face acest lucru cu ușurință chiar dvs. făcând mediul de cultură atât de umed încât apa să vă curgă printre degete atunci când este frământat și strâns destul de tare (foto 1). Folosiți, de exemplu, un pahar de măsurare de 250 ml. Umpleți paharul de măsurare până la 150 ml cu apă demineralizată. Adăugați mediul de cultură până când volumul ajunge la 250 ml (foto 2). Se agită bine și se lasă să stea câteva ore. Apoi filtrați-l și măsurați pH-ul.

Valorile corecte ale pH-ului pentru fiecare mediu
Când se cultivă în substrat, valorile pH-ului între 5,0 și 6,4 sunt bune pentru mediul radicular. Nu va exista niciun efect negativ dacă valorile sunt puțin mai mari sau mai mici. Efecte adverse imediate vor fi observate doar cu valori mai mici de 4 și mai mari de 8, o valoare a pH-ului mai mică de 4 cauzează adesea daune imediate rădăcinilor. În plus, metalele grele, inclusiv manganul și fierul, sunt absorbite atât de bine încât pot otrăvi planta (necroză). Valorile cuprinse între 7 și 8 nu sunt imediat dăunătoare pentru plantă. Substanțele nutritive, cum ar fi fierul, fosfatul și manganul, sunt mai puțin disponibile atunci, ceea ce va duce la deficiențe (cloroză și probleme de dezvoltare) pe termen lung.
Corectarea valorii pH-ului
 Dacă aciditatea din mediul radicular este între 5 și 6,4, atunci pH-ul mediului de cultură este în regulă și nu trebuie să luați nicio măsură corectivă. Încercați să evitați să corectați pH-ul decât dacă este cu adevărat necesar. Este mai probabil să faceți mai mult rău decât bine; plantei îi place liniștea și pacea. Este mai important să monitorizați modul în care se schimbă aciditatea pe o perioadă mai lungă de timp. Dacă valoarea scade sub pH 5 sau crește peste pH 6,4, atunci este recomandabil să începeți treptat să faceți ajustări.
Dacă aciditatea din mediul radicular este între 5 și 6,4, atunci pH-ul mediului de cultură este în regulă și nu trebuie să luați nicio măsură corectivă. Încercați să evitați să corectați pH-ul decât dacă este cu adevărat necesar. Este mai probabil să faceți mai mult rău decât bine; plantei îi place liniștea și pacea. Este mai important să monitorizați modul în care se schimbă aciditatea pe o perioadă mai lungă de timp. Dacă valoarea scade sub pH 5 sau crește peste pH 6,4, atunci este recomandabil să începeți treptat să faceți ajustări.
Corectarea acidității se face cel mai ușor prin scăderea acidității soluției de hrănire cu acid azotic în timpul fazei de creștere și cu acid fosforic în timpul fazei de înflorire sau, după caz, pentru a o crește cu potasă caustică, bicarbonat de sodiu și CANNA RHIZOTONIC. Asigurați-vă că pH-ul din soluția utilizată nu scade prea mult sub 5,0. Atunci când se cultivă în lână de stâncă, fibrele vor fi afectate, cauzând eliberarea unei cantități mari de material alcalin la valori foarte scăzute ale pH-ului. În plus, pH-ul este mai greu de controlat din cauza absenței bicarbonatului
Un pH ridicat în mediul radicular poate fi cauzat și de bicarbonatul care s-a acumulat. Pentru a remedia acest lucru, mențineți un drenaj de 20% sau clătiți cu o soluție mai acidă.
Este util să notați măsurătorile pH-ului atât de la soluția adăugată, cât și de la soluția de hrănire din substrat. Vă veți face o idee bună despre evoluția pH-ului și despre efectul măsurilor luate.
- Enzimele de scindare a proteinelor au nevoie de un mediu acid (sucuri gastrice), iar enzimele de scindare a carbohidraților au nevoie de un mediu alcalin (saliva).
- Aciditatea unei soluții este determinată de raportul dintre ionii de hidrogen (= acid) și ionii de hidroxid (= alcalin).
- Se pot produce carențe deoarece planta trebuie să secrete protoni pentru a putea absorbi aceste molecule. Un mediu de cultură cu un pH scăzut are deja o cantitate foarte mare de protoni. Aceste elemente sunt, de asemenea, clădite pentru că protonii resping moleculele din mediul din substrat.
- Bicarbonatul este substanța care, atunci când este combinată cu calciul, este responsabilă pentru calcar. În combinație cu sodiul, bicarbonatul este folosit în medicamente pentru a contracara excesul de acid gastric (Alka-seltzer).
- Câteva laboratoare lucrează, de asemenea, cu duritatea bicarbonatului. Pentru a traduce aceasta în mg/l bicarbonat trebuie să înmulțiți duritatea bicarbonatului cu 21,8.
De exemplu: duritatea bicarbonatului este 11, atunci 1 litru de apă conține (11 x 21.8=) 240 mg/litru de bicarbonat. -
Teritoriu nisipos: Teritoriu cu iarbă pH 4,6 … 5,2 Teritoriu cu construcții pH 5,0 … 5.6 Argila: Argila de mare pH 6,0 … 7,2 Argila de râu pH 6,2 … 6,4 Argila: Nu prelucrată pH 4.0 - Dacă există o creștere semnificativă a algelor, atunci pH-ul va crește deoarece dioxidul de carbon va fi eliminat din soluție. Bacteriile pot transforma anumite forme de azot astfel încât acestea să aibă un efect acidifiant. Cantitățile mari de CO2 din aer generează mai mult dioxid de carbon în soluția de hrănire și invers.
- Utilizați soda doar în cantități mici, deoarece conține sodiu, iar plantele au nevoie doar de o cantitate foarte mică de sodiu. Nu uitați, concentrațiile mari de sodiu vor afecta planta.
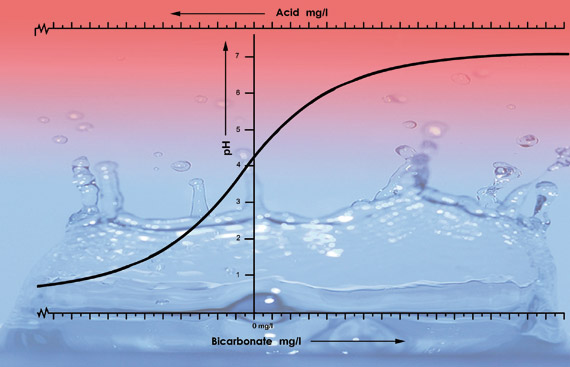
Ilustrație a valorilor pH-ului apei de la robinet din diferite zone cu niveluri diferite de bicarbonat. Am adăugat 33 ml de acid azotic (38%) la fiecare eșantion de 100 de litri din fiecare tip de apă. Curba pH-ului scade mai repede după pH 5,3, deoarece pentru acest tip de apă acidul neutralizează tot bicarbonatul. Sub pH 5,3, nivelul de aciditate se va accelera rapid.
În sistemele cu recirculare, valoarea pH-ului poate fluctua mai mult decât în sistemele de tip „run-to-waste”. Același lucru este valabil și pentru valoarea EC, ppm. Dacă doriți să aflați mai multe despre EC, pH și ppm, vă sfătuim să citiți articolul nostru Totul despre EC, pH și ppm folosind AQUA.
.