Diabet zaharat este costisitor, dar majoritatea costurilor sunt atribuite complicațiilor și îngrijirii spitalicești.1 Conform Asociației Americane de Diabet (ADA), în 2012, costul total estimat pentru diabet a fost de 245 miliarde de dolari.1 Se estimează că 43% a provenit din costurile de spitalizare în spital și încă 18% pentru rețete pentru gestionarea complicațiilor diabetului.1
Majoritatea acestor complicații pot fi prevenite cu un control țintit al glicemiei. Datele epidemiologice demonstrează că pentru fiecare punct procentual de scădere a hemoglobinei A1c (HbA1c), are loc o reducere cu 35% a riscului de complicații microvasculare.2 Vestea bună este că ratele complicațiilor în diabet au fost reduse,3 dar acest lucru a fost depășit de creșterea pur și simplu a numărului de persoane cu diabet care evoluează cu complicații.
Multe persoane cu diabet de tip 2 pot avea o complicație legată de diabet în momentul diagnosticului. Atât în cazul diabetului de tip 1, cât și al celui de tip 2, unele dintre complicații, cum ar fi retinopatia și nefropatia, sunt silențioase. Acest lucru necesită o abordare țintită agresivă, deoarece așteptarea simptomelor va fi prea târziu. Chiar și neuropatia diabetică va fi asimptomatică la până la 50% dintre persoanele cu anomalii măsurabile.4
Acest articol va trece în revistă recomandările din Standardele de îngrijire ADA 2017 pentru complicațiile microvasculare și declarațiile de poziție relevante și va evidenția screeningul preventiv și perlele clinice pentru medicul de îngrijire primară care tratează pacienții cu diabet.
- Retinopatia diabetică
- Tabel 1. Stadiile retinopatiei cu descrierea
- Clinical Pearls
- Diabet renal
- Tabel 2. Selectarea studiilor de referință care demonstrează controlul glicemic cu A1c sub 7%
- Tabel 3. GFR estimat cu stadiul și descrierea
- Tabelul 4. Categoriile de albuminurie în IRC
- Figura 1. Frecvența sugerată a evaluării (număr de ori pe an) în funcție de eGFR și categoria de albuminurie
- Tabel 5. Semnale de alarmă care sugerează o boală glomerulară nondiabetică
- Tabelul 6. Ajustarea dozelor și recomandări pentru agenții hipoglicemianți la pacienții cu insuficiență renală
- Clasa
- Medicamente
- Clinical Pearls
- Nevropatie periferică diabetică
- Tabelul 7. Alte cauze ale neuropatiei67
- Tabelul 8. Agenți farmacologici utilizați în mod obișnuit pentru DPN4,69
- Clinical Pearls
- Gastropareză
- Clinical Pearls
- Cheiroartropatia diabetică
- Concluzie
Retinopatia diabetică
Retinopatia diabetică este o complicație microvasculară comună a diabetului de tip 1 și de tip 2. Se estimează că 3,7 milioane de persoane la nivel mondial au o deficiență vizuală moderată până la severă din cauza retinopatiei diabetice, iar peste 800.000 de persoane din întreaga lume sunt oarbe din cauza retinopatiei diabetice.5 Este cea mai frecventă cauză de orbire nou apărută la adulții cu vârsta cuprinsă între 20 și 74 de ani.6 Au fost făcute corelații puternice cu controlul glicemiei, controlul tensiunii arteriale și durata bolii. Prin depistarea precoce, regulată și controlul acestor factori de risc, retinopatia diabetică poate fi detectată și tratată pentru a preveni afectarea vederii.
Durata diabetului este cel mai mare factor de risc pentru progresia retinopatiei diabetice. În cazul diabetului de tip 1, retinopatia este rară în primii 3-5 ani sau înainte de pubertate.7 În următorii 20 de ani, aproape toți pacienții cu diabet de tip 1 vor dezvolta retinopatie diabetică.7 La pacienții cu diabet de tip 2, până la 21% vor avea un anumit grad de retinopatie la momentul diagnosticului.7 Hiperglicemia cronică, nefropatia, hipertensiunea arterială și dislipidemia sunt alți factori care cresc riscul sau sunt asociați cu retinopatia diabetică.8 Până la 50% dintre pacienții cu albuminurie (indiferent de nivelul estimat al ratei de filtrare glomerulară) vor avea retinopatie.9 Tabelul 1 descrie diferitele stadii ale retinopatiei.
Tabel 1. Stadiile retinopatiei cu descrierea |
|
|
Stadiul |
Descriere |
|
Descriere |
|
|
Limpede Non-Proliferative Diabetic Retinopathy |
Microaneurisme prezente |
|
Moderate Non-Proliferative Diabetic Retinopathy |
Microaneurysms present |
|
Moderate Non-Proliferative Diabetic Retinopathy |
Microaneurysms, hemoragii retiniene pe puncte sau pete, exudate dure, sau pete de vată pot fi prezente |
|
Retinopatie diabetică nonproliferativă severă |
Hemoragii intraretiniene, perlaj venos, sau pot fi prezente anomalii microvasculare intraretiniene |
|
Retinopatie diabetică proliferativă |
Neovascularizare, hemoragii vitreale sau preretiniene prezente |
Pathophysiology. Anomaliile ușoare, neproliferative, caracterizate prin creșterea permeabilității vasculare pot evolua spre retinopatie diabetică neproliferativă (NPDR) moderată sau severă.7 Retinopatia diabetică proliferativă se caracterizează prin proliferarea de noi vase de sânge retiniene.7 Edemul macular, care reprezintă îngroșarea centrală a retinei cu exsudație și edem, se poate prezenta în orice stadiu al retinopatiei.7 Retinopatia diabetică poate fi accelerată de sarcină, pubertate, lipsa controlului glicemic, hipertensiune arterială și operația de cataractă.7
Prevenirea retinopatiei diabetice. Controlul glicemic este esențial pentru prevenirea retinopatiei diabetice. În cadrul studiului Diabetes Control and Complications Trial (DCCT), cercetătorii au evaluat efectul unui control strict al glicemiei și al progresiei de la o retinopatie inexistentă sau minimă la momentul inițial la o NPDR moderată.10 Pentru pacienții din grupul de terapie intensivă fără retinopatie la momentul inițial, riscul mediu de retinopatie a fost redus cu 76% în 36 de luni.10 În cazul pacienților din grupul de terapie intensivă care prezentau deja NPDR minimă sau moderată, riscul de progresie a fost redus cu 54% față de cei care au utilizat tratamentul convențional.10 În cadrul studiului original Action to Control Cardiovascular Risk in Diabetes (ACCORD), participanții cu diabet zaharat de tip 2 timp de 10 ani și cu boli cardiovasculare cunoscute au fost repartizați aleatoriu la terapie intensivă sau standard pentru glicemie, tensiune arterială sistolică și dislipidemie. Patru ani mai târziu, progresia retinopatiei a fost redusă la cei care au avut anterior un control intensiv al glicemiei, indiferent de nivelurile actuale similare de HbA1c.11 Efecte moștenite similare nu au fost observate în acele grupuri cu control intensiv al tensiunii arteriale sau cu fenofibrat pentru dislipidemie.11
Screening. Deoarece edemul macular și retinopatia diabetică proliferativă pot fi asimptomatice, screeningul este vital pentru depistarea și tratamentul precoce. Pentru pacienții cu diabet zaharat de tip 1, screeningul trebuie inițiat la cinci ani de la diagnosticare.8 Pentru cei cu diabet zaharat de tip 2, screeningul trebuie inițiat la diagnosticare.8 Screeningul trebuie efectuat de un oftalmolog sau optometrist cu experiență în retinopatia diabetică. Screeningul trebuie finalizat cu ochii dilatați. Dacă retinopatia este deja prezentă, se recomandă trimiterea la un oftalmolog.8 Evaluarea repetată trebuie făcută anual dacă se constată o boală minimă sau nu se constată nicio boală.8
Principiul sarcinii este o perioadă cu risc ridicat pentru retinopatia proliferativă. La femeile gravide cu diabet zaharat preexistent de tip 1 sau de tip 2, examinările oftalmologice trebuie efectuate înainte de concepție sau în primul trimestru. Examinările trebuie repetate în fiecare trimestru și timp de un an după naștere.8 Pentru cei cu diabet gestațional, nu sunt necesare examinări oftalmologice suplimentare după naștere.
Sarcina la pacienții cu diabet preexistent de tip 1 sau de tip 2 poate duce la o progresie rapidă a retinopatiei diabetice. Acest lucru este valabil mai ales dacă există un control glicemic deficitar în momentul concepției.14 Femeile cu diabet zaharat care sunt însărcinate sau care intenționează să rămână însărcinate trebuie să fie sfătuite cu privire la riscul de dezvoltare sau progresie a retinopatiei diabetice și la necesitatea controlului glicemic înainte de concepție.8 Cu toate acestea, o înrăutățire precoce a retinopatiei poate apărea odată cu implementarea rapidă a unui management intensiv al glicemiei, dacă retinopatia este deja prezentă.8 Diabetul gestațional nu pare să confere același risc de apariție a retinopatiei diabetice în timpul sarcinii.8
Tratament. În plus față de controlul glicemiei, s-a demonstrat că și controlul tensiunii arteriale (< 140 mmHg sistolică) diminuează progresia retinopatiei diabetice, dar nu există niciun beneficiu suplimentar al unui control strict al tensiunii arteriale sistolice < 120 mmHg.12 Fenofibratul poate, de asemenea, să încetinească progresia retinopatiei diabetice, în special cu NPDR foarte ușoară, la pacienții cu dislipidemie.13 S-a demonstrat că aspirina nu are niciun efect asupra progresiei retinopatiei, asupra apariției hemoragiei vitreene sau asupra duratei hemoragiei vitreene și poate fi utilizată în condiții de siguranță pentru alte indicații medicale fără compromitere oculară.7
Tratamentul pacienților cu diabet zaharat trebuie să includă recomandări de exerciții fizice. Cei cu retinopatie nonproliferativă ușoară pot începe activitatea fizică în condiții de siguranță. Cu toate acestea, pacienții cu retinopatie neproliferativă moderată trebuie să evite activitățile care cresc foarte mult tensiunea arterială, cum ar fi ridicarea de greutăți.15 Pacienții cu retinopatie neproliferativă severă sau instabilă trebuie să evite orice activitate fizică viguroasă (sărituri, zdruncinături), orice activitate cu capul în jos și reținerea respirației.15 În cazul hemoragiei vitreene, nu trebuie să se facă exerciții fizice.15
Detectarea precoce a retinopatiei diabetice este importantă deoarece tratamentul poate preveni sau inversa pierderea vederii. În cadrul Diabetic Retinopathy Study (DRS), cercetătorii au constatat că operația de fotocoagulare a fost un tratament eficient pentru retinopatia diabetică. Studiul privind retinopatia diabetică cu tratament precoce și DRS au arătat că fotocoagularea a scăzut riscul de pierdere a vederii, cu cel mai mare beneficiu la pacienții care prezentau o boală inițială mai avansată.16,17 Datele actuale oferă dovezi că agenții intravitreali ai factorului de creștere endotelială antivasculară (anti-VEGF) sunt mai eficienți în tratarea edemului macular decât monoterapia sau terapia combinată cu coagularea cu laser.8 În plus, anti-VEGF poate îmbunătăți vederea, în timp ce fotocoagularea previne doar pierderea ulterioară a vederii.18,19 Un dezavantaj al anti-VEGF este că necesită terapie intravitreană lunară în primele 12 luni.
Clinical Pearls
- Nu există semne sau simptome specifice ale retinopatiei diabetice precoce.
- Screeningul pentru retinopatia diabetică ar trebui să aibă loc la pacienții:
– cu diabet de tip 1 la cinci ani după diagnosticare.
– la pacienții cu diabet de tip 2 la diagnostic.
- Consiliere și examene sporite ar trebui oferite femeilor diabetice care plănuiesc să rămână sau rămân însărcinate, deoarece retinopatia diabetică se poate accelera rapid în timpul sarcinii.
- Controlul strict al glicemiei și controlul tensiunii arteriale (< 140 mmHg sistolică) pot preveni dezvoltarea retinopatiei diabetice.
- Până la 50% dintre pacienții cu albuminurie (indiferent de nivelul eGFR) vor avea retinopatie.9
- Tratamentul cu fotocoagulare poate preveni progresia bolii, iar tratamentul anti-VEGF poate inversa pierderea vederii din cauza edemului macular.
Diabet renal
Diabet renal (DKD), terminologia preferată de ADA, este principala cauză a bolii cronice de rinichi (CKD) în Statele Unite.20,21 DKD are efecte semnificative pe termen lung asupra calității vieții pacienților cu diabet și este responsabilă pentru până la 40% din cazurile de boală renală în stadiu terminal (ESRD).20 Pe baza Inițiativei de calitate a rezultatelor bolii renale (Kidney Disease Outcomes Quality Initiative – KDOQI) a Fundației Naționale a Rinichiului (National Kidney Foundation’s Kidney Foundation’s Kidney Disease Outcomes Quality Initiative – KDOQI) și a Standardelor de îngrijire ADA 2017, această secțiune va oferi îndrumări cu privire la nivelurile țintă de HbA1c, managementul medicației și tratamentul terapeutic pentru pacienții cu DKD.
KDOQI stratifică nivelul țintă de HbA1c în funcție de riscul de hipoglicemie și comorbidități al pacientului. Această inițiativă se bazează pe trei publicații care demonstrează că un control glicemic cu HbA1c sub 7% va preveni sau va diminua progresia bolii renale la pacienții cu diabet zaharat de tip 2.22,23,24 Aceste studii sunt rezumate în tabelul 2. ADA recomandă ca la pacienții cu risc crescut de hipoglicemie, obiectivul HbA1c să fie ridicat peste 7%.8 KDOQI recomandă ca pacienții cu IRC stadiul 4 și 5 care au o speranță de viață limitată să mențină o HbA1c mai mare de 7%.25
Tabel 2. Selectarea studiilor de referință care demonstrează controlul glicemic cu A1c sub 7% |
|
|
Trial |
Rezultate |
|
Acțiune în diabet și boli vasculare: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% reducere nouă macroalbuminurie și terapie de substituție renală cu A1c sub 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% reducere macroalbuminurie și 32% reducere a microalbuminuriei cu A1c sub 7% |
|
Studiul Action to Control Cardiovascular Risk in Diabetes (ACCORD)24 |
Reducere cu 2% a macroalbuminuriei și cu 21% a microalbuminuriei cu A1c sub 7% |
Epidemiologie. Bărbații și femeile sunt afectați în mod egal de DKD.20 Incidența maximă pentru dezvoltarea DKD este la 15 ani după diagnosticare.21 Afroamericanii au o probabilitate de trei până la cinci ori mai mare de a dezvolta nefropatie diabetică decât caucazienii.20 Mexicanii americani și indienii Pima au, de asemenea, un risc mai mare de a dezvolta DKD.20
Proteinuria este un predictor al morbidității cardiovasculare și al mortalității din toate cauzele în diabet.21 Prezența DKD este un factor de creștere a riscului de boală cardiovasculară. Pacienții cu DKD se confruntă în mod constant cu rate mai mari de mortalitate din cauza bolilor cardiovasculare.26 În plus, mortalitatea din toate cauzele este mai mare la pacienții cu DKD.21
În cazul diabetului de tip 1, complicațiile microvasculare, cum ar fi DKD, încep să se dezvolte la aproximativ 10-20 de ani de la diagnosticare; în cazul diabetului de tip 2, debutul exact este adesea necunoscut și, prin urmare, justifică un screening mai precoce.27
Fiziopatologie și patogeneză. Se consideră că hiperglicemia induce trei modificări histologice majore la nivelul glomerulilor care duc la DKD: 1) expansiunea mezangială, 2) îngroșarea membranei bazale glomerulare și 3) scleroza glomerulară.28 Deși patogeneza exactă a motivelor pentru care apare DKD este necunoscută, se crede că hiperglicemia provoacă inițial hiperfiltrare și leziuni renale ca urmare a modificărilor histologice și a activării citokinelor.20 În mod obișnuit, albuminuria poate fi primul semn al DKD.29
Aceasta este exacerbată și mai mult ca urmare a condițiilor comorbide de hiperlipidemie, arterioscleroză, hipertensiune arterială și obezitate, care toate contribuie la leziuni renale și la declinul ulterior al funcției. Obezitatea centrală duce la hipertensiune arterială prin hiperactivarea sistemului renină-angiotensină-aldosteron și a sistemului nervos simpatic.20 Mai mult, pe măsură ce vasculatura renală devine arteriosclerotică, are loc o progresie crescută a nefropatiei diabetice. O trăsătură distinctivă importantă a nefropatiei diabetice în comparație cu alte forme de IRC este faptul că glomerulii și rinichii sunt de obicei normali sau de dimensiuni crescute inițial.20
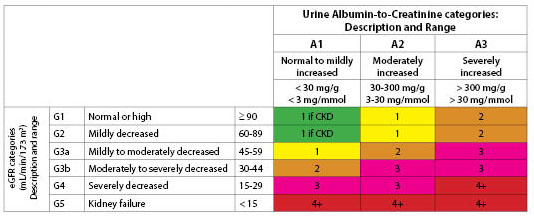
Clasificare. Atât eGFR cât și prezența albuminuriei sunt utilizate pentru a stadializa IRC.30,31 eGFR se bazează pe rasă, vârstă, sex, greutate și nivelul creatininei serice. (A se vedea tabelul 3.) Din punct de vedere istoric, termenul de microalbuminurie a fost utilizat pentru a defini nivelurile moderat crescute de albumină. Fundația Națională a Rinichiului recomandă acum utilizarea termenilor „ușoară”, „moderată” sau „sever crescută” pentru a descrie nivelurile de albuminurie pe baza nivelurilor descrise în tabelul 4.31 Raportul albumină-creatinină este testul inițial utilizat pentru a detecta albuminuria.
Tabel 3. GFR estimat cu stadiul și descrierea |
||||
|
Stadiul |
GFR (ml/min per 1.73 m2) |
Descriere |
||
|
90+ |
Hiperfiltrare glomerulară |
|||
|
Funcție renală ușor redusă |
||||
|
3A |
Funcție renală moderat redusă |
|||
|
3B |
||||
|
Funcție renală sever redusă |
||||
|
< 15 sau în dializă |
Final-insuficiență renală în stadiu terminal |
|||
Tabelul 4. Categoriile de albuminurie în IRC |
|||
|
Categoria |
Albuminuria în CKD |
Albumin-to-Creatinină |
Descriere |
|
A1 |
< 30 |
< 30 |
Normal până la ușor crescut |
|
A2 |
Moderat crescut |
||
|
A3 |
> 300 |
Sănătos crescut |
|
Cele două scheme de clasificare reprezintă calea dublă de dezvoltare a IRC. Una este prin creșterea creatininei și înrăutățirea GFR. Cealaltă este prin dezvoltarea albuminuriei. Creșterea albuminuriei este adesea urmată de o scădere a eGFR;32 totuși, acest lucru poate fi evitat prin utilizarea inhibitorilor enzimei de conversie a angiotensinei (IECA) sau a blocantelor receptorilor de angiotensină (BRA) și prin controlul glicemiei. (A se vedea figura 1.)
Figura 1. Frecvența sugerată a evaluării (număr de ori pe an) în funcție de eGFR și categoria de albuminurie
Reprodus cu permisiunea Kidney Disease: Improving Global Outcomes (KDIGO).
Simptome comune. Majoritatea oamenilor nu au simptome de nefropatie diabetică. Adesea, pacienții pot avea dovezi sau diagnosticul altor complicații microvasculare.20 DKD precoce este de obicei asimptomatică. O constatare tardivă a DKD este urina spumoasă. Mai mult, dacă un pacient este sever hipoalbuminemic, el sau ea poate prezenta edeme pedale și oboseală.20 Pacienții cu DKD au de obicei hipertensiune arterială sistemică. Pacienții cu nefropatie diabetică vor prezenta de obicei și retinopatie și neuropatie.8
Opțiuni de diagnosticare. Deoarece nu există simptome, screeningul de rutină este critic. ADA recomandă depistarea anuală a raportului albumină-creatinină urinară.8 În plus, cel puțin o dată pe an, trebuie testat eGFR-ul la pacienții cu diabet de tip 1 cu o durată de cinci ani și în rândul tuturor pacienților cu diabet de tip 2 sau la pacienții cu hipertensiune arterială și diabet comorbid.8 Nu există o recomandare clară pentru obținerea de imagini, cum ar fi o ecografie, pentru diagnosticul DKD.
Diagnostic diferențial. Unele semnale de alarmă pot sugera că diabetul nu este singura cauză a IRC. Dacă o persoană are o IRC avansată fără dovezi de alte complicații microvasculare, acesta este un avertisment. Proteinuria manifestă cu apariția bruscă (la mai puțin de cinci ani de la debutul diabetului) a unui sediment urinar cu globule roșii dismorfice și mulaje, sau o scădere bruscă a GFR, sugerează o boală renală de etiologie non-diabetică.20 Se poate face o electroforeză serică sau urinară dacă există o preocupare pentru mielom multiplu. Absența albuminuriei cu un eGFR redus și diabet zaharat necesită investigarea pentru alte cauze de IRC decât DKD.21 Tabelul 5 enumeră stegulețele roșii care sugerează o boală glomerulară non-diabetică.
Tabel 5. Semnale de alarmă care sugerează o boală glomerulară nondiabetică
- Debutul proteinuriei < la 5 ani de la debutul documentat al diabetului zaharat de tip 1 sau de la debutul acut al bolii renale
- Declin acut al eGFR; nefropatie diabetică
- Sediment urinar care conține globule roșii dismorfice sau mulaje celulare
- Absența altor complicații microvasculare, cum ar fi neuropatia sau retinopatia
- Semne și/sau simptome ale unei alte boli sistemice
Tratament. Un semn distinctiv al diabetului nefropatic este managementul glucozei, reducerea sării, a tensiunii arteriale și a dislipidemiei. În plus, pacienții trebuie să evite medicamentele și suplimentele nefrotoxice, cum ar fi aminoglicozidele și antiinflamatoarele nesteroidiene. Pacienții trebuie să fie trimiși la un nefrolog în stadiul IV al bolii renale sau dacă apare o scădere rapidă a funcției renale. Alte indicații de trimitere depind de complexitatea cazului. Noile medicamente orale mai noi pentru diabet pot ajuta la prevenirea progresiei insuficienței renale.
Controlul glicemic. Selecția, monitorizarea și farmacologia medicamentelor, toate sunt afectate la pacienții cu nefropatie diabetică. Pe măsură ce eGFR-ul unui pacient scade, unii agenți orali vor necesita ajustarea dozei. Insulina rămâne terapia centrală pentru controlul glucozei la pacienții cu diabet zaharat și IRC avansată.31 Tabelul 6 prezintă ajustările de doză recomandate pentru medicamentele antiglicemiante la pacienții cu boală renală. În 2016, s-a demonstrat că atât empagliflozina, cât și canagliflozina au redus progresia IRC și microalbuminuria.33,34 Empagliflozina a scăzut ratele de progresie a nefropatiei și a redus riscul de evenimente cardiovasculare adverse majore comparativ cu placebo, atunci când a fost adăugată la tratamentul standard al diabetului de tip 2 în cadrul studiului de referință Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabelul 6. Ajustarea dozelor și recomandări pentru agenții hipoglicemianți la pacienții cu insuficiență renală |
||
|
Glucoza-agenți de scădere a glucozei |
Ajustări ale dozelor în insuficiența renală |
|
Clasa |
Medicamente |
|
|
Biguanide |
Metformină |
eGFR 30 până la 45 ml/min/1.73 m2: Nu se recomandă inițierea tratamentului. Dacă după inițiere, se evaluează beneficiile/riscurile continuării terapiei. eGFR < 30 ml/min/1,73 m2: Utilizarea este contraindicată |
|
Sulfoniluree |
Glimepirida |
Insuficiență ușoară până la moderată: Se inițiază la 1 mg o dată pe zi Insuficiență severă: Utilizarea este contraindicată |
|
Glipizidă |
Liberare prelungită: Se inițiază la 2,5 mg o dată pe zi |
|
|
Glyburide |
eGFR < 60 ml/min/1,73 m2: Nu se recomandă utilizarea |
|
|
Meglitinide |
Nateglinidă |
Nu necesară ajustarea dozei |
|
Repaglinidă |
CrCl 20 până la 40 ml/min: Se inițiază la 0.5 mg la mese CrCl < 20 mL/min: Nu există informații |
|
|
Thiazolidinedionate |
Pioglitazonă |
Nici o ajustare a dozei. necesară |
|
Rosiglitazona |
Nu este necesară ajustarea dozei |
|
|
α-Inhibitori de glucozidază |
Acarboză |
SCr > 2.0 mg/dL: Nu se recomandă utilizarea |
|
Miglitol |
CrCl < 25 ml/min sau SCr >2.0 mg/dL: Nu se recomandă utilizarea |
|
|
Inhibitori DPP-4 |
Alogliptin |
CrCl 30 până la 60 mL/min: 12.5 mg o dată pe zi CrCl < 30 mL/min: 6,25 mg o dată pe zi RDS care necesită hemodializă: 6.25 mg o dată pe zi și se administrează fără a se ține seama de momentul hemodializei |
|
Linagliptin |
Nu este necesară ajustarea dozei |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg o dată pe zi IRS care necesită hemodializă: 2.5 mg o dată pe zi și se administrează după hemodializă |
|
|
Sitagliptin |
CrCl 30 până la 50 mL/min: 50 mg o dată pe zi CrCl < 30 mL/min: 25 mg o dată pe zi IRS care necesită hemodializă sau dializă peritoneală: 25 mg o dată pe zi și se administrează fără a se ține cont de momentul hemodializei |
|
|
Vildagliptin |
CrCl < 50 mL/min: 50 mg o dată pe zi |
|
|
Sechestranți ai acizilor biliari |
Colesevelam |
Nu sunt necesare ajustări ale dozei |
|
Dopamina…2 agoniști |
Bromocriptină |
Nicio informație |
|
Inhibitori SGLT-2 |
Canagliflozin |
eGFR 45 până la 60 ml/min/1.73 m2: A nu se depăși 100 mg o dată pe zi eGFR < 45 ml/min/1,73 m2: Nu se recomandă inițierea tratamentului. Dacă după inițiere, întrerupeți tratamentul pentru pacienții cu eGFR persistent < 45 ml/minut/1,73 m2. eGFR < 30 ml/min/1,73 m2/IRD/hemodializă: Utilizarea este contraindicată |
|
Dapagliflozin |
eGFR < 60 ml/min/1,73 m2: Nu se recomandă inițierea tratamentului. Dacă după inițiere, întrerupeți tratamentul pentru pacienții cu eGFR persistent între 30 și < 60 ml/min/1,73 m2. eGFR < 30 ml/min/1,73 m2/IRD/hemodializă: Utilizarea este contraindicată |
|
|
Empagliflozin |
eGFR < 45 mL/min/1,73 m2: Nu se recomandă inițierea tratamentului. Dacă după inițiere, întrerupeți tratamentul pentru pacienții cu eGFR persistent < 45 ml/min/1,73 m2. eGFR < 30 ml/min/1,73 m2. IDRS/ Hemodializă: Utilizarea este contraindicată |
|
|
GLP-.1 receptori agoniști |
Albiglutida |
Nu este necesară ajustarea dozei |
|
Dulaglutidă |
Nu este necesară ajustarea dozei |
|
|
Exenatidă |
CrCl 30 până la 50 ml/min: Nu există informații. A se utiliza cu prudență. CrCl < 30 mL/min/ ESRD: Nu se recomandă utilizarea |
|
|
Liraglutidă |
Nu există informații |
|
|
Lixisenatidă |
eGFR 15 până la 29 ml/min/1.73 m2: Nu există informații. A se monitoriza pentru creșterea efectelor adverse gastro-intestinale care pot duce la deshidratare și înrăutățirea funcției renale. eGFR <15 mL/min/1.73 m2/ ESRD: Nu se recomandă utilizarea |
|
|
Amylin mimetice |
Pramlintide |
CrCl ≥15 mL/min: Nu este necesară ajustarea dozei ESRD: Nu există informații |
|
Insuline |
Rapid.analogi cu acțiune rapidă
Insulină cu acțiune rapidă
Insulină intermediară-acțiune
Analogi bazali ai insulinei
|
Nevoile de insulină pot fi reduse datorită modificărilor în clearance-ul sau metabolismul insulinei. Monitorizați îndeaproape glicemia. |
Tensiunea arterială. Tratamentul pentru tensiunea arterială ar trebui să înceapă la 140/90 mmHg pentru pacienții cu diabet și boală renală diabetică.37 United Kingdom Prospective Diabetes Study (UKPDS) a constatat o reducere cu 12% a riscului de complicații diabetice cu fiecare scădere cu 10 mmHg a tensiunii sistolice până când presiunea a fost de 120 mmHg.38 Medicamentele de elecție rămân inhibitorii ECA sau BRA pentru persoanele cu hipertensiune arterială și diabet, DKD și CKD. S-a demonstrat că inhibarea ACE întârzie apariția DKD atunci când este inițiată la pacienții cu albuminurie ușor crescută. Creatinina poate urca cu până la 30% la inițierea unui inhibitor ECA sau BRA.39 Luați în considerare evaluarea altor boli renale subiacente dacă creatinina crește mai mult decât atât.
KDOQI recomandă să nu se administreze IECA/RAB la pacienții cu diabet zaharat de tip 2 care sunt normotensivi și la pacienții normoalbuminurici.40,41,42 Inhibitorii ECA sau BRA sunt sugerate pentru pacienții cu diabet care sunt normotensivi cu microalbuminurie. 31,37 Nu există o doză sau o titrare specifică pentru aceste persoane. Nu se recomandă blocarea dublă a sistemului renină-angiotensină atât prin ACE cât și prin BRA din cauza riscului crescut de hiperkaliemie, alterarea funcției renale și hipotensiune arterială.43
Reducerea sării. Studiile 2012 Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial și Irbesartan Diabetic Nephropathy Trial (IDNT) au demonstrat că dietele sărace în sodiu au crescut efectele nefroprotectoare și cardioprotectoare ale ARB la pacienții cu diabet zaharat de tip 2 și nefropatie diabetică.44,45
Dializă renală și transplant renal. Pacienții cu ESRD trebuie să fie trimiși la nefrologie. Opțiunile de tratament includ dializa peritoneală sau hemodializa, transportul renal sau opțiunea de a întrerupe tratamentul și de a începe îngrijirea paliativă sau hospice. Un studiu observațional a constatat că pacienții care au început dializa la o vârstă mai tânără (< 60 de ani) au avut o supraviețuire mai slabă.46
Referire. Figura 1 include indicațiile de trimitere pe baza clasificării GFR și a albuminuriei. Luați în considerare alte cauze ale bolii renale care nu sunt legate de diabet, în special la pacienții cu diabet de tip 1, unde apariția retinopatiei nu precede dezvoltarea nefropatiei.21 Nefrologii pot ajuta la clarificarea diagnosticului, la controlul hipertensiunii rezistente și al hiperkaliemiei și la pregătirea pacienților pentru dializă.8
De asemenea, trebuie să se ia în considerare faptul că dezvoltarea nefropatiei poate să nu fie legată de diabetul în sine. La pacienții cu diabet zaharat de tip 1, apariția retinopatiei precede de obicei dezvoltarea nefropatiei.47 O persoană care prezintă nefropatie, dar nu și retinopatie, ar trebui să fie evaluată pentru alte cauze. Ar trebui să se facă trimitere la un nefrolog pentru a stabili cauza nefropatiei atunci când aceasta este incertă sau când există probleme legate de DKD greu de gestionat, inclusiv anemie, hiperparatiroidism și boală renală în progresie cu un eGFR < 30 ml/min/1,73 m2.8 A avea un nefrolog consultant atunci când apare CKD în stadiul 4 (eGFR < 30 ml/min/1,73 m2) este asociat cu scăderea morbidității, scăderea costurilor cu asistența medicală și dializa întârziată.48 Luați în considerare o trimitere la stadiul 3B pentru a pregăti pacienții mai devreme și pentru ca nefrologia să trateze medical la maximum.
Clinical Pearls
- Screeningul anual pentru DKD ar trebui să aibă loc prin testarea albuminei urinare și o măsurare a eGFR.
- Controlul tensiunii arteriale și al glucozei poate asigura prevenirea progresiei nefropatiei. Mențineți tensiunea arterială < 140/90 mmHg la pacienții cu diabet și IRC. Inhibitorii ECA sau BRA trebuie să fie tratamentul de elecție.
- Inhibitorii ECA și BRA nu trebuie utilizați pentru a preveni nefropatia dacă tensiunea arterială și excreția de proteine sunt normale. Inhibitorii ECA și BRA nu trebuie utilizați în asociere.
- Pacienții cu IRC în stadiile 3-5 au un risc crescut de hipoglicemie. Trebuie utilizată prudență cu agenți administrați pe cale orală, cum ar fi sulfonilureele.
- La unii pacienți cu IRC, este adecvat să se stabilească ținta HbA1c > 7%, în special atunci când riscul de hipoglicemie este mare.
Nevropatie periferică diabetică
O definiție larg acceptată a neuropatiei periferice diabetice (DPN) în practica clinică este „prezența simptomelor și/sau a semnelor de disfuncție a nervilor periferici la persoanele cu diabet zaharat după excluderea altor cauze”.”49 Clasificarea ADA a polineuropatiei distale simetrice este: 1) neuropatie cu fibre mici în principal, 2) neuropatie cu fibre mari în principal și 3) neuropatie mixtă cu fibre mici și mari (cea mai frecventă).
Pathophysiology and Pathogenesis. Dezvoltarea și progresia DPN decurg din relațiile complexe dintre nervi și celulele care îi înconjoară. 50 Atât factorii vasculari, cât și interacțiunile metabolice contribuie la toate etapele DPN. 51 Înțelegerea general acceptată în cazul diabetului uman care duce la dezvoltarea DPN este interacțiunea complexă dintre hiperglicemie, durata diabetului, leziunile neuronale legate de vârstă, gradele de control al tensiunii arteriale și al lipidelor din sânge, precum și greutatea.52,53,54,55 Hiperglicemia activează numeroase căi biochimice care determină starea metabolică a unei celule nervoase și se combină cu afectarea perfuziei nervoase, contribuind la progresia neuropatiilor. Un studiu de referință, DCCT, susține importanța hiperglicemiei în patogeneza neuropatiei.10,56,57 Un alt mecanism legat de hiperglicemie care duce la DPN este stresul oxidativ și nitrozativ indus de hiperglicemie, cu o creștere a producției de radicali liberi.58,59
În plus față de hiperglicemie, s-a sugerat recent că inflamația de grad scăzut ar putea juca un rol important în patogeneza neuropatiilor diabetice, conducând la deficite la nivelul fibrelor nervoase periferice și autonome.51,60 Ansamblul complex de factori metabolici și vasculari declanșează dezechilibrul dintre leziuni și reparații în fibrele nervoase, afectând în mod specific fibrele senzoriale distale și contribuind la pierderea treptată a senzației care manifestă simptomele clinice ale polineuropatiei diabetice.58,61
Simptome comune. Atunci când vă întrebați despre simptomele de DNP experimentate, notați localizarea (cel mai probabil resimțite la mâini și picioare), factorii precipitanți, caracteristicile disconforturilor, precum și debutul și frecvența exacerbării nocturne, deoarece simptomele sunt specifice pacientului.4 Atât fibrele mici, cât și cele mari sunt afectate de glicemia crescută, iar simptomele experimentate variază în funcție de clasa de fibre senzoriale afectate. Atunci când fibrele nervoase afectate sunt predominant mici, simptomele declanșate sunt, de obicei, durere (înțepături, lancinante, înțepături, arsuri, dureri, plictiseală și sensibilitate excesivă), disestezii (senzații neplăcute de arsură, furnicături, înțepături și înțepături) și amorțeală.4
Intensitatea disconfortului poate varia de la senzația de senzații anormale minore până la a fi invalidat de durerea care poate fi exacerbată noaptea și perturbarea somnului, care s-a dovedit a fi asociată cu depresia din cauza percepției de scădere a calității vieții.4
Pe de altă parte, atunci când sunt afectate predominant fibrele mari, pacienții ar putea să simtă amorțeală și furnicături la nivelul extremităților, să aibă un mers instabil și să-și piardă echilibrul (ceea ce duce la potențiale căderi).4 Unii pacienți ar putea experimenta înrăutățirea simptomelor pe măsură ce nivelul glicemiei scade din cauza intensificării managementului terapeutic al diabetului. Pacienții ar putea fi asimptomatici, dar cu diferite grade de pierdere senzorială; un rezultat nedorit al pierderii senzoriale severe datorate neuropatiei diabetice poate fi rănirea nedureroasă, ceea ce duce la un risc crescut de ulcerație a piciorului sau, în cazuri grave, amputare.62
Cea mai frecventă formă de neuropatie periferică diabetică este polineuropatia distală simetrică cu o pierdere progresivă a fibrelor nervoase senzoriale.4 Modelul tipic de „ciorap” bilateral este creat de leziunile care apar pe porțiunile cele mai distale ale nervilor cei mai lungi (fiind afectați primii).63,64,65 Pe măsură ce timpul progresează, un model de „mănușă de ciorap”, favorizând pierderea senzorială și simptomele tipice ale DNP, rezultă din continuarea proximală a deficitelor nervoase.4
Diagnostic clinic. Diagnosticul clinic al DNP poate fi pus pe baza semnelor și simptomelor neuropatice ale unui pacient cu diabet zaharat, după excluderea altor cauze de neuropatie.66 Neuropatia periferică diabetică asimptomatică poate apărea la până la 50% dintre cei care au această complicație; prin urmare, punerea în aplicare a îngrijirii preventive a picioarelor este esențială, în special pentru cei care prezintă un risc ridicat de leziuni din cauza picioarelor insensibile.4 Screeningul anual pentru DPN trebuie efectuat la toți pacienții cu diabet zaharat prin înțepături cu acul, temperatură, percepția vibrațiilor (folosind un diapazon de 128-Hz), senzația de presiune a monofilamentului de 10 g și reflexele profunde ale tendonului gleznei; potențialele ulcere ale piciorului pot fi prezise prin pierderea senzației monofilamentului de 10 g (pierderea senzației de protecție) și o percepție redusă a vibrațiilor.63 Standardele de îngrijire medicală în diabet-2017 ale ADA continuă să recomande un test monofilament 10-g anual în scopul identificării pacienților cu risc de a dezvolta ulcerații și amputații.8 În plus, ghidurile ADA din 2017 recomandă depistarea DPN la diagnosticarea diabetului de tip 2 și la cinci ani după diagnosticarea diabetului de tip 1.8
În 2009, Toronto Consensus Panel on Diabetic Neuropathies a actualizat criteriile de diagnostic pentru a oferi categorii de diagnostic. În plus, mai multe instrumente de screening bine validate pot fi incluse de către furnizorii de asistență medicală în procesul de diagnosticare, inclusiv Michigan Neuropathy Screening Instrument (MNSI), Toronto Clinical Neuropathy Score și Utah Neuropathy Scale. Tabelul 7 descrie alte cauze de neuropatie care trebuie excluse.
Tabelul 7. Alte cauze ale neuropatiei67
- Alcool sau alte toxine
- Medicamente neurotoxice, în special chimioterapia
- Deficiență de vitamina B12
- Hipotiroidism
- Boală renală
- Malignități (mielom multiplu, carcinom bronhogenic)
- Virusul imunodeficienței umane (HIV)
- Nevropatie inflamatorie cronică demielinizantă, neuropatii ereditare și vasculită
Studii de diagnosticare. Există mai multe teste de diagnostic pentru a confirma prezența DPN. Studiile de conducere nervoasă au fost considerate de ani de zile ca fiind testul de diagnostic standard de aur pentru DPN, datorită măsurătorilor lor obiective fără răspunsurile pacienților, ceea ce duce la o fiabilitate ridicată.4 Testarea senzorială cantitativă evaluează abilitățile pacienților de a detecta atingerea ușoară, vibrațiile și discriminarea temperaturii, implicând un anumit nivel de subiectivitate.4 Alte metode, inclusiv biopsia cutanată și densitatea fibrelor nervoase intraepidermice și microscopia confocală corneană, nu au fost utilizate în mod curent în practica clinică, dar pot fi utilizate în studiile clinice.4
Opțiuni de tratament: Tratament farmacologic. Tratamentul farmacologic al DPN are ca scop ameliorarea simptomatică, astfel încât medicamentele utilizate nu sunt menite să prevină progresia. Tabelul 8 rezumă medicamentele din cele trei clase cel mai frecvent utilizate (anticonvulsivante, antidepresive și opioide) pentru a controla simptomele neuropatice. Deși mai mulți agenți sunt utilizați în mod obișnuit ca abordare inițială pentru gestionarea DPN, doar pregabalina și duloxetina au fost aprobate de FDA pentru gestionarea acestei afecțiuni; astfel, oricare dintre acești agenți este recomandat ca alegere inițială pentru durerea neuropatică simptomatică.4 Gabapentina, deși nu este aprobată de FDA pentru a fi utilizată în gestionarea DPN, este adesea utilizată ca abordare inițială, care are o eficacitate comparativă cu agenții aprobați de FDA. Antidepresivele triciclice (de exemplu, amitriptilina) – agenți neaprobați de FDA pentru DPN – sunt eficiente în gestionarea DPN, dar trebuie utilizate cu prudență din cauza unui risc mai mare de efecte secundare.
Tabelul 8. Agenți farmacologici utilizați în mod obișnuit pentru DPN4,69 |
|||||||
|
Agent farmaceutic (intervalul NNT 30-50% ameliorare*) |
Doza zilnică maximă pentru DNP (mg/zi) |
Efecte secundare frecvente |
Efecte secundare frecvente |
Este necesară ajustarea dozei? |
Contraindicații |
Considerații privind prescrierea |
|
|
Anticonvulsivante
|
|||||||
|
Pregabalin (3.3-8,3) |
Vârtej Somnolență Creștere în greutate Edem periferic Vedere încețoșată Constipație |
Renală: Da Hepatică: Nu |
Hipersensibilitate la pregabalină |
Evidențe solide; aprobat de FDA; substanță controlată |
|||
|
Gabapentin (3.3-7.2) |
3,600 |
Vărsături Ataxie Somnolență Dureri de cap Naza Diarreea Creștere în greutate |
Renal: Da Hepatic: Nu |
Hipersensibilitate la gabapentin |
Evidență moderată; nu este aprobat de FDA |
||
|
Antidepresive
|
|||||||
|
Amitriptilina (2.1-4.2) |
Sedare severă; confuzie; efecte anticolinergice (constipație, vedere încețoșată) |
Renală: Nu Hepatic: Nu Se recomandă doze mai mici la pacienții vârstnici |
Hipersensibilitate la amitriptilină; administrarea concomitentă sau în decurs de 14 zile cu MAO; administrarea concomitentă cu cisapridă; faza acută de recuperare după infarctul miocardic |
Evidențe moderate; nu este aprobat de FDA; a se utiliza cu prudență pentru cei cu antecedente de boli cardiovasculare |
|||
|
Duloxetină (3.8-11) |
(S.U.A.) |
Nausee; sedare; somnolență generalizată |
Renală: Da Hepatică: A se evita utilizarea în caz de insuficiență hepatică |
Hipersensibilitate; coadministrare cu sau în decurs de 14 zile cu MAO; inițiere la cei care primesc linezolid sau albastru de metilen IV |
Evidență moderată; aprobat de FDA; poate fi adăugat la pregabalină sau gabapentin |
||
|
Venlafaxină (5.2-8.4) |
Nausee; sedare; somnolență generalizată |
Renală: Da Hepatică: Da |
Dovezile sunt slabe; nu este aprobat de FDA; poate fi adăugat la gabapentin |
||||
|
Opioide
|
|||||||
|
Tramadol (2.1-6.4) |
Somnolență Nausee Vomitoze Constipație Constipație Grețuri ușoare Amețeli Dureri de cap |
Renal: Da Hepatic: Nu |
Hipersensibilitate la tramadol, opioide sau la oricare dintre componentele formulării; Formulare RE: depresie respiratorie semnificativă și astm acut sau sever; Formulare IR: intoxicație acută cu alcool, hipnotice, narcotice, analgezice cu acțiune centrală, opioide sau medicamente psihotrope |
Potențial scăzut de abuz (substanță controlată din Lista IV); nerecomandată pentru utilizare ca agent de primă sau a doua linie |
|||
|
Tapentadol (N/A) |
Liberare imediată: Liberare prelungită: |
Somnolență Nausee Vomitoze Constipație Vărsături |
Renală: Nu se recomandă utilizarea când Hepatic: Nu |
Hipersensibilitate la tapentadol; depresie respiratorie semnificativă; asm acut sau sever; ileu paralitic; în termen de 14 zile de la utilizarea inhibitorilor MAO |
aprobat de FDA; substanță controlată din Lista II; nerecomandată pentru utilizare ca agent de primă sau a doua linie |
||
|
Informațiile se referă la agenții farmaceutici obținute din prospectele respective (la care se face referire prin denumirile comerciale) |
|||||||
Ghidul American Academy of Neurology (AAN) recomandă următorii agenți topici: capsaicină și dinitrat de izosorbid dinitrat spray (dovezi moderate) și plasturele Lidoderm (dovezi slabe).69 Oxcarbazepina, lamotrigina, lacosamida, clonidina, pentoxifilina și mexiletina nu sunt recomandate în ghidul AAN în tratarea DPN.69
În plus, opioidele au fost recomandate de unii pentru a fi utilizate în DPN refractară. Opioidele recomandate de ghidul AAN includ dextrometorfanul (400 mg/zi), sulfatul de morfină (titrat până la 120 mg/zi) și oxicodona (medie 37 mg/zi, maxim 120 mg/zi); cu toate acestea, nu există date suficiente pentru a sugera utilizarea unui agent în detrimentul celuilalt.69 Autorii acestui articol recomandă utilizarea opioidelor doar în cazurile severe refractare, cu o monitorizare atentă a pacienților care obțin o îmbunătățire funcțională reală cu ajutorul opioidelor. Autorii urmează declarația de poziție din 2016 a Centrelor pentru Controlul și Prevenirea Bolilor, conform căreia opioidele au o utilizare limitată pe termen lung în durerea de tip non-canceros.70
Una dintre provocările în tratamentul farmacologic al DPN este reprezentată de studiile inadecvate de tip head-to-head care încorporează rezultatele privind calitatea vieții.4 Un studiu recent care a comparat un tratament de opt săptămâni între pregabalină în doză mare, duloxetină în doză mare sau în combinație nu a constatat diferențe semnificative în ceea ce privește modificarea medie a durerii între monoterapie și terapia combinată.71 Sunt necesare mai multe studii care să compare doi agenți activi pentru a oferi informații pentru îmbunătățirea îngrijirii celor care suferă de neuropatie periferică diabetică.
Tratament non-farmacologic. Proceduri. Ghidul RNA sugerează luarea în considerare a stimulării electrice percutanate a nervilor timp de trei până la patru săptămâni pentru tratamentul DPN.69 Un studiu pilot, cu două stiluri de acupunctură, randomizat și controlat72 și un studiu randomizat, cu un singur orb, controlat cu placebo73 , care evaluează eficacitatea acupuncturii în DPN, ambele au arătat îmbunătățiri ale măsurilor de rezultat asociate cu durerea. Cu toate acestea, sunt necesare studii suplimentare pentru a confirma rolul acupuncturii în managementul DPN.
Acid alfa-lipoic. Unele dovezi sugerează că utilizarea acidului alfa-lipoic antioxidant ar putea ajuta la reducerea stresului oxidativ mediat de radicalii liberi și ar putea oferi următoarele beneficii: țintirea patogenezei, încetinirea dezvoltării și ameliorarea simptomelor de DPN.74,75
Prevenție. S-a demonstrat că modificările stilului de viață, care se concentrează pe o dietă sănătoasă și pe activitatea fizică, au demonstrat în mod continuu scăderea prevalenței diabetului și a complicațiilor acestuia, inclusiv a neuropatiei periferice diabetice.68 S-a demonstrat că un control intensiv al glicemiei ajută la scăderea riscului de neuropatie diabetică la pacienții cu diabet prin îmbunătățirea funcției nervoase.61,76,77 DCCT a stabilit rolul controlului glicemic în prevenirea și încetarea progresiei neuropatiei diabetice în diabetul de tip 1.10,56
Clinical Pearls
- Până la 50% dintre pacienți ar putea avea neuropatie periferică nedureroasă sau asimptomatică.
- Pacienților cu neuropatie li se recomandă să primească educație pentru îngrijirea picioarelor (autoinspecția zilnică a picioarelor) și îngrijire podiatrică regulată pentru pacienții selectați.
- Pacienții cu DPN care prezintă semne de pierdere a senzației de protecție cu sau fără deformare trebuie sfătuiți să fie urmăriți de un medic la fiecare trei până la șase luni pentru măsuri preventive.64
- Pentru a gestiona eficient simptomele de DPN, o abordare multidisciplinară devine esențială; această abordare cuprinzătoare ar putea include terapie farmacologică, psihologică și/sau fizică.
- O nouă declarație de poziție privind neuropatia diabetică publicată de ADA recomandă depistarea DPN la pacienții cu prediabet care prezintă simptome de neuropatie periferică.4
- Sunt necesare îngrijiri de specialitate pentru persoanele cu boală periferică, neuropatie nesenzorială sau picior Charcot.
Gastropareză
O altă formă de neuropatie diabetică este gastropareza. Această afecțiune este asociată cu simptome gastrointestinale superioare, inclusiv greață, vărsături, sațietate precoce sau plenitudine postprandială, dureri abdominale și balonare, dar în absența obstrucției de evacuare. Deși există o serie de cauze ale gastroparezei, s-a estimat că diabetul reprezintă aproximativ o treime din toate cazurile.78
Pathophysiology. Mecanismele fiziopatologice propuse pentru gastropareza diabetică includ controlul glicemic deficitar, neuropatia ganglionilor simpatici vagali sau prevertebrali, anomalii ale celulelor interstițiale ale lui Cajal, pierderea oxidului nitric sintetazei și, posibil, miopatie.79,80
Prezentare clinică. La începutul acestei afecțiuni, pacienții sunt de obicei asimptomatici. Nu există o relație liniară între simptome și severitatea neuropatiei. Varietatea mare a simptomelor face dificilă diagnosticarea afecțiunii. Alte prezentări clinice includ anorexie, malnutriție, pierdere în greutate și hipoglicemie din cauza nepotrivirii absorbției alimentelor și a insulinei. Durerea poate fi de fapt subraportată, dar semnificativă pentru multe persoane. În cadrul unui consorțiu finanțat de NIH, 72% dintre pacienții cu gastropareză au avut dureri abdominale.81 Acesta a fost simptomul dominant la 18% dintre acești pacienți. Durerea era indusă de alimentație (72%), era nocturnă (74%) și a interferat cu somnul (66%) pentru acești pacienți.81
Cât de frecventă este gastropareza diabetică? Incidența cumulată pe 10 ani a gastroparezei a fost estimată la 5,2% în cazul diabetului de tip 1 și la 1% în cazul diabetului de tip 2 în rândul pacienților cu diabet din comunitate.82 Alte studii au constatat că ratele sunt între 5-12%.83,84 Cu toate acestea, ratele sunt mult mai mari atunci când diagnosticul se bazează mai degrabă pe simptome decât pe studiul de golire a stomacului.
Gastropareza este mai frecventă în diabetul de tip 1 decât în diabetul de tip 2 și este cel mai frecvent întâlnită după ce persoana a avut diabet de mai mult de 10 ani și a dezvoltat celelalte complicații microvasculare de retinopatie, nefropatie și neuropatie periferică. Dacă un pacient prezintă gastropareză mai devreme decât era de așteptat, trebuie explorate alte etiologii, cel mai frecvent leziuni perioperatorii ale nervului vagal sau efecte farmacologice ale agenților pe bază de incretină – agoniști ai receptorilor peptidei-1 asemănătoare glucagonului (GLP-1RA) și inhibitori ai dipeptidil-peptidazei 4 (inhibitori DPP-4).
După ce un pacient dezvoltă simptome de gastropareză, simptomele persistă de obicei și sunt stabile pe parcursul a 12-25 de ani. Acest lucru este valabil chiar dacă există un control îmbunătățit al glucozei,85 cu excepția cazului unui transplant de pancreas și rinichi.86 Deși nu există dovezi clare că gastropareza crește mortalitatea în sine, aceasta reduce substanțial toate aspectele legate de calitatea vieții.87
Diagnostic. O serie de teste pot ajuta la diagnosticare. Standardul de aur pentru acest diagnostic este scintigrafia gastroesofagiană. Aceasta este neinvazivă, testează fiziologia și oferă rezultate cantitative. Gastropareza poate fi diagnosticată dacă există o retenție de cel puțin 35% a unei mese standard cu conținut scăzut de grăsimi la patru ore după ingerare.80
Pentru a oferi cele mai precise rezultate ale testului, protocolul pretest trebuie să includă întreruperea tuturor medicamentelor care alterează motilitatea timp de cel puțin două-trei zile înainte de testare, inclusiv prokineticele, opiaceele și anticolinergicele. Agenții de incretină, cum ar fi agoniștii GLP-1 și inhibitorii DPP-4, ar trebui, de asemenea, să fie opriți, deoarece se știe că aceștia întârzie golirea gastrică. S-a demonstrat, de asemenea, că hiperglicemia întârzie golirea gastrică, iar glucoza trebuie să fie sub 275 mg/dL înainte de începerea studiului.79,88
Pacienții trebuie să se abțină de la fumat și de la consumul de alcool în ziua testului, deoarece ambele pot încetini golirea gastroesofagiană.89 În plus, GLP-1RA pot exacerba gastropareza, deoarece încetinesc golirea gastrică. Mai mult, unele persoane pot avea gastropareză subclinică care este descoperită atunci când se începe administrarea unui GLP-1RA.
Tratament. Tratamentul gastroparezei depinde în mare măsură de severitatea simptomelor. Principiile generale de tratament includ tratamente de susținere (fluide, electroliți, controlul glucozei și nutriție), tratamente medicale (prokinetice, antiemetice și ameliorarea durerii) și tratamente invazive (intervenție chirurgicală, injecții cu Botox, stimulare gastrică sau stimulare electrică).79
Tratamentul de susținere este de obicei început în spital și se concentrează pe normalizarea tulburărilor de fluide, electroliți și nutriție. Atunci când se asigură suportul nutrițional, alimentația enterală este preferată celei parenterale, deoarece este mai fiziologică și poate ajuta la menținerea florei intestinale. Mai mult, modificările dietetice pot fi foarte utile în gastropareză. Dietele sărace în fibre, sărace în grăsimi și cu conținut scăzut de reziduuri sunt recomandate pacienților cu gastropareză.85 Dietele bogate în fibre pot crește simptomele, deoarece necesită mai multă digestie.
Medicamente. Prokinetice: În Statele Unite, metoclopramida și eritromicina sunt cele mai frecvent utilizate medicamente pentru tratarea gastroparezei. Cu toate acestea, metoclopramida are o avertizare de tip black box din cauza riscului de discinezie tardivă. Dezvoltarea acestei afecțiuni este direct legată de durata de utilizare a metoclopramidei și de numărul de doze administrate. Atunci când utilizați acest medicament, cel mai bine este să îl folosiți numai la pacienții simptomatici și să începeți cu cea mai mică doză eficientă cu 15 minute înainte de mese. Vacanțele medicamentoase pot ajuta uneori la prelungirea duratei efectelor.90
Domperidona este un agonist dopaminergic mai selectiv care este la fel de eficient ca metoclopramidul, dar are mai puține efecte secundare asupra sistemului nervos central.91
Antiemetice: Antiemeticele pot fi utilizate pentru a ajuta la ameliorarea simptomelor. Cu toate acestea, riscul de interacțiuni medicamentoase este semnificativ și trebuie monitorizat cu atenție.
Managementul durerii poate fi o provocare la pacienții cu gastropareză. Antidepresivele triciclice sunt adesea utilizate ca terapie de primă linie pentru durerea în gastropareză. Abordările de a doua linie sunt agonistul slab al receptorilor mu-opioizi, tramadol, care eliberează, de asemenea, serotonină și inhibă recaptarea norepinefrinei, și analogul acidului gama-aminobutiric, gabapentin. Cu toate acestea, utilizarea narcoticelor în gastropareză nu este recomandată, deoarece poate contribui la constipație și la înrăutățirea simptomelor.
Tratamente invazive: Injecțiile cu Botox sunt utilizate în mod obișnuit în tratamentul gastroparezei, dar utilizarea lor nu este susținută de studii clinice.92,93
Dispozitivul de stimulare electrică gastrică a fost aprobat de FDA în 2000, în temeiul unei derogări pentru dispozitive umanitare.94 Dispozitivul de stimulare electrică gastrică oferă o stimulare electrică de înaltă frecvență și de energie scăzută la nivelul stomacului. Este mai util în gastropareza diabetică decât în gastropareza idiopatică. O meta-analiză a arătat beneficii substanțiale în ceea ce privește simptomele pacienților. Mecanismul exact al beneficiilor sale nu este încă cunoscut.95 S-a propus că stimularea electrică gastrică determină modificări ale mecanismelor centrale care controlează greața și vărsăturile, crește funcția vagală și determină scăderea sensibilității la distensie.97 Pacienții care răspund bine răspund de obicei rapid. Acest lucru i-a determinat pe unii să recomande mai întâi o încercare cu plasarea temporară a electrozilor înainte de implementarea pe termen lung.
Clinical Pearls
- Gastropareza diabetică este mai frecventă la persoanele cu diabet de lungă durată și la cele cu alte complicații microvasculare.
- Diagnosticul standard de aur pentru gastropareză este scintigrafia gastroesofagiană.
- În gastropareza diabetică sunt recomandate dietele sărace în fibre, sărace în grăsimi și cu conținut scăzut de reziduuri.
- Tratamentele farmacologice și intervenționale au beneficii limitate și un risc semnificativ pe termen lung.
Cheiroartropatia diabetică
Una dintre complicațiile diabetului mai puțin cunoscute este cheiroartropatia. Această afecțiune se caracterizează prin mobilitate limitată a articulațiilor din cauza îngroșării pielii la persoanele cu diabet de lungă durată. Probabil că a fost prima complicație identificată din diabetul de tip 1. Ratele de prevalență variază foarte mult, de la 8-50%.98
Cheiroartropatia se crede că este cauzată de glicozilarea și reticulația colagenului. Poate afecta pielea și tendoanele și poate avea ca rezultat o mobilitate limitată a articulațiilor, cel mai frecvent extensia degetelor, rigiditate și durere. Semnul clasic al examenului fizic pentru cheiropatia diabetică este „semnul rugăciunii”. În această afecțiune, o persoană este incapabilă să își aplatizeze complet mâinile pentru a se „ruga”, lăsând un spațiu între degetele mâinii stângi și cele ale mâinii drepte. Există dovezi că cei care dezvoltă cheiropatie au un risc de trei ori mai mare de complicații microvasculare.99
Cheiropatia diabetică este de obicei mai gravă la cei cu glicemie de lungă durată sau prost controlată. Din fericire, multe persoane experimentează o ameliorare a simptomelor și o îmbunătățire a mobilității atunci când se îmbunătățește controlul glicemiei.100
Concluzie
Managementul complicațiilor diabetului necesită o echipă multidisciplinară. Depistarea precoce a retinopatiei, nefropatiei și neuropatiei este esențială, având în vedere natura asimptomatică a bolii. Semnul distinctiv al managementului diabetului pentru toate complicațiile continuă să fie controlul glicemiei și al tensiunii arteriale.
- American Diabetes Association. Costul diabetului. Disponibil la: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Actualizat la 22 iunie 2015. Accesat la 8 feb. 2017.
- UK Prospective Diabetes Study Group. Controlul intensiv al glicemiei cu sulfoniluree sau insulină în comparație cu tratamentul convențional și riscul de complicații la pacienții cu diabet zaharat de tip 2. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Neuropatia diabetului: O declarație de poziție a Asociației Americane de Diabet. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Estimări globale privind numărul de persoane oarbe sau cu deficiențe de vedere din cauza retinopatiei diabetice: O meta-analiză din 1990 până în 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Fapte despre boala oculară diabetică. Disponibil la: https://nei.nih.gov/health/diabetic/retinopathy. Actualizat în sept. 2015. Accesat la 8 feb. 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopatia în diabet. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standarde de îngrijire medicală în diabet-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Factorii de risc cardiovascular și complicațiile asociate cu albuminuria și afectarea funcției renale în diabetul tratat cu insulină. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. Efectul tratamentului intensiv al diabetului zaharat asupra dezvoltării și progresiei complicațiilor pe termen lung în diabetul zaharat insulino-dependent. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Efecte persistente ale controlului intensiv al glicemiei asupra retinopatiei în diabetul de tip 2 în cadrul studiului Action to Control Cardiovascular Risk in Diabetes (ACCORD) follow-on. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Efectul sarcinii asupra complicațiilor microvasculare în cadrul studiului Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Activitatea fizică/exercițiu și diabetul: O declarație de poziție a Asociației Americane de Diabet. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Raport preliminar privind efectele terapiei de fotocoagulare. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Fotocoagularea pentru edemul macular diabetic: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab pentru edemul macular diabetic: Rezultate din 2 studii randomizate de fază III: RISE și RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; publicat online la 17 martie 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Nefropatie diabetică. Medscape Disponibil la: Medscape: http://emedicine.medscape.com/article/238946-overview. Actualizat la 30 sept. 2016. Accesat Feb. 12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: A report from an ADA Consensus Conference (Un raport al unei conferințe de consens ADA). Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Controlul intensiv al glicemiei și rezultatele vasculare la pacienții cu diabet de tip 2. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Controlul glicemiei și complicațiile vasculare la veteranii cu diabet de tip 2. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Efectul tratamentului intensiv al hiperglicemiei asupra rezultatelor microvasculare în diabetul de tip 2: O analiză a studiului randomizat ACCORD. Lancet 2010;376:419-430.
- National Kidney Foundation. Ghidul de practică clinică KDOQI pentru diabet și insuficiență renală cronică: actualizare 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Asociații ale măsurilor bolii renale cu mortalitatea și boala renală în stadiu terminal la persoanele cu și fără diabet: O meta-analiză. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Managementul diabetului zaharat la pacienții cu boală renală cronică. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Distingerea nefropatiei diabetice de alte cazuri de glomeruloscleroză: O actualizare. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Evaluarea de laborator a bolii renale diabetice. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. O nouă ecuație pentru a estima rata de filtrare glomerulară. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. Ghidul de practică clinică KDOQI pentru boala cronică de rinichi: Evaluare, clasificare și stratificare. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Rezultatele renale pe termen lung ale pacienților cu diabet zaharat de tip 1 și microalbuminurie: O analiză a cohortei Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin încetinește progresia declinului funcției renale independent de efectele glicemice. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Disponibil la: http://online.lexi.com. Accesat la 31 oct. 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Disponibil la: http://www.micromedexsolutions.com. Accesat la 31 oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Implicații clinice și terapeutice pentru diabetul de tip 2. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: Un studiu retrospectiv de cohortă. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Efectele renale și retiniene ale enalaprilului și losartanului în diabetul de tip 1. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Efectul candesartanului asupra microalbuminuriei și a ratei de excreție a albuminei în diabet: Trei studii randomizate. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan pentru întârzierea sau prevenirea microalbuminuriei în diabetul de tip 2. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Eficacitatea și siguranța blocării duble a sistemului renină-angiotensină: Meta-analiză a studiilor randomizate. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effect of a reduction of a uric acid on renal outcomes during losartan treatment: A post-hoc analysis of the reduction of endpoints in non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Efectul renoprotector al antagonistului receptorilor de angiotensină irbesartan la pacienții cu nefropatie datorată diabetului de tip 2. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progress to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Linii directoare pentru diagnosticul și managementul ambulatoriu al neuropatiei periferice diabetice. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. Stresul ER în neuropatia periferică diabetică: O nouă țintă terapeutică. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Mecanisme pro-inflamatorii în neuropatia diabetică: Accent pe calea factorului nuclear kappa B. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Factorii de risc vasculari și neuropatia diabetică. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Trigliceridele crescute corelate cu progresia neuropatiei diabetice. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Neuropatia autonomă cardiovasculară (raportul dintre expirație și inspirație) în diabetul de tip 1. Incidență și predictori. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Factori de risc pentru neuropatia autonomă cardiacă în diabetul zaharat de tip 1. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Efectul tratamentului intensiv al diabetului zaharat asupra conducției nervoase în cadrul studiului Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. Efectul tratamentului intensiv al diabetului zaharat asupra măsurilor de funcționare a sistemului nervos autonom în cadrul studiului Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Neuropatia diabetică: De la mecanisme la management. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Neuropatia diabetică: Mecanisme celulare o țintă terapeutică. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Efecte protectoare ale inactivării genei ciclooxigenazei-2 împotriva disfuncției nervilor periferici și a pierderii fibrelor nervoase intraepidermice în diabetul experimental. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: Manifestări clinice și tratamente actuale. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical practice: Ulcerele neuropatice ale piciorului diabetic. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: O declarație a Asociației Americane de Diabet. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: Un raport al grupului de lucru al grupului de interes pentru îngrijirea picioarelor al Asociației Americane de Diabet, cu aprobarea Asociației Americane de Endocrinologi Clinici. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Actualizare privind definițiile, criteriile de diagnostic, estimarea severității și tratamentele. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies: Actualizare privind definiția cercetării, criteriile de diagnostic și estimarea severității. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Diagnosticul diferențial al neuropatiei diabetice. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Antrenamentul de exerciții fizice poate modifica istoria naturală a neuropatiei periferice diabetice. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidence-based guideline: Tratamentul neuropatiei diabetice dureroase. Raport al Academiei Americane de Neurologie, al Asociației Americane de Medicină Neuromusculară și Electrodiagnostic și al Academiei Americane de Medicină Fizică și Reabilitare. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetină și pregabalină: monoterapie cu doze mari sau combinația lor? Studiul „COMBO-DN” – un studiu multinațional, randomizat, dublu-orb, cu grupuri paralele, la pacienții cu dureri neuropatice periferice diabetice. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Rolul acupuncturii în managementul neuropatiei diabetice dureroase (DPN): A pilot RCT. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Tratamentul polineuropatiei diabetice simptomatice cu acidul alfa-lipoic antioxidant: O meta-analiză. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Eficacitatea și siguranța tratamentului antioxidant cu acid alfa-lipoic pe o perioadă de 4 ani în polineuropatia diabetică: Studiul NATHAN 1. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. The acute effects of glycemic control on axonal excitability in human diabetic nerves. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Neuropatia diabetică dureroasă. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografia, caracteristicile clinice, profilurile psihologice și de abuz, tratamentul și urmărirea pe termen lung a pacienților cu gastropareză. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiologia, mecanismele și managementul gastroparezei diabetice. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importanța durerii abdominale ca simptom în gastropareză: Relația cu factorii clinici, severitatea bolii, calitatea vieții, retenția gastrică și utilizarea medicamentelor. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Riscul de gastropareză la subiecții cu diabet de tip 1 și 2 în populația generală. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalența simptomelor gastrointestinale asociate cu diabetul zaharat: Un studiu bazat pe populație de 15.000 de adulți. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Îmbunătățirea funcției autonome și gastrice în cazul transplantului de pancreas- rinichi vs. rinichi singur contribuie la calitatea vieții. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Simptomele abdominale superioare la pacienții cu diabet de tip 1: Fără legătură cu afectarea golirei gastrice cauzată de neuropatia autonomă. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Fumatul întârzie golirea gastrică a solidelor. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Articol de revizuire: Metoclopramida și discinezia tardivă. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Studiu clinic: Un studiu randomizat-controlat încrucișat al injecției intrapilorice de toxină botulinică în gastropareză. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. High-frequency gastric electrical stimulation for the treatment of gastroparesis: O meta-analiză. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Gastropareza severă: Terapia medicală sau stimularea electrică gastrică. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mecanismele îmbunătățirii simptomatice după stimularea electrică gastrică la pacienții gastroparetici. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalența tulburărilor musculo-scheletice la pacienții cu diabet zaharat de tip 2: Un studiu pilot. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Mobilitatea limitată a articulațiilor în diabetul zaharat din copilărie indică un risc crescut de boală microvasculară. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Rezolvarea cheiroartropatiei diabetice. Br Med J 1986;293:1537.
.