Voltaiska (galvaniska) celler
För att illustrera de grundläggande principerna för en galvanisk cell, låt oss betrakta reaktionen mellan metallisk zink och kopparjon (Cu2+) för att ge kopparmetall och Zn2+-jon. Den balanserade kemiska ekvationen är följande:
\
Vi kan få denna reaktion att inträffa genom att föra in en zinkstav i en vattenlösning av kopparsulfat(II). När reaktionen fortskrider löses zinkstången upp och det bildas en massa metallisk koppar. Dessa förändringar sker spontant, men all energi som frigörs är i form av värme snarare än i en form som kan användas för att utföra arbete.
Denna samma reaktion kan utföras med hjälp av den galvaniska cell som illustreras i figur \(\PageIndex{3a}\). För att sätta ihop cellen sätts en kopparremsa in i en bägare som innehåller en 1 M lösning av Cu2+ joner, och en zinkremsa sätts in i en annan bägare som innehåller en 1 M lösning av Zn2+ joner. De två metallremsorna, som fungerar som elektroder, är förbundna med en tråd, och avdelningarna är förbundna med en saltbrygga, ett U-format rör som förs in i båda lösningarna och som innehåller en koncentrerad vätska eller geléelektrolyt. Jonerna i saltbryggan väljs så att de inte stör den elektrokemiska reaktionen genom att själva oxideras eller reduceras eller genom att bilda en utfällning eller ett komplex; vanligt förekommande katjoner och anjoner är Na+ eller K+ respektive NO3- eller SO42-. (Jonerna i saltbryggan behöver inte vara desamma som jonerna i redoxparet i någon av avdelningarna). När kretsen är sluten sker en spontan reaktion: zinkmetall oxideras till Zn2+ -joner vid zinkelektroden (anoden) och Cu2+ -joner reduceras till Cu-metall vid kopparelektroden (katoden). När reaktionen fortskrider löses zinkremsan upp och koncentrationen av Zn2+-joner i Zn2+-lösningen ökar. Samtidigt ökar kopparremsan i massa och koncentrationen av Cu2+-joner i Cu2+-lösningen minskar (figur \(\PageIndex{3b}\)). Vi har alltså utfört samma reaktion som vi gjorde med en enda bägare, men den här gången är den oxidativa och den reduktiva halvreaktionen fysiskt separerade från varandra. De elektroner som frigörs vid anoden flödar genom tråden och producerar en elektrisk ström. Galvaniska celler omvandlar alltså kemisk energi till elektrisk energi som sedan kan användas för att utföra arbete.
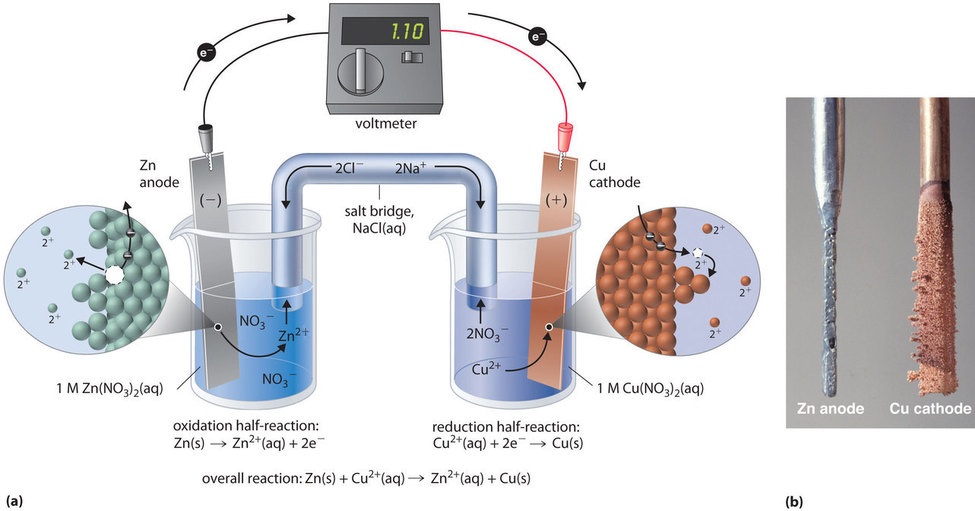
Elektrolyten i saltbryggan tjänar två syften: den sluter kretsen genom att bära elektrisk laddning och upprätthåller den elektriska neutraliteten i de båda lösningarna genom att tillåta att joner migrerar mellan dem. Identiteten hos saltet i en saltbrygga är oviktig, så länge de ingående jonerna inte reagerar eller genomgår en redoxreaktion under cellens driftsförhållanden. Utan en sådan förbindelse skulle den totala positiva laddningen i Zn2+-lösningen öka när zinkmetallen löses upp, och den totala positiva laddningen i Cu2+-lösningen skulle minska. Saltbryggan gör det möjligt att neutralisera laddningarna genom ett flöde av anjoner till Zn2+-lösningen och ett flöde av katjoner till Cu2+-lösningen. I avsaknad av en saltbrygga eller någon annan liknande förbindelse skulle reaktionen snabbt upphöra eftersom den elektriska neutraliteten inte skulle kunna upprätthållas.
En voltmeter kan användas för att mäta skillnaden i elektrisk potential mellan de två avdelningarna. Om man öppnar strömbrytaren som förbinder trådarna till anoden och katoden förhindrar man att en ström flödar, så ingen kemisk reaktion uppstår. När strömbrytaren är stängd är dock den externa kretsen sluten och en elektrisk ström kan flöda från anoden till katoden. Cellens potential (\(E_{cell}\)), mätt i volt, är skillnaden i elektrisk potential mellan de två halvreaktionerna och är relaterad till den energi som behövs för att förflytta en laddad partikel i ett elektriskt fält. I den cell som vi har beskrivit visar voltmetern en potential på 1,10 V (figur \(\PageIndex{3a}\)). Eftersom elektroner från oxidationshalvreaktionen frigörs vid anoden är anoden i en galvanisk cell negativt laddad. Katoden, som drar till sig elektroner, är positivt laddad.
Inte alla elektroder genomgår en kemisk omvandling under en redoxreaktion. Elektroden kan vara tillverkad av en inert, högledande metall såsom platina för att förhindra att den reagerar under en redoxprocess, där den inte förekommer i den totala elektrokemiska reaktionen. Detta fenomen illustreras i exempel \(\PageIndex{1}\).
En galvanisk (voltaisk) cell omvandlar den energi som frigörs av en spontan kemisk reaktion till elektrisk energi. En elektrolytisk cell förbrukar elektrisk energi från en extern källa för att driva en icke spontan kemisk reaktion.
Exempel \(\PageIndex{1}\)
En kemist har konstruerat en galvanisk cell som består av två bägare. Den ena bägaren innehåller en remsa av tenn nedsänkt i vattenhaltig svavelsyra och den andra innehåller en platinaelektrod nedsänkt i vattenhaltig salpetersyra. De två lösningarna är förbundna med en saltbrygga och elektroderna är förbundna med en tråd. Strömmen börjar flöda och bubblor av en gas uppträder vid platinaelektroden. Den spontana redoxreaktion som uppstår beskrivs av följande balanserade kemiska ekvation:
\
För denna galvaniska cell,
- skriver du den halva reaktion som uppstår vid varje elektrod.
- angiv vilken elektrod som är katod och vilken som är anod.
- angiv vilken elektrod som är den positiva elektroden och vilken som är den negativa elektroden.
Givet: galvanisk cell och redoxreaktion
Förfrågas om: halva reaktioner, identiteten på anod och katod samt elektrodtilldelning som positiv eller negativ
Strategi:
- Identifiera oxidationshalvreaktionen och reduktionshalvreaktionen. Identifiera sedan anoden och katoden utifrån den halvreaktion som sker vid varje elektrod.
- Utifrån elektronflödets riktning tilldelar du varje elektrod som antingen positiv eller negativ.
Lösning
A I reduktionshalvreaktionen reduceras nitrat till kväveoxid. (Salpeteroxiden skulle sedan reagera med luftens syre för att bilda NO2, med sin karakteristiska rödbruna färg). I oxidationshalvreaktionen oxideras metalliskt tenn. Halvreaktionerna som motsvarar de faktiska reaktionerna som sker i systemet är följande:
reduktion: \
oxidation:
Nitrat reduceras alltså till NO, medan tennelektroden oxideras till Sn2+.
Då reduktionsreaktionen sker vid Pt-elektroden är den katod. Omvänt sker oxidationsreaktionen vid tennelektroden, så den är anod.
B Elektroner flödar från tennelektroden genom tråden till platinelektroden, där de överförs till nitrat. Den elektriska kretsen sluts av saltbryggan, som tillåter diffusion av katjoner mot katoden och anjoner mot anoden. Eftersom elektroner flödar från tennelektroden måste den vara elektriskt negativ. I motsats till detta flödar elektroner mot Pt-elektroden, så den elektroden måste vara elektriskt positiv.
Övningsuppgift \(\PageIndex{1}\)
Tänk på en enkel galvanisk cell som består av två bägare som är sammankopplade med en saltbrygga. Den ena bägaren innehåller en lösning av \(\ce{MnO_4^{-}}\) i utspädd svavelsyra och har en Pt-elektrod. Den andra bägaren innehåller en lösning av \(\ce{Sn^{2+}}\) i utspädd svavelsyra och har också en Pt-elektrod. När de två elektroderna är förbundna med en tråd, flyter strömmen och det uppstår en spontan reaktion som beskrivs av följande balanserade kemiska ekvation:
\
För denna galvaniska cell,
- skriver du den halva reaktionen som uppstår vid varje elektrod.
- angiv vilken elektrod som är katod och vilken som är anod.
- angiv vilken elektrod som är positiv och vilken som är negativ.
Svara a
\ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}\]
Svar b
Pt-elektroden i permanganatlösningen är katoden, den i tennlösningen är anoden.
Svar c
Katoden (elektroden i bägaren som innehåller permanganatlösningen) är positiv och anoden (elektroden i bägaren som innehåller tennlösningen) är negativ.