Min gissning är att du redan har den empiriska formeln för vinsyra och att du måste hitta dess molekylformel genom att använda dess molmassa.
Att anta att utgångspunkten här är den empiriska formeln för vinsyra ser ut så här
#”C”_2 ”H”_3 ”O”_3 -># empirisk formel
Nu talar en förenings empiriska formel om för dig det minsta hela talförhållandet som finns mellan atomerna i de ingående elementen.
I det här fallet vet du att molekylformeln, som talar om det exakta antalet atomer som ingår i en molekyl av nämnda förening, kommer att innehålla
#color(black)(”2 atomer av C” color(red)(” for every ”) {(”3 atoms of H”),(”3 atoms of O”) :}#
I huvudsak letar du efter en multipel av den empiriska formeln.
Vintersyra sägs ha en molarmassa på #”150 g mol”^(-1)#. Ditt mål här är att bestämma molarmassan för dess empiriska formel och sedan använda detta värde för att bestämma föreningens molekylformel.
I det här fallet får du
#2 xx ”12.011 g mol”^(-1) ” ”color(blue)(+)#
#3 xx ”1.00794 g mol”^(-1)#
#3 xx ”15.9994 g mol”^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaaaaaaaaaaaa)#
#”75.044 g mol”^(-1) -> #molmassan för den empiriska formeln
Så, om den empiriska formeln har en molmassa på #”75.044 g mol”^(-1)# och molarmassan för vinsyra är #”150 g mol”^(-1)#, följer att du måste multiplicera den empiriska formeln med
#(150 color(red)(cancel(color(black)(”g mol”^(-1)))))/(75.044color(red)(cancel(color(black)(”g mol”^(-1))))) = 1,999 ~~ color(red)(2)#
för att få molekylformeln. Detta innebär att molekylformeln för vinsyra blir
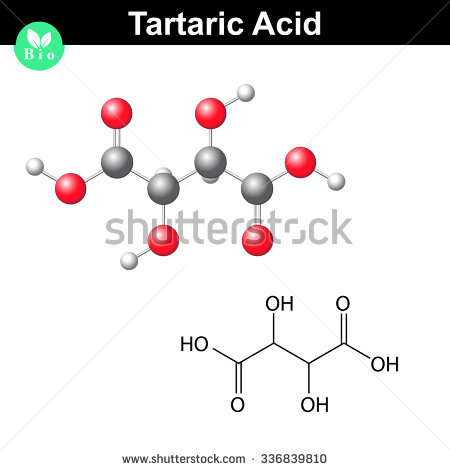
#(”C”_2 ”H”_3 ”O”_3)_color(red)(2) innebär color(green)(|bar(ul(color(white)(a/a) ”C”_4 ”H”_6 ”O”_6color(white)(a/a)|)))#
Här ser en molekyl av vinsyra ut