En isobar process är en termodynamisk process förändring av tillståndet hos en viss mängd materia där trycket förblir konstant. Det som kan förändras är en eller flera av dess tillståndsvariabler. Om värme överförs till systemet utförs arbete och systemets inre energi förändras också.
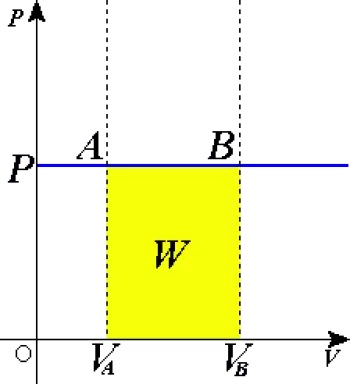
I ett tryck-volymdiagram driver den en horisontell linje enligt idealgaslagen.
Den isobariska processen styrs av Charles lag. Enligt Charles lag är volymen för en fast massa idealgas vid konstant tryck direkt proportionell mot Kelvintemperaturen.
Isobariska processer regleras av termodynamikens första lag. I dessa processer är energiökningen lika med ökningen av entalpi minus trycket multiplicerat med volymökningen:ΔE = ΔH – P – ΔV.
Inte att förväxla med isotermiska processer, som sker vid konstant tryck, eller med adiabatiska processer, som inte utbyter värme. I dessa processer kan en tryckförändring ske. När processen sker i en konstant volym kallas den för en isokarisk process.
Exempel på isobariska processer
För att bättre förstå denna termodynamiska process hjälper det oss att se ett par exempel.
-
Expansionsfasen i cylindern i en motor.
-
Kokar vatten i en öppen behållare.
-
Uppvärmning av ett jordklot på grund av solstrålningens inverkan.
-
Varmluftsballonger experimenterar med isobarisk och isokronisk process.
Uppvärmning av luften i en ballong
Volymförändringen som en ballong upplever när solens strålar träffar den är ett exempel på en isobarisk process. Medan solen ökar temperaturen upplever gasens (luftens) volym en isobarisk expansion.
I början av morgonen uppvisar den ett visst tryck, en viss volym och en viss temperatur, när luften inuti värms upp ökar trycket, men detta varierar inte på grund av volymökningen.
Cylinderexpansionsfasen i en värmemotor
Cylindern i en värmemotor kan expanderas eller krympas beroende på cykelns fas. Expansionen av luft i en cylinder med en rörlig kolv till vilken värme tillförs sker genom en isobarisk process. På samma sätt minskas volymen isobariskt under kompressionen.
Volymen ökar i proportion till sin temperatur och trycket förblir konstant. Detta är i enlighet med Charles lag.
Kokning av vatten i en öppen behållare
Ett vardagligt exempel på en isobarisk process är kokning av vatten i en öppen behållare. Genom att tillföra värmeenergi till vattnet stiger dess temperatur och omvandlas till ånga.
Den ånga som erhålls har en högre temperatur och upptar en större volym, men trycket förblir konstant. Från början är trycket lika med det atmosfäriska trycket.
Hetta upp en varmluftsballong
En varmluftsballong är ett exempel på en isobarisk process.
Varmluftsballonger fungerar eftersom varm luft stiger. Genom att värma luften inuti ballongen med brännaren blir den lättare än den kallare luften på utsidan. Detta gör att ballongen flyter uppåt, som om den befann sig i vatten.
Trycket inne i ballongen är detsamma som det atmosfäriska trycket. När piloten injicerar värme i luften stiger temperaturen. Det gör att luftens densitet minskar och på grund av skillnaden mellan luftens och luftens densitet stiger ballongen.
Thermodynamiskt sett omvandlas en del av värmen till arbete vilket gör att varmluftsballongen stiger uppåt. En del av denna värme frigörs utanför systemet på grund av den termodynamiska kontakten med den yttre luften och på grund av förlusten av varmluft när den expanderar.
W 1-2 = P ( V 2 – V 1 ) W 1-2 = n R ( T 2 – T 1 ) Q 1-2 = m c p ( T 2 – T 1 ) Q 1-2 = ( k / ( k -1))). P ( V 2 – V 1 )
Var,
-
W 1-2 mängden arbete som utförs av tillståndsförändringen
-
Q 1-2 mängden tillförd eller borttagen värme
-
P tryck
-
V volymen
-
T den absoluta temperaturen
-
n mängden stoft (vanligen uttryckt i mol)
-
m ämnets massa
-
cp ämnets specifika värme vid konstant tryck
-
k är ett förhållande som är lika med kvoten av den specifika värmen vid konstant tryck och konstant volym, respektive
Från den första ekvationen kan vi se att om systemet expanderar (ΔV är positivt) så utför systemet positivt arbete. Om volymökningen däremot är negativ, drar systemet ihop sig och arbetet är negativt.
Ekvation för tillståndet hos en idealgas
Ekvationen för tillståndet hos en idealgas (ibland Mendeleev – Clapeyron-ekvationen eller Clapeyron-ekvationen) är en formel som fastställer förhållandet mellan tryck, molärvolym och den absoluta temperaturen hos en idealgas. Ekvationen är:
pV = nRT
Varvid,
p – tryck,
V- gasvolym,
n- gasmängden,
R – universell gaskonstant , R ≈ 8,314 J / (mol⋅K),
T – termodynamisk temperatur, K kelvin.