Diabetes mellitus är dyrt, men de flesta kostnaderna hänförs till komplikationer och sjukhusvård.1 Enligt American Diabetes Association (ADA) uppgick den totala uppskattade kostnaden för diabetes 2012 till 245 miljarder dollar.1 Uppskattningsvis 43 % av kostnaderna för sjukhusvård och ytterligare 18 % för recept för att hantera diabeteskomplikationer.1
De flesta av dessa komplikationer kan förebyggas med riktad glukoskontroll. Epidemiologiska data visar att för varje procentenhet minskning av hemoglobin A1c (HbA1c) sker en 35 % riskminskning av mikrovaskulära komplikationer.2 De goda nyheterna är att komplikationsfrekvensen för diabetes har minskat,3 men detta har överträffats av den rena ökningen av antalet personer med diabetes som utvecklas med komplikationer.
Många personer med typ 2-diabetes kan ha en diabetesrelaterad komplikation vid tidpunkten för diagnosen. Vid både typ 1- och typ 2-diabetes är vissa av komplikationerna, t.ex. retinopati och nefropati, tysta. Detta kräver ett aggressivt målinriktat tillvägagångssätt eftersom det blir för sent att vänta på symtom. Till och med diabetisk neuropati kommer att vara asymtomatisk hos upp till 50 % av de personer som har mätbara avvikelser.4
Denna artikel kommer att granska rekommendationerna från ADA 2017 Standards of Care för mikrovaskulära komplikationer och relevanta ställningstaganden, och kommer att belysa förebyggande screening och kliniska pärlor för den primärvårdsläkare som behandlar patienter med diabetes.
- Diabetisk retinopati
- Tabell 1. Retinopatistadier med beskrivning
- Kliniska pärlor
- Diabetes och njursjukdom
- Tabell 2. Utvalda landmärkesstudier som visar glykemisk kontroll med A1c under 7 %
- Tabell 3. Uppskattad GFR med stadium och beskrivning
- Tabell 4. Kategorier av albuminuri i CKD
- Figur 1. Föreslagen utvärderingsfrekvens (antal gånger per år) per eGFR- och albuminuriakategori
- Tabell 5. Röda flaggor som tyder på icke-diabetisk glomerulär sjukdom
- Tabell 6. Dosjusteringar och rekommendationer för glukossänkande medel hos patienter med nedsatt njurfunktion
- Klass
- Medicinering
- Kliniska pärlor
- Diabetisk perifer neuropati
- Tabell 7. Andra orsaker till neuropati67
- Tabell 8. Vanligt använda farmakologiska medel för DPN4,69
- Kliniska pärlor
- Gastropares
- Kliniska pärlor
- Diabetisk cheiroartropati
- Slutsats
Diabetisk retinopati
Diabetisk retinopati är en vanlig mikrovaskulär komplikation vid typ 1- och typ 2-diabetes. Uppskattningsvis 3,7 miljoner människor i världen är måttligt till allvarligt synskadade på grund av diabetisk retinopati, och mer än 800 000 människor i världen är blinda på grund av diabetisk retinopati.5 Det är den vanligaste orsaken till nytillkommen blindhet hos vuxna i åldern 20-74 år.6 Starka samband har gjorts med glykemisk kontroll, blodtryckskontroll och sjukdomens varaktighet. Genom tidig, regelbunden screening och kontroll av dessa riskfaktorer kan diabetisk retinopati upptäckas och behandlas för att förhindra synnedsättning.
Duration av diabetes är den största riskfaktorn för progression av diabetisk retinopati. Vid typ 1-diabetes är retinopati sällsynt under de första 3-5 åren eller före puberteten.7 Under de följande 20 åren kommer nästan alla patienter med typ 1-diabetes att utveckla diabetisk retinopati.7 Hos patienter med typ 2-diabetes kommer så många som 21 % att ha någon grad av retinopati vid tidpunkten för diagnosen.7 Kronisk hyperglykemi, nefropati, hypertoni och dyslipidemi är andra faktorer som ökar risken för eller är associerade med diabetisk retinopati.8 Upp till 50 % av patienterna med albuminuri (oavsett nivå på uppskattad glomerulär filtrationshastighet) kommer att ha retinopati.9 Tabell 1 beskriver de olika stadierna av retinopati.
Tabell 1. Retinopatistadier med beskrivning |
|
|
Steg |
Beskrivning |
|
Mild Non-.Proliferativ diabetisk retinopati |
Mikroaneurysm finns |
|
Måttlig icke-proliferativ diabetisk retinopati |
Mikroaneurysm, Retinala punkt- eller blottblödningar, hårda exudater, eller bomullstussar kan förekomma |
|
Svår icke-proliferativ diabetisk retinopati |
Intraretinala blödningar, venösa pärlor, eller intraretinala mikrovaskulära avvikelser kan förekomma |
|
Proliferativ diabetisk retinopati |
Neovaskularisering, vitreösa eller preretinala blödningar förekommer |
Patofysiologi. Milda, icke-proliferativa avvikelser som kännetecknas av ökad kärlpermeabilitet kan utvecklas till måttlig till svår icke-proliferativ diabetisk retinopati (NPDR).7 Proliferativ diabetisk retinopati kännetecknas av proliferation av nya retinala blodkärl.7 Makulaödem, som är en central förtjockning av näthinnan med exsudation och ödem, kan förekomma i alla stadier av retinopati.7 Diabetisk retinopati kan påskyndas av graviditet, pubertet, bristande glykemisk kontroll, högt blodtryck och kataraktkirurgi.7
Förebyggande av diabetisk retinopati. Glykemisk kontroll är nyckeln till att förebygga diabetisk retinopati. I Diabetes Control and Complications Trial (DCCT) utvärderade forskarna effekten av noggrann glykemisk kontroll och progression från ingen eller minimal retinopati vid baslinjen till måttlig NPDR.10 För patienter i den intensiva terapigruppen utan retinopati vid baslinjen minskade den genomsnittliga risken för retinopati med 76 % under 36 månader.10 Bland patienter i gruppen med intensiv behandling som redan hade minimal till måttlig NPDR minskade risken för progression med 54 % jämfört med dem som använde konventionell behandling.10 I den ursprungliga ACCORD-studien (Action to Control Cardiovascular Risk in Diabetes) randomiserades deltagare med typ 2-diabetes sedan 10 år tillbaka och känd kardiovaskulär sjukdom till intensiv- eller standardbehandling av glykemi, systoliskt blodtryck och dyslipidemi till intensiv- eller standardbehandling. Fyra år senare minskade retinopatiprogressionen hos dem med tidigare intensiv glykemisk kontroll, oavsett liknande aktuella HbA1c-nivåer.11 Liknande arvseffekter sågs inte i de grupper med intensiv blodtryckskontroll eller på fenofibrat för dyslipidemi.11
Screening. Eftersom makulaödem och proliferativ diabetisk retinopati kan vara asymtomatiska är screening avgörande för tidig upptäckt och behandling. För patienter med typ 1-diabetes bör screening inledas fem år efter diagnosen.8 För patienter med typ 2-diabetes bör screening inledas vid diagnosen.8 Screening bör utföras av en ögonläkare eller optiker som har erfarenhet av diabetisk retinopati. Screeningen bör genomföras med utvidgade ögon. Om retinopati redan föreligger rekommenderas remiss till en ögonläkare.8 Upprepad utvärdering bör göras årligen om minimal eller ingen sjukdom hittas.8
Graviditet är en högrisktid för proliferativ retinopati. Hos gravida kvinnor med befintlig typ 1- eller typ 2-diabetes bör ögonundersökningar utföras före befruktningen eller under den första trimestern. Undersökningarna bör upprepas varje trimester och under ett år efter förlossningen.8 För dem med graviditetsdiabetes behövs inga ytterligare ögonundersökningar efter förlossningen.
Graviditet hos patienter med redan befintlig typ 1- eller typ 2-diabetes kan resultera i snabb progression av diabetisk retinopati. Detta gäller särskilt om den glykemiska kontrollen är dålig vid tidpunkten för befruktningen.14 Kvinnor med diabetes som är gravida eller planerar att bli gravida bör informeras om risken för utveckling eller progression av diabetisk retinopati och behovet av glykemisk kontroll före befruktningen.8 En tidig försämring av retinopati kan dock inträffa vid ett snabbt genomförande av intensiv glykemisk kontroll om retinopati redan finns.8 Gestationsdiabetes verkar inte ge samma risk för att utveckla diabetisk retinopati under graviditeten.8
Behandling. Förutom glykemisk kontroll har även blodtryckskontroll (< 140 mmHg systoliskt) visat sig minska utvecklingen av diabetisk retinopati, men det finns ingen ytterligare fördel med noggrann kontroll av systoliskt blodtryck < 120 mmHg.12 Fenofibrat kan också bromsa utvecklingen av diabetisk retinopati, särskilt vid mycket lindrig NPDR, hos patienter med dyslipidemi.13 Aspirin visade sig inte ha någon effekt på progression av retinopati, utveckling av glaskroppsblödning eller varaktigheten av glaskroppsblödning, och det kan användas säkert för andra medicinska indikationer utan okulär kompromiss.7
Behandlingen av patienter med diabetes bör inkludera rekommendationer om motion. De med mild icke-proliferativ retinopati kan börja med fysisk aktivitet på ett säkert sätt. Patienter med måttlig icke-proliferativ retinopati bör dock undvika aktiviteter som kraftigt ökar blodtrycket, t.ex. styrkelyft.15 Patienter med svår icke-proliferativ eller instabil retinopati bör undvika all fysisk aktivitet som är kraftig (hoppning, skakningar), alla aktiviteter med huvudet nedåt och andningsuppehåll.15 Vid glaskroppsblödning bör ingen motion utövas.15
Främtidig upptäckt av diabetisk retinopati är viktig eftersom behandling kan förhindra eller vända synförlust. I Diabetic Retinopathy Study (DRS) fann forskarna att fotokoagulationskirurgi var en effektiv behandling av diabetisk retinopati. Early Treatment Diabetic Retinopathy Study och DRS visade att fotokoagulation minskade risken för synförlust, med störst fördel hos patienter som hade mer avancerad sjukdom i utgångsläget.16,17 Aktuella data ger belägg för att intravitreala anti-VEGF-preparat (antivascular endothelial growth factor) är effektivare vid behandling av makulaödem än monoterapi eller kombinationsbehandling med laserkoagulation.8 Dessutom kan anti-VEGF förbättra synen, medan fotokoagulation endast förhindrar ytterligare synförlust.18,19 En nackdel med anti-VEGF är att det krävs månadsvis intravitreal behandling under de första 12 månaderna.
Kliniska pärlor
- Det finns inga specifika tecken eller symtom på tidig diabetisk retinopati.
- Screening för diabetisk retinopati bör ske hos patienter:
– med typ 1-diabetes fem år efter diagnosen.
– hos patienter med typ 2-diabetes vid diagnosen.
- Rådgivning och ökade undersökningar bör erbjudas diabeteskvinnor som planerar att bli eller blir gravida, eftersom diabetisk retinopati kan accelerera snabbt under graviditeten.
- Straff glykemisk kontroll och kontroll av blodtrycket (< 140 mmHg systoliskt) kan förhindra utvecklingen av diabetisk retinopati.
- Upp till 50 % av patienterna med albuminuri (oberoende av eGFR-nivå) kommer att ha retinopati.9
- Behandling med fotokoagulering kan förhindra sjukdomsprogression och anti-VEGF-behandling kan reversera synförlust på grund av makulaödem.
Diabetes och njursjukdom
Diabetes och njursjukdom (DKD), som är den terminologi som föredras av ADA, är den främsta orsaken till kronisk njursjukdom (CKD) i Förenta staterna.20,21 DKD har betydande långsiktiga effekter på livskvaliteten hos patienter med diabetes och är ansvarig för upp till 40 % av njursjukdom i slutstadiet (ESRD).20 Baserat på National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative (KDOQI) och ADA 2017 Standards of Care kommer detta avsnitt att ge vägledning om målnivåer för HbA1c, läkemedelshantering och terapeutisk behandling för patienter med DKD.
KDOQI stratifierar målnivån för HbA1c efter patientens risk för hypoglykemi och komorbiditeter. Detta initiativ bygger på tre publikationer som visar att glykemisk kontroll med HbA1c under 7 % förebygger eller minskar utvecklingen av njursjukdom hos patienter med typ 2-diabetes.22,23,24 Dessa studier sammanfattas i tabell 2. ADA rekommenderar att hos patienter med högre risk för hypoglykemi bör målet för HbA1c höjas till över 7 %.8 KDOQI rekommenderar att patienter med CKD steg 4 och 5 som har begränsad förväntad livslängd upprätthåller ett HbA1c över 7 %.25
Tabell 2. Utvalda landmärkesstudier som visar glykemisk kontroll med A1c under 7 % |
|
|
Trial |
Resultat |
|
Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% minskning av ny makroalbuminuri och njurersättningsbehandling med A1c under 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% minskning av makroalbuminuri och 32 % minskning av mikroalbuminuri med A1c under 7 % |
|
The Action to Control Cardiovascular Risk in Diabetes (ACCORD) study24 |
2 % minskning av makroalbuminuri och 21 % minskning av mikroalbuminuri med A1c under 7 % |
Epidemiologi. Män och kvinnor drabbas lika mycket av DKD.20 Den högsta incidensen för att utveckla DKD är 15 år efter diagnosen.21 Afroamerikaner löper tre till fem gånger större risk att utveckla diabetisk nefropati än kaukasier.20 Mexikanska amerikaner och Pima-indianer löper också högre risk att utveckla DKD.20
Proteinuri är en prediktor för kardiovaskulär sjuklighet och dödlighet av alla orsaker vid diabetes.21 Förekomst av DKD är en faktor för ökad risk för kardiovaskulär sjukdom. Patienter med DKD har genomgående högre dödlighet i kardiovaskulära sjukdomar.26 Dessutom är dödligheten av alla orsaker högre hos patienter med DKD.21
I typ 1-diabetes börjar mikrovaskulära komplikationer som DKD att utvecklas cirka 10-20 år efter diagnosen; i typ 2-diabetes är den exakta debuten ofta okänd och motiverar därför en tidigare screening.27
Patofysiologi och patogenes. Hyperglykemi anses framkalla tre viktiga histologiska förändringar i glomeruli som leder till DKD: 1) mesangial expansion, 2) förtjockning av det glomerulära basalmembranet och 3) glomerulär skleros.28 Även om den exakta patogenesen för varför DKD uppkommer är okänd, anses hyperglykemi initialt orsaka hyperfiltrering och njurskada till följd av histologiska förändringar och aktivering av cytokiner.20 Vanligtvis kan albuminuri vara det första tecknet på DKD.29
Detta förvärras ytterligare till följd av komorbida tillstånd som hyperlipidemi, åderförkalkning, hypertoni och fetma, som alla bidrar till njurskador och efterföljande funktionsnedsättning. Central fetma leder till hypertoni genom hyperaktivering av renin-angiotensin-aldosteronsystemet och det sympatiska nervsystemet.20 När njurkärlen blir arteriosklerotiska sker dessutom en ökad progression av diabetisk nefropati. Ett viktigt särskiljande drag för diabetisk nefropati jämfört med andra former av CKD är att glomeruli och njurar vanligtvis är normala eller ökade i storlek initialt.20
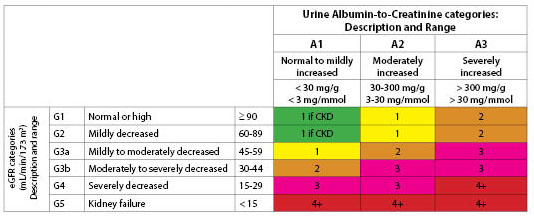
Klassificering. Både eGFR och förekomst av albuminuri används för att stadga CKD.30,31 eGFR baseras på ras, ålder, kön, vikt och serumkreatininnivåer. (Se tabell 3.) Historiskt sett användes termen mikroalbuminuri för att definiera måttligt förhöjda albuminnivåer. National Kidney Foundation rekommenderar nu att man använder termerna ”mild”, ”måttligt” eller ”kraftigt förhöjd” för att beskriva albuminuri nivåer baserat på nivåerna i tabell 4.31 Albumin-till-kreatininförhållandet är det första testet som används för att upptäcka albuminuri.
Tabell 3. Uppskattad GFR med stadium och beskrivning |
|||
|
Steg |
GFR (mL/min per 1.73 m2) |
Beskrivning |
|
|
90+ |
Glomerulär hyperfiltration |
||
|
Mildt nedsatt njurfunktion |
|||
|
3A |
Måttligt nedsatt njurfunktion |
||
|
3B |
|||
|
Svårt nedsatt njurfunktion |
|||
|
< 15 eller på dialys |
Slut-stadium av njursvikt |
||
Tabell 4. Kategorier av albuminuri i CKD |
|||
|
Kategori |
Albumin tillKreatininnivåer |
Beskrivning |
|
|
A1 |
< 30 |
Normal till lätt ökad |
|
|
A2 |
Måttligt ökad Ökad |
||
|
A3 |
> 300 |
Svårt ökad |
|
De två klassifikationsscheman representerar den dubbla vägen till att utveckla CKD. Den ena är genom förhöjt kreatinin och försämrad GFR. Den andra är genom utveckling av albuminuri. Ökande albuminuri följs ofta av en försämring av eGFR;32 detta kan dock avvärjas genom användning av ACE-hämmare (angiotensinkonverterande enzym) eller ARB (angiotensinreceptorblockerare) och glykemisk kontroll. (Se figur 1.)
Figur 1. Föreslagen utvärderingsfrekvens (antal gånger per år) per eGFR- och albuminuriakategori
Upptryckt med tillstånd från Kidney Disease: Förbättra globala resultat (KDIGO).
Gemensamma symtom. De flesta människor har inga symtom från diabetisk nefropati. Ofta kan patienterna ha tecken på eller diagnos av andra mikrovaskulära komplikationer.20 Tidig DKD är vanligtvis asymtomatisk. Ett sent fynd av DKD är skummig urin. Om en patient dessutom är allvarligt hypoalbuminemisk kan han eller hon presentera fotödem och trötthet.20 Patienter med DKD har vanligtvis systemisk hypertoni. Patienter med diabetisk nefropati har vanligtvis också retinopati och neuropati.8
Diagnostiska alternativ. Eftersom det inte finns några symtom är rutinmässig screening avgörande. ADA rekommenderar årlig screening av ett förhållande mellan urinalbumin och kreatinin.8 Dessutom bör eGFR testas minst en gång om året hos patienter med typ 1-diabetes med en varaktighet på fem år och bland alla patienter med typ 2-diabetes eller patienter med komorbid hypertoni och diabetes.8 Det finns ingen tydlig rekommendation om att erhålla avbildning, till exempel ultraljud, för att diagnostisera DKD.
Differentialdiagnostik. Vissa röda flaggor kan tyda på att diabetes inte är den enda orsaken till CKD. Om en person har avancerad CKD utan tecken på andra mikrovaskulära komplikationer är detta en varning. Öppen proteinuri med plötslig debut (mindre än fem år efter insjuknandet i diabetes) av urinsediment med dysmorfiska röda blodkroppar och avgjutningar, eller en plötslig minskning av GFR, tyder på en njursjukdom av icke-diabetisk etiologi.20 Serum- eller urinelektrofores kan göras om det finns en oro för multipelt myelom. Avsaknaden av albuminuri med ett minskat eGFR och diabetes kräver utredning för andra orsaker till CKD än DKD.21 I tabell 5 listas röda flaggor som tyder på en icke-diabetisk glomerulär sjukdom.
Tabell 5. Röda flaggor som tyder på icke-diabetisk glomerulär sjukdom
- Debut av proteinuri < 5 år från dokumenterad debut av typ 1-diabetes eller akut debut av njursjukdom
- Akut nedgång av eGFR; Diabetisk nefropati
- Urinsediment som innehåller dysmorfiska erytrocyter eller cellutgjutningar
- Frivaro av andra mikrovaskulära komplikationer såsom neuropati eller retinopati
- Signaler och/eller symtom på en annan systemsjukdom
Behandling. Ett kännetecken för diabetesnefropati är hantering av glukos, saltreduktion, blodtryck och dyslipidemi. Dessutom bör patienterna undvika nefrotoxiska läkemedel och kosttillskott som aminoglykosider och icke-steroida antiinflammatoriska medel. Patienterna bör remitteras till en nefrolog vid njursjukdom i stadium IV eller om njurfunktionen snabbt försämras. Andra indikationer för remiss beror på hur komplicerat fallet är. Nyare orala läkemedel mot diabetes kan bidra till att förhindra utvecklingen av njursvikt.
Glykemisk kontroll. Läkemedelsval, övervakning och farmakologi påverkas alla hos patienter med diabetisk nefropati. När patientens eGFR sjunker kommer vissa orala medel att kräva dosjustering. Insulin förblir den centrala behandlingen för glukoskontroll hos patienter med diabetes och avancerad CKD.31 Tabell 6 visar de rekommenderade dosjusteringarna för antiglykemiska läkemedel hos patienter med njursjukdom. År 2016 visades både empagliflozin och canagliflozin minska progressionen av CKD och mikroalbuminuri.33,34 Empagliflozin sänkte graden av nefropatiprogression och minskade risken för större negativa kardiovaskulära händelser jämfört med placebo när det lades till standardbehandling av typ 2-diabetes i den banbrytande resultatstudien Empaglifliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG).33
Tabell 6. Dosjusteringar och rekommendationer för glukossänkande medel hos patienter med nedsatt njurfunktion |
||
|
Glukos- |
Dosjusteringar vid nedsatt njurfunktion |
|
Klass |
Medicinering |
|
|
Biguanider |
Metformin |
eGFR 30 till 45 mL/min/1.73 m2: Rekommenderas inte att inleda behandling. Om efter initiering, bedöma fördelar/risker med fortsatt behandling. eGFR < 30 mL/min/1,73 m2: Användning är kontraindicerad |
|
Sulfonylureas |
Glimepirid |
Lätt till måttligt nedsatt funktionsförmåga: Inleda med 1 mg en gång dagligen Svårt nedsatt funktionstillstånd: Användning är kontraindicerad |
|
Glipizid |
Förlängd frisättning: Börja med 2,5 mg en gång dagligen |
|
|
Glyburid |
eGFR < 60 ml/min/1,73 m2: Användning rekommenderas inte |
|
|
Meglitinider |
Nateglinid |
Nej dosjustering nödvändig |
|
Repaglinid |
CrCl 20 till 40 ml/min: Inleda vid 0.5 mg med måltider CrCl < 20 mL/min: Ingen information |
|
|
Thiazolidinedioner |
Pioglitazon |
Ingen dosjustering. nödvändig |
|
Rosiglitazon |
Ingen dosjustering nödvändig |
|
|
α-Glukosidashämmare |
Akarbose |
SCr > 2.0 mg/dL: Användning rekommenderas inte |
|
Miglitol |
CrCl < 25 mL/min eller SCr >2.0 mg/dL: Användning rekommenderas inte |
|
|
DPP-4-hämmare |
Alogliptin |
CrCl 30 till 60 mL/min: 12.5 mg en gång dagligen CrCl < 30 mL/min: 6,25 mg en gång dagligen ESRD som kräver hemodialys: 6.25 mg en gång dagligen och administrera utan hänsyn till tidpunkten för hemodialys |
|
Linagliptin |
Ingen dosjustering nödvändig |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg en gång dagligen ESRD som kräver hemodialys: 2.5 mg en gång dagligen och administrera efter hemodialys |
|
|
Sitagliptin |
CrCl 30 till 50 ml/min: 50 mg en gång dagligen CrCl < 30 ml/min: 25 mg en gång dagligen ESRD som kräver hemodialys eller peritonealdialys: 25 mg en gång dagligen och administrera utan hänsyn till tidpunkten för hemodialys |
|
|
Vildagliptin |
CrCl < 50 mL/min: 50 mg en gång dagligen |
|
|
Gallsyrasekvestranter |
Colesevelam |
Inga dosjusteringar nödvändiga |
|
Dopamin-2-agonister |
Bromokriptin |
Ingen information |
|
SGLT-2-hämmare |
Canagliflozin |
eGFR 45 till 60 mL/min/1.73 m2: Överskrid inte 100 mg en gång dagligen eGFR < 45 mL/min/1,73 m2: Rekommenderas inte att inleda behandlingen. Om efter initiering, avbryt behandlingen för patienter med eGFR som persistent är < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodialys: Användning är kontraindicerad |
|
Dapagliflozin |
eGFR < 60 ml/min/1,73 m2: Rekommenderas inte att påbörja behandlingen. Om efter initiering, avbryt behandlingen för patienter med eGFR som varaktigt ligger mellan 30 och < 60 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2/ESRD/Hemodialys: Användning är kontraindicerad |
|
|
Empagliflozin |
eGFR < 45 ml/min/1,73 m2: Rekommenderas inte att påbörja behandlingen. Om efter initiering, avbryt behandlingen för patienter med eGFR som varaktigt < 45 mL/min/1,73 m2. eGFR < 30 mL/min/1,73 m2. ESRD/ Hemodialys: Användning är kontraindicerad |
|
|
GLP-1-receptoragonister |
Albiglutid |
Ingen dosjustering nödvändig |
|
Dulaglutid |
Ingen dosjustering nödvändig |
|
|
Exenatid |
CrCl 30 till 50 mL/min: Ingen information. Använd med försiktighet. CrCl < 30 mL/min/ ESRD: Användning rekommenderas inte |
|
|
Liraglutid |
Ingen information |
|
|
Lixisenatid |
eGFR 15 till 29 mL/min/1.73 m2: Ingen information. Övervaka för ökade negativa GI-effekter som kan leda till uttorkning och försämrad njurfunktion. eGFR <15 mL/min/1.73 m2/ ESRD: Användning rekommenderas inte |
|
|
Amylinmimetika |
Pramlintid |
CrCl ≥15 mL/min: Ingen dosjustering nödvändig ESRD: Ingen information |
|
Insuliner |
Rapid-verkande analoger
Kortverkande
Intermediär-verkande
Basala insulinanaloger
|
Insulinbehovet kan minskas på grund av förändringar i insulinclearance eller metabolism. Övervaka blodglukos noggrant. |
Blodtryck. Behandling av blodtrycket bör påbörjas vid 140/90 mmHg för patienter med diabetes och diabetisk njursjukdom.37 I United Kingdom Prospective Diabetes Study (UKPDS) fann man en 12-procentig minskning av risken för diabeteskomplikationer för varje 10 mmHg sänkning av det systoliska trycket fram till dess att trycket var 120 mmHg.38 De läkemedel som är att föredra förblir ACE-hämmare eller ARB:er för personer med hypertoni och diabetes, DKD och CKD. ACE-hämning har visat sig fördröja utvecklingen av DKD när den initieras hos patienter med lätt förhöjd albuminuri. Kreatinin kan stiga med upp till 30 % vid initiering av en ACE-hämmare eller ARB.39 Överväg att utvärdera om det finns andra underliggande njursjukdomar om kreatininet stiger mer än så.
KDOQI rekommenderar att man avråder från att ge ACE/ARB:er till typ 2-diabetespatienter som är normotensiva och normoalbuminuriska patienter.40,41,42 ACE-hämmare eller ARB föreslås för diabetespatienter som är normotensiva med mikroalbuminuri.31,37 Det finns ingen specifik dos eller titrering för dessa personer. Dubbel blockering av renin-angiotensinsystemet med både ACE och ARB rekommenderas inte på grund av den ökade risken för hyperkalemi, nedsatt njurfunktion och hypotoni.43
Saltreduktion. 2012 Reduction of Endpoints in Non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan (RENAAL) Trial och Irbesartan Diabetic Nephropathy Trial (IDNT) visade att natriumfattig kost ökade de nefroprotektiva och kardioprotektiva effekterna av ARB:er hos patienter med typ 2-diabetes och diabetisk nefropati.44,45
Njurdialys och njurtransplantation. Patienter med ESRD bör hänvisas till nefrologi. Behandlingsalternativen omfattar peritonealdialys eller hemodialys, njurtransplantation eller alternativet att avbryta behandlingen och påbörja palliativ vård eller hospicevård. En observationsstudie visade att patienter som påbörjade dialys vid yngre ålder (< 60 år) hade sämre överlevnad.46
Omläggning. Figur 1 innehåller indikationer för remittering baserat på GFR- och albuminurieklassificering. Överväg andra orsaker till njursjukdom som inte är relaterade till diabetes, särskilt hos patienter med typ 1-diabetes där uppkomsten av retinopati inte föregår utvecklingen av nefropati.21 Nefrologer kan hjälpa till att klargöra diagnosen, kontrollera resistent hypertoni och hyperkalemi och förbereda patienterna för dialys.8
Det är också viktigt att tänka på att utvecklingen av nefropati inte nödvändigtvis är relaterad till själva diabetessjukdomen. Hos patienter med typ 1-diabetes föregår vanligtvis uppkomsten av retinopati utvecklingen av nefropati.47 En person som uppvisar nefropati men ingen retinopati bör få en utvärdering för andra orsaker. Man bör hänvisa till en nefrolog för att fastställa orsaken till nefropati när det är osäkert eller när det finns svårhanterliga, DKD-relaterade problem, inklusive anemi, hyperparatyreoidism och framskridande njursjukdom med ett eGFR < 30 mL/min/1,73 m2.8 Att ha en konsulterande nefrolog när CKD i steg 4 utvecklas (eGFR < 30 mL/min/1,73 m2) är förknippat med minskad sjuklighet, minskade vårdkostnader och fördröjd dialys.48 Överväg en remiss vid stadium 3B för att förbereda patienterna tidigare och för att nefrologin ska kunna behandla maximalt medicinskt.
Kliniska pärlor
- Årlig DKD-screening för DKD bör ske genom urinalbumintest och en mätning av eGFR.
- Blodtrycks- och glukoskontroll kan ge förebyggande åtgärder mot nefropathiprogress. Håll blodtrycket < 140/90 mmHg hos patienter med diabetes och CKD. ACE-hämmare eller ARB bör vara den behandling som väljs.
- ACE-hämmare och ARB bör inte användas för att förebygga nefropati om blodtryck och proteinutsöndring är normala. ACE-hämmare och ARB bör inte användas i kombination.
- Patienter med CKD stadium 3-5 har en ökad risk för hypoglykemi. Försiktighet bör iakttas med orala medel som sulfonureider.
- För vissa patienter med CKD är det lämpligt att sätta målet för HbA1c > 7 %, särskilt när risken för hypoglykemi är stor.
Diabetisk perifer neuropati
En allmänt accepterad definition av diabetisk perifer neuropati (DPN) i klinisk praxis är ”förekomsten av symtom och/eller tecken på perifer nervdysfunktion hos personer med diabetes efter att andra orsaker har uteslutits”.”49 ADA:s klassificering av distal symmetrisk polyneuropati är: 1) huvudsakligen småfibrig neuropati, 2) huvudsakligen storfibrig neuropati och 3) blandad små- och storfibrig neuropati (vanligast).
Patofysiologi och patogenes. Utvecklingen och progressionen av DPN uppstår på grund av de komplexa relationerna mellan nerverna och de omgivande cellerna.50 Både vaskulära faktorer och metaboliska interaktioner bidrar till alla stadier av DPN.51 Den allmänt accepterade förståelsen i mänsklig diabetes som leder till utveckling av DPN är det komplexa samspelet mellan hyperglykemi, diabetessjukdomens varaktighet, åldersrelaterade neuronala skador, graden av blodtrycks- och blodfettkontroll samt vikt.52,53,54,55 Hyperglykemi aktiverar ett flertal biokemiska vägar som bestämmer nervcellens metabola tillstånd och kombineras med försämrad nervperfusion, vilket bidrar till progressionen av neuropatier. En banbrytande studie, DCCT, stöder betydelsen av hyperglykemi i patogenesen av neuropati.10,56,57 En annan hyperglykemi-relaterad mekanism som leder till DPN är hyperglykemi-inducerad oxidativ och nitrosativ stress med en ökad produktion av fria radikaler.58,59
Inom hyperglykemi har låggradig inflammation nyligen föreslagits spela en viktig roll i patogenesen för diabetiska neuropatier, vilket leder till brister i perifera och autonoma nervfibrer.51,60 Den komplexa uppsättningen av metaboliska och vaskulära faktorer utlöser obalansen mellan skador och reparationer i nervfibrer, vilket specifikt påverkar distala sensoriska fibrer och bidrar till den gradvisa känselförlusten som manifesterar de kliniska symtomen på diabetisk polyneuropati.58,61
Högsta symtom. När man frågar efter upplevda symtom på DPN bör man notera lokalisering (mest sannolikt känns det i händer och fötter), utlösande faktorer, egenskaper hos besvären samt debut och frekvens av nattlig exacerbation eftersom symtomen är patientspecifika.4 Både små och stora fibrer påverkas av förhöjt blodsocker och de upplevda symtomen varierar beroende på vilken klass av sensoriska fibrer som påverkas. När de drabbade nervfibrerna huvudsakligen är små är de symtom som utlöses vanligen smärta (stickande, lanserande, stickande, brännande, värkande, tråkig och överdrivet känslig), dysestesier (obehagliga förnimmelser av brännande, stickande, stickande och stickande) och domningar.4
Intensiteten av obehaget kan sträcka sig från att känna mindre onormala förnimmelser till att bli handikappad av smärtan som kan förvärras på natten och störa sömnen, vilket har visat sig vara förknippat med depression på grund av en uppfattning om sänkt livskvalitet.4
Å andra sidan, när stora fibrer övervägande påverkas, kan patienterna känna domningar och stickningar i extremiteterna, uppleva ostadig gång och förlora balansen (vilket leder till potentiella fall).4 Vissa patienter kan uppleva att symtomen förvärras när blodglukosnivåerna sjunker på grund av intensifierad terapeutisk behandling av diabetes. Patienterna kan vara asymtomatiska men med olika grader av känselförlust; ett oönskat resultat av allvarlig känselförlust på grund av diabetisk neuropati kan vara smärtfri skada, vilket leder till en ökad risk för fotsår eller, i allvarliga fall, amputation.62
Den vanligaste formen av diabetisk perifer neuropati är distal symmetrisk polyneuropati med en progressiv förlust av sensoriska nervfibrer.4 Det typiska ”strumpmemönstret” bilateralt skapas av de skador som uppstår på de mest distala delarna av de längsta nerverna (som drabbas först).63,64,65 Med tiden uppstår ett ”strumphandskemönster”, som främjar känselförlust och typiska symtom på DNP, från proximalt fortskridande av nervbrister.4
Klinisk diagnostik. En klinisk diagnos av DPN kan ställas baserat på neuropatiska tecken och symtom hos en patient med diabetes efter att ha uteslutit andra orsaker till neuropati.66 Asymtomatisk diabetisk perifer neuropati kan förekomma hos upp till 50 % av dem som har denna komplikation; därför är det viktigt att genomföra förebyggande fotvård, särskilt för dem som löper stor risk för skador på grund av känselfria fötter.4 Årlig screening för DPN bör utföras hos alla patienter med diabetes genom pinprick, temperatur, vibrationsuppfattning (med hjälp av en stämgaffel på 128 Hz), tryckkänsla med 10-g monofilament och djupa senreflexer i fotleden. Potentiella fotsår kan förutsägas genom förlust av 10-g monofilamentkänsla (förlust av skyddande känsla) och minskad vibrationsuppfattning.63 ADA:s Standards of Medical Care in Diabetes-2017 fortsätter att rekommendera ett årligt 10-g monofilamenttest i syfte att identifiera patienter som löper risk att utveckla sårbildning och amputation.8 Dessutom rekommenderar ADA:s riktlinjer från 2017 screening för DPN vid diagnos av typ 2-diabetes och fem år efter diagnos av typ 1-diabetes.8
År 2009 uppdaterade Torontos konsensuspanel för diabetesneuropatier de diagnostiska kriterierna för att tillhandahålla diagnostiska kategorier. Dessutom kan flera välvaliderade screeninginstrument inkluderas av vårdgivare i diagnostiseringsprocessen, inklusive Michigan Neuropathy Screening Instrument (MNSI), Toronto Clinical Neuropathy Score och Utah Neuropathy Scale. I tabell 7 beskrivs andra orsaker till neuropati som bör uteslutas.
Tabell 7. Andra orsaker till neuropati67
- Alkohol eller andra gifter
- Neurotoxiska läkemedel, särskilt kemoterapi
- Vitamin B12-brist
- Hypotyreos
- Renal sjukdom
- Maligniteter (multipelt myelom,
- Humant immunbristvirus (HIV)
- Kronisk inflammatorisk demyeliniserande neuropati, ärftliga neuropatier och vaskulit
Diagnostiska studier. Det finns flera diagnostiska undersökningar för att bekräfta förekomsten av DPN. Nervledningsstudier har i flera år ansetts vara den gyllene standarden för diagnostiskt test för DPN på grund av deras objektiva mått utan patienternas svar, vilket leder till hög tillförlitlighet.4 Kvantitativ sensorisk testning utvärderar patienternas förmåga att upptäcka lätt beröring, vibrationer och temperaturdiskriminering, vilket inbegriper en viss grad av subjektivitet.4 Andra metoder, inklusive hudbiopsi och intraepidermal nervfibertäthet och korneal konfokal mikroskopi, har inte använts rutinmässigt i klinisk praxis, men kan användas i kliniska prövningar.4
Behandlingsalternativ: Farmakologisk behandling. Den farmakologiska behandlingen av DPN syftar till symtomförbättring, så de läkemedel som används är inte avsedda att förhindra progression. Tabell 8 sammanfattar läkemedel från de tre vanligaste klasserna (antikonvulsiva medel, antidepressiva medel och opioider) för att kontrollera neuropatiska symtom. Även om flera medel vanligen används som förstahandsval vid behandling av DPN är det endast pregabalin och duloxetin som har godkänts av FDA för behandling av detta tillstånd; därför rekommenderas något av dessa medel som förstahandsval vid symtomatisk neuropatisk smärta.4 Gabapentin används ofta som förstahandsval, även om det inte är FDA-godkänt för behandling av DPN, och har en jämförande effekt med de FDA-godkända medlen. Tricykliska antidepressiva medel (t.ex. amitriptylin) – som inte är FDA-godkända DPN-medel – är effektiva vid behandling av DPN, men de bör användas med försiktighet på grund av högre risk för biverkningar.
Tabell 8. Vanligt använda farmakologiska medel för DPN4,69 |
||||||
|
Farmaceutiskt medel (NNT-intervall 30-50 % förbättring*) |
Max daglig dos för DNP (mg/dag) |
Högsta tillåtna dos för DNP (mg/dag) |
Högsta möjliga biverkningar |
Behövs dosjusteringar? |
Kontraindikationer |
Kontroller vid förskrivning |
|
Antikonvulsiva medel
|
||||||
|
Pregabalin (3.3-8.3) |
Svindel Somnolens Viktökning Perifert ödem Suddig syn Förstoppning |
Renal: Ja Hepatisk: Nej |
Överkänslighet mot pregabalin |
Starka bevis; FDA-godkänd; kontrollerad substans |
||
|
Gabapentin (3.3-7.2) |
3,600 |
Svindel Ataxi Somnolens Huvudvärk Nausea Diarré Viktsökning |
Renal: Ja Hepatisk: Nej |
Överkänslighet mot gabapentin |
Måttlig evidens; inte FDA-godkänd |
|
|
Antidepressiva medel
|
||||||
|
Amitriptylin (2.1-4.2) |
Svår sedering; förvirring; antikolinerga effekter (förstoppning, suddig syn) |
Renal: Nej Hepatisk: Nej Lägre doser rekommenderas för äldre patienter |
Överkänslighet mot amitriptylin; samtidig administrering med eller inom 14 dagar av MAO:er; samtidig administrering med cisaprid; Akut återhämtningsfas efter hjärtinfarkt |
Måttlig evidens; inte FDA-godkänd; användning med försiktighet för personer med en historia av kardiovaskulär sjukdom |
||
|
Duloxetin (3.8-11) |
(USA) |
Nausea; sedation; generaliserad sömnighet |
Renal: Ja Hepatisk: Undvik användning vid nedsatt leverfunktion |
Hypersensitivitet; samtidig administrering med eller inom 14 dagar av MAOs; initiering hos dem som får linezolid eller intravenöst metylenblått |
Måttlig evidens; FDA godkänt; kan läggas till pregabalin eller gabapentin |
|
|
Venlafaxin (5.2-8.4) |
Nausea; sedation; generaliserad sömnighet |
Renal: Ja Hepatisk: Ja |
Svaga bevis; inte FDA-godkänt; kan läggas till gabapentin |
|||
|
Opioider
|
||||||
|
Tramadol (2.1-6.4) |
Somnolens Nausea Kräkningar Konstipation Lätt huvudvärk Svimmelhet Svårighet Huvudvärk |
Renal: Ja Hepatisk: Nej |
Överkänslighet mot tramadol, opioider eller någon komponent i formuleringen; ER-formulering: Betydande andningsdepression och akut eller svår astma; IR-formulering: Akut intoxikation med alkohol, hypnotika, narkotika, centralt verkande analgetika, opioider eller psykotropa läkemedel |
Låg potential för missbruk (kontrollerad substans enligt förteckning IV); inte rekommenderat för användning som första- eller andrahandsmedel |
||
|
Tapentadol (N/A) |
Immediat frisättning: Förlängd frisättning: |
Somnolens Nausea Kräkningar Konstipation Svindel |
Renal: Användning rekommenderas inte när Hepatisk: Nej |
Överkänslighet mot tapentadol; betydande andningsdepression; akut eller svår astma; paralytisk ileus; inför 14 dagar efter användning av MAO-hämmare |
FDA-godkänd; kontrollerad substans enligt förteckning II; inte rekommenderat för användning som första- eller andrahandsmedel |
|
|
Informationen avser farmaceutiska medel hämtade från respektive bipacksedlar (refereras med handelsnamn) |
||||||
Riktlinjen från American Academy of Neurology (AAN) rekommenderar följande topiska medel: Det rekommenderas följande topiska medel: Capsaicin och isosorbiddinitratspray (måttlig evidens) och Lidoderm-plåster (svag evidens).69 Oxkarbazepin, lamotrigin, lacosamid, klonidin, pentoxifyllin och mexiletin rekommenderas inte i AAN:s riktlinje för behandling av DPN.69
Det finns dessutom opioider som vissa rekommenderar att användas vid refraktär DPN. De opioider som rekommenderas i AAN:s riktlinje omfattar dextrometorfan (400 mg/dag), morfinsulfat (titrerat till 120 mg/dag) och oxikodon (medelvärde 37 mg/dag, max 120 mg/dag), men det finns inga tillräckliga data för att föreslå att man använder det ena medlet framför det andra.69 Författarna till den här artikeln rekommenderar att man endast använder opioider i svåra refraktära fall med noggrann övervakning av de patienter som får en verklig funktionell förbättring av opioider. Författarna följer 2016 års ställningstagande från Centers for Disease Control and Prevention om att opioider har begränsad långsiktig användning vid smärta av icke-cancertyp.70
En av utmaningarna vid farmakologisk behandling av DPN är otillräckliga head-to-head-studier med integrering av livskvalitetsresultat.4 En nyligen genomförd studie som jämförde en åttaveckorsbehandling bland högdos pregabalin, högdos duloxetin eller i en kombination fann inga signifikanta skillnader i genomsnittlig smärtförändring mellan monoterapi och kombinationsbehandling.71 Fler studier som jämför två aktiva substanser behövs för att ge insikt om hur man kan förbättra vården för dem som lider av diabetisk perifer neuropati.
Nonfarmakologisk behandling. Förfaranden. I ANN-riktlinjen föreslås att man överväger perkutan elektrisk nervstimulering i tre till fyra veckor för behandling av DPN.69 En randomiserad, kontrollerad pilotstudie72 med akupunktur i två stilar och en enkelblind, placebokontrollerad, randomiserad studie73 som utvärderade akupunkturens effektivitet vid DPN visade båda på förbättringar av utfallsmått i samband med smärta. Det behövs dock ytterligare studier för att bekräfta akupunkturens roll i behandlingen av DPN.
Alpha-liponsyra. Vissa bevis tyder på att användningen av antioxidanten alfa-liponsyra kan bidra till att minska den fria radikalmedierade oxidativa stressen och ge följande fördelar: rikta in sig på patogenesen, bromsa utvecklingen och förbättra symtomen vid DPN.74,75
Förebyggande. Livsstilsförändringar, med fokus på hälsosam kost och fysisk aktivitet, har kontinuerligt visat sig minska prevalensen av diabetes och dess komplikationer, inklusive diabetisk perifer neuropati.68 Intensiv glykemisk kontroll har visat sig bidra till att sänka risken för diabetisk neuropati hos patienter med diabetes genom att förbättra nervfunktionen.61,76,77 DCCT fastställde den roll som glykemisk kontroll spelar för att förebygga och upphöra med utvecklingen av diabetisk neuropati vid typ 1-diabetes.10,56
Kliniska pärlor
- Upp till 50 % av patienterna kan ha smärtfri eller asymtomatisk perifer neuropati.
- Patienter med neuropati rekommenderas fotvårdsutbildning (daglig självinspektion av fötterna) och regelbunden fotvård för utvalda patienter.
- Patienter med DPN som uppvisar tecken på förlust av skyddande känsel med eller utan deformitet bör rekommenderas att följa upp med en läkare var tredje till sjätte månad för förebyggande åtgärder.64
- För att effektivt hantera symtom på DPN blir ett multidisciplinärt tillvägagångssätt viktigt; detta omfattande tillvägagångssätt kan inkludera farmakologisk, psykologisk och/eller fysisk terapi.
- I ett nytt ställningstagande om diabetisk neuropati som publicerats av ADA rekommenderas screening för DPN hos patienter med prediabetes som uppvisar symtom på perifer neuropati.4
- Specialiserad vård behövs för personer med perifer sjukdom, icke-sensorisk neuropati eller Charcot-fot.
Gastropares
En annan form av diabetesneuropati är gastropares. Detta tillstånd är förknippat med övre gastrointestinala symtom inklusive illamående, kräkningar, tidig mättnad eller postprandiell mättnad, buksmärta och uppblåsthet, men i avsaknad av utloppsobstruktion. Även om det finns ett antal orsaker till gastropares har man uppskattat att diabetes står för ungefär en tredjedel av alla fall.78
Patofysiologi. Föreslagna patofysiologiska mekanismer för diabetisk gastropares inkluderar försämrad glykemisk kontroll, vagal eller prevertebral sympatisk ganglianeuropati, avvikelser i Cajals interstitiella celler, förlust av kväveoxidsyntas och eventuellt myopati.79,80
Klinisk presentation. Tidigt i detta tillstånd är patienterna vanligtvis symtomfria. Det finns inget linjärt samband mellan symtom och neuropathins svårighetsgrad. Den stora variationen av symtom gör det svårt att diagnostisera tillståndet. Andra kliniska presentationer är anorexi, undernäring, viktnedgång och hypoglykemi på grund av missförhållandet mellan absorption av mat och insulin. Smärta kan faktiskt vara underrapporterad men betydande för många människor. I ett NIH-finansierat konsortium hade 72 % av patienterna med gastroparesis buksmärta.81 Detta var det dominerande symtomet hos 18 % av dessa patienter. Smärtan framkallades av att äta (72 %), var nattlig (74 %) och störde sömnen (66 %) för dessa patienter.81
Hur vanligt är diabetes gastropares? Den kumulativa tioårsincidensen av gastropares har uppskattats till 5,2 % vid typ 1-diabetes och 1 % vid typ 2-diabetes bland samhällspatienter med diabetes82 . Andra studier har funnit att frekvenserna ligger mellan 5 och 12 %.83,84 Frekvensen är dock mycket högre när diagnosen baseras på symtom snarare än på studien av magentömning.
Gastropares är vanligare vid typ 1-diabetes än vid typ 2-diabetes, och det är vanligast att den uppträder efter det att personen har haft diabetes i mer än 10 år och har utvecklat de andra mikrovaskulära komplikationerna retinopati, nefropati och perifer neuropati. Om en patient uppvisar gastropares tidigare än väntat bör andra etiologier undersökas, oftast perioperativ vagal nervskada eller farmakologiska effekter av inkretinbaserade medel – glukagonliknande peptid-1-receptoragonister (GLP-1RA) och dipeptidylpeptidas 4-hämmare (DPP-4-hämmare).
När en patient väl utvecklar symtom från gastropares, kvarstår symtomen vanligen och är stabila under 12-25 år. Detta gäller även om glukoskontrollen förbättras,85 utom vid pankreas- och njurtransplantation.86 Även om det inte finns några tydliga bevis för att gastropares ökar mortaliteten i sig, minskar den väsentligt alla aspekter av livskvaliteten.87
Diagnostik. Ett antal tester kan hjälpa till med diagnosen. Guldstandarden för denna diagnos är gastroesofageal scintigrafi. Det är icke-invasivt, testar fysiologi och ger kvantitativa resultat. Gastropares kan diagnostiseras om det finns minst 35 % retention av en standardmåltid med låg fetthalt fyra timmar efter förtäring.80
För att ge de mest exakta testresultaten bör förtestprotokollet innefatta att avbryta alla motilitetsförändrande mediciner under minst två till tre dagar före testet, inklusive prokinetika, opiater och antikolinergika. Inkretinmedel, t.ex. GLP-1-agonister och DPP-4-hämmare, bör också avbrytas, eftersom de är kända för att fördröja magsäckstömningen. Hyperglykemi har också visat sig fördröja gastrisk tömning, och glukosen bör vara under 275 mg/dL innan studien påbörjas.79,88
Patienterna bör avstå från att röka och dricka alkohol på testdagen, eftersom båda kan fördröja den gastroesofageala tömningen.89 Dessutom kan GLP-1RAs förvärra gastropares eftersom de fördröjer gastrisk tömning. Vidare kan vissa personer ha subklinisk gastropares som avslöjas när en GLP-1RA påbörjas.
Behandling. Behandlingen av gastropares beror till stor del på symtomens svårighetsgrad. De allmänna behandlingsprinciperna omfattar stödjande behandling (vätska, elektrolyter, glukoskontroll och nutrition), medicinsk behandling (prokinetika, antiemetika och smärtlindring) och invasiva behandlingar (kirurgi, Botox-injektioner, gastricing eller elektrisk stimulering).79
Supportiv behandling inleds vanligen på sjukhus och är inriktad på normalisering av vätske-, elektrolyt- och nutritionsstörningar. Vid näringsstöd är enteral matning att föredra framför parenteral matning, eftersom det är mer fysiologiskt och kan bidra till att upprätthålla tarmfloran. Vidare kan kostförändringar vara till stor hjälp vid gastropares. Kost med låg fiberhalt, låg fetthalt och låg residuhalt rekommenderas för patienter med gastropares.85 Kost med hög fiberhalt kan öka symtomen eftersom den kräver mer matsmältning.
Läkemedel. Prokinetika: I USA är metoklopramid och erytromycin de vanligaste läkemedlen för att behandla gastropares. Metoklopramid har dock en black box-varning på grund av risken för tardiv dyskinesi. Utvecklingen av detta tillstånd är direkt relaterad till hur länge metoklopramid används och hur många doser som tas. När man använder detta läkemedel är det bäst att använda det endast hos symtomatiska patienter och börja med den lägsta effektiva dosen 15 minuter före måltid. Läkemedelssemester kan ibland bidra till att förlänga effekten.90
Domperidon är en mer selektiv dopaminagonist som är lika effektiv som metoklopramid men har färre biverkningar från centrala nervsystemet.91
Antiemetika: Antiemetika kan användas för att hjälpa till med symtomen. Risken för läkemedelsinteraktioner är dock betydande och bör övervakas noggrant.
Painhantering kan vara en utmaning hos patienter med gastropares. Tricykliska antidepressiva läkemedel används ofta som förstahandsbehandling för smärta vid gastropares. Andrahandsmetoder är den svaga mu-opioidreceptoragonisten tramadol, som också frigör serotonin och hämmar återupptaget av noradrenalin, och gamma-aminosmörsyraanalogen gabapentin. Det rekommenderas dock inte att använda narkotiska läkemedel vid gastropares, eftersom det kan bidra till förstoppning och förvärrade symtom.
Invasiva behandlingar: Botoxinjektioner används ofta vid behandling av gastropares, men deras användning har inte stöd i kliniska prövningar.92,93
Den gastriska elstimuleringsapparaten godkändes av FDA enligt ett undantag för humanitär utrustning år 2000.94 Den gastriska elstimuleringsapparaten ger högfrekvent, lågenergisk elstimulering av magsäcken. Den är till större hjälp vid diabetisk gastropares än vid idiopatisk gastropares. En metaanalys visade på betydande fördelar när det gäller patienternas symtom. Den exakta mekanismen för nyttan är fortfarande inte känd.95 Det har föreslagits att gastrisk elektrisk stimulering leder till förändringar i de centrala mekanismer som kontrollerar illamående och kräkningar, ökar den vagala funktionen och resulterar i minskad känslighet för distension.97 Patienter som reagerar bra reagerar vanligtvis snabbt. Detta har fått vissa att rekommendera ett försök med tillfällig elektrodplacering först innan långvarig implementering.
Kliniska pärlor
- Diabetisk gastropares är vanligare hos personer med långvarig diabetes och personer med andra mikrovaskulära komplikationer.
- Guldstandarddiagnosen för gastropares är gastroesofageal scintigrafi.
- Dieter med låg fiberhalt, låg fetthalt och låg residuhalt rekommenderas vid diabetisk gastropares.
- Farmakologiska och interventionella behandlingar har begränsade fördelar och betydande risker på lång sikt.
Diabetisk cheiroartropati
En av de mindre kända diabeteskomplikationerna är cheiroartropati. Detta tillstånd kännetecknas av begränsad rörlighet i lederna på grund av förtjockning av huden hos personer med långvarig diabetes. Det var sannolikt den första komplikation som identifierades från typ 1-diabetes. Prevalensen varierar kraftigt från 8-50 %.98
Cheiroartropati tros orsakas av glykosylering och tvärbindning av kollagen. Den kan påverka hud och senor och kan leda till begränsad ledrörlighet, oftast förlängning av fingrarna, stelhet och smärta. Det klassiska tecknet vid fysisk undersökning för diabetisk cheiropati är ”bönetecknet”. Vid detta tillstånd kan en person inte helt platta ut sina händer för att ”be” och lämnar en lucka mellan fingrarna i vänster och höger hand. Det finns bevis för att de som utvecklar cheiropati har tre gånger större risk för mikrovaskulära komplikationer.99
Diabetisk cheiropati är vanligtvis värre hos personer med långvarig eller dåligt kontrollerad glykemi. Lyckligtvis upplever många människor lindring av symtomen och förbättrad rörlighet när glukoskontrollen förbättras.100
Slutsats
Hantering av diabeteskomplikationer kräver ett multidisciplinärt team. Tidig screening av retinopati, nefropati och neuropati är viktigt med tanke på sjukdomens asymtomatiska karaktär. Kännetecknet för diabeteshantering för alla komplikationer fortsätter att vara glykemisk kontroll och blodtryckskontroll.
- American Diabetes Association. Kostnader för diabetes. Tillgänglig på: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Uppdaterad den 22 juni 2015. Tillgänglig 8 februari 2017.
- UK Prospective Diabetes Study Group. Intensiv blodglukoskontroll med sulfonylureas eller insulin jämfört med konventionell behandling och risk för komplikationer hos patienter med typ 2-diabetes. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropati: A position statement by the American Diabetes Association. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Globala uppskattningar av antalet personer som är blinda eller har nedsatt syn på grund av diabetisk retinopati: En metaanalys från 1990 till 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Fakta om diabetisk ögonsjukdom. Tillgänglig på: https://nei.nih.gov/health/diabetic/retinopathy. Uppdaterad september 2015. Tillgänglig 8 februari 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopati vid diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Kardiovaskulära riskfaktorer och komplikationer i samband med albuminuri och nedsatt njurfunktion vid insulinbehandlad diabetes. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. Effekten av intensiv behandling av diabetes på utveckling och progression av långtidskomplikationer vid insulinberoende diabetes mellitus. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group and the Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Persistent effects of intensive glycemic control on retinopathy in type 2 diabetes in the Action to Control Cardiovascular Risk in Diabetes (ACCORDORD) follow-on study. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effekter av medicinska behandlingar på retinopatiutveckling vid typ 2-diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. Effekterna av medicinsk behandling på utvecklingen av diabetisk retinopati hos personer med typ 2-diabetes: Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Effekten av graviditet på mikrovaskulära komplikationer i Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: Ett ställningstagande från American Diabetes Association. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Preliminär rapport om effekter av fotokoagulationsbehandling. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Fotokoagulering vid diabetiskt makulaödem: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab för diabetiskt makulaödem: Resultat från 2 randomiserade fas III-studier: RISE och RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetisk retinopati. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; publicerad online 17 mars 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Diabetes nephropathy. Medscape Tillgänglig på: http://emedicine.medscape.com/article/238946-overview. Uppdaterad 30 september 2016. Tillgänglig 12 februari 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetisk njursjukdom: En rapport från en ADA-konsensuskonferens. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensiv blodsockerkontroll och vaskulära resultat hos patienter med typ 2-diabetes. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glukoskontroll och vaskulära komplikationer hos veteraner med typ 2-diabetes. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effekten av intensiv behandling av hyperglykemi på mikrovaskulära resultat vid typ 2-diabetes: En analys av den randomiserade ACCORD-studien. Lancet 2010;376:419-430.
- National Kidney Foundation. KDOQI kliniska riktlinjer för diabetes och CKD: 2012 års uppdatering. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Samband mellan åtgärder för njursjukdom och dödlighet och njursjukdom i slutstadiet hos personer med och utan diabetes: En metaanalys. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Hantering av diabetes mellitus hos patienter med kronisk njursjukdom. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Att skilja diabetisk nefropati från andra fall av glomeruloskleros: En uppdatering. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Laboratoriebedömning av diabetisk njursjukdom. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. KDOQI kliniska riktlinjer för kronisk njursjukdom: Utvärdering, klassificering och stratifiering. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: En analys av kohorten Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin bromsar progressionen av njurfunktionsförsämring oberoende av glykemiska effekter. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Tillgänglig på: http://online.lexi.com. Tillgänglig 31 oktober 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Tillgänglig på: http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Kliniska och terapeutiska konsekvenser för typ 2-diabetes. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rater och prediktorer för avbrytande av ACE-hämmare efter förhöjt serumkreatinin: En retrospektiv kohortstudie. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effekt av kandesartan på mikroalbuminuri och albuminutsöndringshastighet vid diabetes: Tre randomiserade studier. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan för fördröjning eller förebyggande av mikroalbuminuri vid typ 2-diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacy and safety of dual blockade of the renin-angiotensin system: Metaanalys av randomiserade prövningar. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effekten av en minskning av urinsyra på njurutfall under losartanbehandling: En post-hoc-analys av minskningen av endpoints i icke-insulinberoende diabetes mellitus med Angiotensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotektiv effekt av angiotensinreceptorantagonisten irbesartan hos patienter med nefropati till följd av typ 2-diabetes. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Riktlinjer för diagnos och öppenvårdsbehandling av diabetisk perifer neuropati. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER-stress vid diabetisk perifer neuropati: Ett nytt terapeutiskt mål. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Proinflammatoriska mekanismer vid diabetisk neuropati: Fokus på kärnfaktorn kappa B-vägen. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vaskulära riskfaktorer och diabetisk neuropati. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Kardiovaskulär autonom neuropati (expirations- och inspirationsförhållande) vid typ 1-diabetes. Förekomst och prediktorer. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Riskfaktorer för kardiell autonom neuropati vid diabetes mellitus typ 1. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Effekten av intensiv diabetesbehandling på nervledning i Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. Effekten av intensiv diabetesbehandling på mätningar av det autonoma nervsystemets funktion i Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetisk neuropati: Mekanismer till behandling. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetisk neuropati: Cellulära mekanismer – ett terapeutiskt mål. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Protective effects of cyclooxygenase-2 gene inactivation against peripheral nerve dysfunction and intraepidermal nerve fibers loss in experimental diabetes. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetisk neuropati: Kliniska manifestationer och aktuella behandlingar. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical practice: Neuropatiska diabetiska fotsår. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetiska neuropatier: Ett uttalande från American Diabetes Association. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: En rapport från arbetsgruppen för intressegruppen för fotvård inom American Diabetes Association, med stöd av American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetiska neuropatier: Uppdatering av definitioner, diagnostiska kriterier, bedömning av svårighetsgrad och behandlingar. Diabetes Care 2010;33:2285-2293.
- Dyck PJ, Albers JW, Andersen H, et al. Diabetiska polyneuropatier: Uppdatering av forskningsdefinition, diagnostiska kriterier och uppskattning av svårighetsgrad. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Differential diagnosis of diabetic neuropathy: Differential diagnosis of diabetic neuropathy. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidensbaserad riktlinje: Behandling av smärtsam diabetisk neuropati. Rapport från American Academy of Neurology, American Association of Neuromuscular and Electrodiagnostic Medicine och American Academy of Physical Medicine and Rehabilitation. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetin och pregabalin: Högdosmonoterapi eller deras kombination? ”COMBO-DN-studien” – en multinationell, randomiserad, dubbelblind, parallellgruppsstudie hos patienter med diabetisk perifer neuropatisk smärta. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Akupunkturens roll vid behandling av diabetisk smärtsam neuropati (DPN): En pilot RCT. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Behandling av symptomatisk diabetisk polyneuropati med antioxidanten alfa-liponsyra: En metaanalys. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. De akuta effekterna av glykemisk kontroll på axonal excitabilitet i mänskliga diabetiska nerver. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Smärtsam diabetisk neuropati. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demografi, kliniska egenskaper, psykologiska och missbruksprofiler, behandling och långtidsuppföljning av patienter med gastropares. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiologi, mekanismer och behandling av diabetisk gastropares. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importance of abdominal pain as a symptom in gastroparesis: Relation till kliniska faktorer, sjukdomens svårighetsgrad, livskvalitet, magretention och läkemedelsanvändning. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk för gastropares hos personer med typ 1 och 2-diabetes i den allmänna befolkningen. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: En befolkningsbaserad undersökning av 15 000 vuxna. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Ej relaterade till försämring av gastrisk tömning orsakad av autonom neuropati. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Fysiologisk hyperglykemi fördröjer gastrisk tömning hos normala personer och patienter med insulinberoende diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Rökning fördröjer gastrisk tömning av fasta ämnen. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Översiktsartikel: Metoklopramid och tardiv dyskinesi. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Klinisk prövning: En randomiserad kontrollerad crossover-studie av intrapylorisk injektion av botulinumtoxin vid gastropares. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinumtoxin A för behandling av försenad gastrisk tömning. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. Högfrekvent elektrisk magstimulering för behandling av gastropares: En metaanalys. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Svår gastropares: Medicinsk behandling eller elektrisk stimulering av magsäcken. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mekanismer för symtomförbättring efter gastrisk elstimulering hos gastroparetiska patienter. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalens av muskuloskeletala störningar hos patienter med diabetes mellitus typ 2: En pilotstudie. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Begränsad ledrörlighet vid diabetes mellitus hos barn indikerar ökad risk för mikrovaskulära sjukdomar. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Upplösning av diabetisk cheiroartropati. Br Med J 1986;293:1537.