Vad är surhet?
Syrlighet är viktigt för livet på jorden. Syra bestämmer ofta egenskaperna, kvaliteten, absorberbarheten och lösligheten hos många ämnen. Det är på detta sätt som enzymer, som är ansvariga för nästan alla biologiska processer i organismer, fungerar, men bara med rätt syrahalt. En liten fluktuation i blodets surhetsgrad är dödlig.
Vad är pH?
PH (pondus Hydrogenii) anger en lösnings surhet eller alkalinitet. pH-värdet varierar vanligtvis mellan 0 och 14. En lösning med ett pH-värde mellan 0 och 7 är sur och en lösning mellan 7 och 14 är alkalisk. Vinäger och cola har ett pH-värde på mindre än 3. Soda och tvål har ett pH-värde som är högre än 8. Ett pH-värde på 7 anses vara neutralt. Rent vatten i rumstemperatur har ett pH-värde på 7. Kranvattens pH-värde är i allmänhet lite högre på grund av förekomsten av kalcium.
Många naturliga miljöer, t.ex. vår hud, växtsubstrat och näringsmedier, är svagt sura och har ett pH-värde på mellan 5 och 6,5. Om vi tittar på de saker som människor gillar ser vi att de i allmänhet är milt sura eller neutrala ämnen som vatten. Växter föredrar också milt sura ämnen. Ett pH-värde på omkring 5,5 förekommer så ofta i naturen att vissa växtexperter betraktar detta värde som ”neutralt”.
Varför är syra viktigt?
Syran har ett betydande inflytande på upptagbarheten och lösligheten av ett antal näringsämnen (se figur 1).
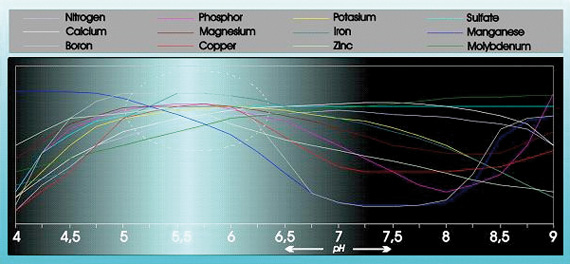
Figur 1
För övrigt har syran ett betydande inflytande på strukturen, nedbrytningen av organiska ämnen och på mikrolivet i marken. pH-värdet påverkar också hur näringsämnen, tungmetaller, bekämpningsmedel och andra mikroorganismer i odlingssubstratet sköljs ut ur marken.
Ett för lågt eller för högt pH-värde kan vara skadligt för dina växter, så det är viktigt att få det rätt. Men hur vet du när pH-värdet är fel? Genom erfarenhet! Så för att hjälpa dig har vi satt upp några av de symtom som du kan observera:
Symtom på ett för lågt pH (substratet är för surt)
- De flesta näringsämnen kan lätt lösas upp, vilket kan leda till ett överskott av mangan, aluminium och järn;
- Fosfor-, kalium-, magnesium- och molybdenbrist kan orsakas av överdriven sköljning;
- Magnesiumbrist, särskilt i kalla substrat;
- Den allmänna jordmånen är dålig;
- Jordbruket hämmas.
Symptom på ett för högt pH (substratet är för alkaliskt)
- De flesta näringsämnen löser sig sämre, vilket leder till att kalcium-, järn- och fosfatföreningar fälls ut;
- Förhindrat upptag av framför allt mangan, fosfat och järn, men även koppar, zink och bor. Detta leder till brister, särskilt i våta, kalla odlingssubstrat.
- I sandiga jordar ökar nedbrytningen av organiska ämnen avsevärt om pH är högt.
Vad bestämmer pH?
En av de viktigaste faktorerna som bestämmer pH-värdet i en lösning eller i substratet är buffertkapaciteten. Buffertkapaciteten innebär i detta fall att det finns ett slags balans närvarande som kontinuerligt återställer sig själv. Om man till exempel lägger en droppe syra i 1 liter kranvatten som har ett pH-värde på 7 kommer det att ha liten påverkan på syranivån. Om man däremot häller en droppe syra i en liter avmineraliserat vatten (batterivatten) kommer pH-värdet omedelbart att sjunka dramatiskt. Detta beror på att kranvatten innehåller bikarbonat medan avmineraliserat vatten inte gör det. Bikarbonat är det viktigaste buffrande ämnet för pH-värden mellan 5,5 och 7,5 i vatten.
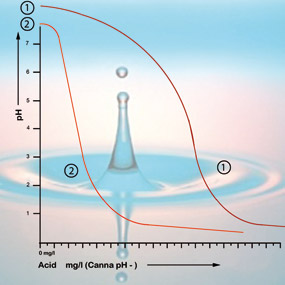 Bikarbonat binder sig till syran i lösningen, vilket släpper ut koldioxid i atmosfären. På så sätt neutraliseras syran och förändringarna i syrahalten blir bara små så länge det fortfarande finns bikarbonat närvarande.
Bikarbonat binder sig till syran i lösningen, vilket släpper ut koldioxid i atmosfären. På så sätt neutraliseras syran och förändringarna i syrahalten blir bara små så länge det fortfarande finns bikarbonat närvarande.
Med ett pH-värde på 5,3 har allt bikarbonat förbrukats och lösningen har inga fler buffertar. pH-värdet är nu instabilt och ändras omedelbart om syra tillsätts (se figur 2). Den mängd syra som behövs för att få en foderlösning till rätt syrahalt kan därför beräknas utifrån bikarbonathalten. Kranvattnets biokarbonathalt anges i allmänhet av vattenbolaget i milligram per liter.
Buffertkapaciteten och substratets syrahalt beror på dess sammansättning och färskhet. Förekomsten av organiskt material, kalcium och bikarbonat bestämmer i allmänhet pH-värdet. Lera innehåller alltid kalciumkarbonat och har ett relativt högt pH-värde som är svårt att förändra, medan torv- och sandjordar är sura.
Plantan i sig har också stor påverkan på surheten. Rötterna kommer att utsöndra antingen sura eller alkaliska sub- stanser beroende på grödans utvecklingsstadium, den tillgängliga födan, skillnaderna i rotarnas temperatur och ljusintensitet. Du förstår alltså varför pH-värdet i rotmiljön ständigt kan fluktuera. En sofistikerad foderbalans under de olika utvecklingsfaserna kommer att hålla pH-värdet i rotmiljön inom acceptabla gränser.
Mikroliv, CO2-nivåer och algtillväxt kan också påverka surhetsgraden i rotmiljön och näringstanken.
Mätning av pH-värdet

Det är ganska enkelt att mäta pH-värdet – du behöver några pH-indikatorer, som t.ex. lakritspapper eller ett pH-testset. Dessa är relativt billiga men är inte alltid exakta och kan ibland avvika med 1-2 pH-enheter. Alla pH-mätare är i allmänhet dyrare och noggrannheten beror på typ av mätare och regelbunden kalibrering med kalibreringsvätska.
Driva prover

PH-värdet i det vatten som används för att bevattna växter är viktigt, men syrahalten runt rötterna är avgörande. Så när du mäter pH är det mycket viktigt att ta provet på rätt sätt för att få bra resultat. Provet har ålders surhet i rotmiljön.
Det är lätt att ta prover och mäta pH i ett recirkulationssystem, det är bara att mäta den recirkulerade utfodringslösningen.
I substratssystem utan recirkulation sugs ut utfodringslösningen ur substratet (stenull, agrofoam etc.) på ett antal ställen. Experter har diskuterat frågan om var proverna ska tas i ett år och en dag. Vi rekommenderar, precis som ett antal välrenommerade laboratorier gör, att man tar prover från de ställen där rötterna finns vilket är under och runt dropp- pers. Ta små prover från så många ställen som möjligt. Ta alltid alla prover samtidigt och helst efter den andra droppmatningen under ljus – dagtid – cykeln.
 I jord-, kokos- och torvsubstrat tar du bara en liten mängd substrat från flera ställen.
I jord-, kokos- och torvsubstrat tar du bara en liten mängd substrat från flera ställen.
Du kan bäst mäta syrahalten i ditt prov genom att använda metoden ”1:1,5 volymextrakt”. Du kan enkelt göra detta själv genom att göra odlingssubstratet så vått att vattnet rinner genom fingrarna när det knådas och pressas ganska hårt (bild 1). Använd till exempel en 250 ml mätbägare. Fyll mätbägaren till 150 ml med avmineraliserat vatten. Tillsätt växtmedium tills volymen är 250 ml (bild 2). Skaka det väl och låt det stå i några timmar. Filtrera det sedan och mät pH-värdet.

De korrekta pH-värdena för varje medium
När man odlar i substrat är pH-värden på mellan 5,0 och 6,4 bra för rotmiljön. Det blir inga negativa effekter om värdena är lite högre eller lägre. Omedelbara negativa effekter kommer endast att ses med värden lägre än 4 och högre än 8. Ett pH-värde lägre än 4 orsakar ofta omedelbar skada på rötterna. Dessutom absorberas tungmetaller, inklusive mangan och järn, så väl att de kan förgifta växten (nekros). Värden mellan 7 och 8 är inte omedelbart skadliga för växten. Näringsämnen som järn, fosfat och mangan är mindre tillgängliga då, vilket leder till brister (kloros och utvecklingsproblem) på lång sikt.
Korrigera pH-värdet
 Om surheten i rotmiljön ligger mellan 5 och 6,4 är pH-värdet i din odlingsmiljö okej och du behöver inte vidta några korrigerande åtgärder. Försök att undvika att korrigera pH-värdet om det inte verkligen är nödvändigt. Det är mer sannolikt att det gör skada än nytta; växten gillar sitt lugn och sin ro. Det är viktigare att övervaka hur syrahalten förändras under en längre period. Om värdet sjunker under pH 5 eller stiger över pH 6,4 är det lämpligt att gradvis börja göra justeringar.
Om surheten i rotmiljön ligger mellan 5 och 6,4 är pH-värdet i din odlingsmiljö okej och du behöver inte vidta några korrigerande åtgärder. Försök att undvika att korrigera pH-värdet om det inte verkligen är nödvändigt. Det är mer sannolikt att det gör skada än nytta; växten gillar sitt lugn och sin ro. Det är viktigare att övervaka hur syrahalten förändras under en längre period. Om värdet sjunker under pH 5 eller stiger över pH 6,4 är det lämpligt att gradvis börja göra justeringar.
Korrigering av surhetsgraden sker lättast genom att sänka surhetsgraden i utfodringslösningen med salpetersyra under tillväxtfasen och fosforsyra under blomningsfasen eller, i förekommande fall, höja den med kaustisk kaliumkalium, kaliumbikarbonat av soda och CANNA RHIZOTONIC. Se till att pH-värdet i den lösning som används inte sjunker alltför mycket under 5,0. Vid odling i stenull kommer fibrerna att skadas vilket gör att mycket alkaliskt material frigörs vid mycket låga pH-värden. Dessutom är pH-värdet svårare att kontrollera på grund av avsaknaden av bikarbonat
Ett högt pH i rotmiljön kan också orsakas av bikarbonat som har byggts upp. För att avhjälpa detta kan man bibehålla 20 % dränering eller skölja igenom med en surare lösning.
Det är bra att notera pH-mätningarna från både den tillsatta lösningen och matningslösningen i substratet. Du får då en god uppfattning om pH-utvecklingen och effekten av de vidtagna åtgärderna.
- Proteinspalande enzymer behöver en sur miljö (magsaften) och kolhydratspalande enzymer behöver en alkalisk miljö (saliv).
- En lösnings surhet bestäms av förhållandet mellan vätejoner (= syra) och hydroxidjoner (= alkalisk).
- Skador kan uppstå eftersom växten måste utsöndra protoner för att kunna ta upp dessa molekyler. Ett växtmedium med lågt pH har redan en mycket stor mängd protoner. Dessa element sköljs också ut eftersom protonerna stöter bort molekylerna från mediet i substratet.
- Bikarbonat är det ämne som i kombination med kalcium orsakar kalkavlagringar. I kombination med natrium används bikarbonat i läkemedel för att motverka överskott av magsyra (Alka-seltzer).
- Vissa laboratorier arbetar också med bikarbonathårdhet. För att översätta detta till mg/l bikarbonat måste man multiplicera bikarbonathårdheten med 21,8.
Till exempel: bikarbonathårdheten är 11, då innehåller 1 liter vatten (11 x 21.8=) 240 mg/liter bikarbonat. -
Sandig mark: Gräsmark pH 4,6 … 5,2 Byggnadsmark pH 5,0 … 5.6 Lera: Merlera pH 6,0 … 7,2 Flodlera pH 6,2 … 6,4 Torv: Obearbetad pH 4.0 - Om det sker en betydande algtillväxt kommer pH-värdet att öka eftersom koldioxid avlägsnas från lösningen. Bakterier kan omvandla vissa former av kväve så att de har en försurande effekt. Stora mängder koldioxid i luften genererar mer koldioxid i utfodringslösningen och vice versa.
- Använd endast soda i små mängder, eftersom den innehåller natrium, och växter behöver bara en mycket liten mängd natrium. Kom ihåg att höga koncentrationer av natrium skadar växten.
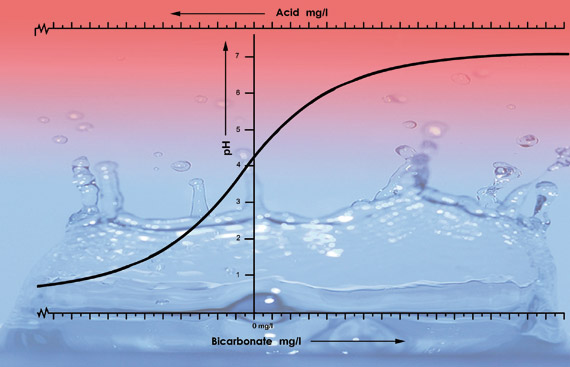
Illustration av pH-värdena i kranvatten från olika områden med olika nivåer av bikarbonat. Vi tillsatte 33 ml salpetersyra (38 %) till varje 100 liters prov av varje vattentyp. pH-kurvan sjunker snabbare efter pH 5,3 eftersom syran för denna typ av vatten neutraliserar all bikarbonat. Under pH 5,3 accelererar surhetsnivån snabbt.
I recirkulerande system kan pH-värdet fluktuera mer än i run-to-waste-system. Detsamma gäller för EC, ppm-värdet. Om du vill veta mer om EC, pH och ppm rekommenderar vi att du läser vår artikel Allt om EC, pH och ppm med AQUA.