Galvanische Zellen
Um die Grundprinzipien einer galvanischen Zelle zu veranschaulichen, betrachten wir die Reaktion von metallischem Zink mit Kupferionen (Cu2+) zu Kupfermetall und Zn2+-Ionen. Die ausgeglichene chemische Gleichung lautet wie folgt:
\
Wir können diese Reaktion auslösen, indem wir einen Zinkstab in eine wässrige Lösung von Kupfer(II)-sulfat einführen. Im Verlauf der Reaktion löst sich der Zinkstab auf, und es bildet sich eine Masse aus metallischem Kupfer. Diese Veränderungen treten spontan auf, aber die gesamte freigesetzte Energie liegt in Form von Wärme vor und nicht in einer Form, die zur Verrichtung von Arbeit genutzt werden kann.
Dieselbe Reaktion kann mit der in Abbildung \(\PageIndex{3a}\) dargestellten galvanischen Zelle durchgeführt werden. Zum Aufbau der Zelle wird ein Kupferstreifen in ein Becherglas mit einer 1 M Lösung von Cu2+-Ionen und ein Zinkstreifen in ein anderes Becherglas mit einer 1 M Lösung von Zn2+-Ionen eingesetzt. Die beiden Metallstreifen, die als Elektroden dienen, sind durch einen Draht verbunden, und die Kammern sind durch eine Salzbrücke verbunden, ein U-förmiges Rohr, das in beide Lösungen eingeführt wird und einen konzentrierten flüssigen oder gelierten Elektrolyten enthält. Die Ionen in der Salzbrücke werden so ausgewählt, dass sie die elektrochemische Reaktion nicht stören, indem sie selbst oxidiert oder reduziert werden oder einen Niederschlag oder Komplex bilden; üblicherweise verwendete Kationen und Anionen sind Na+ oder K+ bzw. NO3- oder SO42-. (Die Ionen in der Salzbrücke müssen nicht mit den Ionen des Redoxpaares in einem der beiden Kompartimente übereinstimmen). Wenn der Kreislauf geschlossen ist, kommt es zu einer spontanen Reaktion: Zinkmetall wird an der Zinkelektrode (der Anode) zu Zn2+-Ionen oxidiert, und Cu2+-Ionen werden an der Kupferelektrode (der Kathode) zu Cu-Metall reduziert. Im Verlauf der Reaktion löst sich der Zinkstreifen auf, und die Konzentration der Zn2+-Ionen in der Zn2+-Lösung nimmt zu; gleichzeitig gewinnt der Kupferstreifen an Masse, und die Konzentration der Cu2+-Ionen in der Cu2+-Lösung nimmt ab (Abbildung \(\PageIndex{3b}\)). Wir haben also dieselbe Reaktion wie mit einem einzigen Becherglas durchgeführt, aber dieses Mal sind die oxidative und die reduktive Halbreaktion räumlich voneinander getrennt. Die Elektronen, die an der Anode freigesetzt werden, fließen durch den Draht und erzeugen einen elektrischen Strom. Galvanische Zellen wandeln also chemische Energie in elektrische Energie um, die dann zur Verrichtung von Arbeit genutzt werden kann.
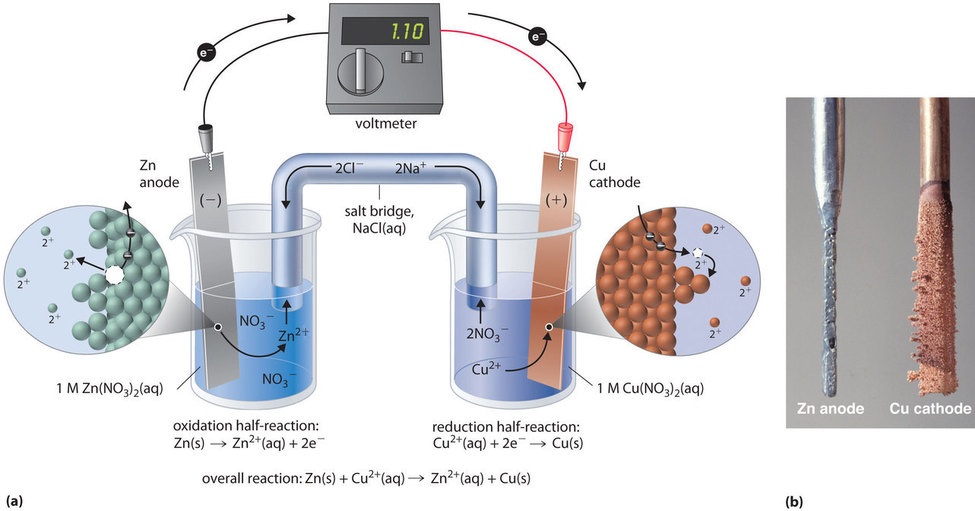
Der Elektrolyt in der Salzbrücke erfüllt zwei Aufgaben: Er schließt den Stromkreis, indem er die elektrische Ladung trägt, und hält die elektrische Neutralität in beiden Lösungen aufrecht, indem er die Ionen zwischen ihnen wandern lässt. Die Identität des Salzes in einer Salzbrücke ist unwichtig, solange die Ionen der Komponenten unter den Betriebsbedingungen der Zelle nicht reagieren oder eine Redoxreaktion eingehen. Ohne eine solche Verbindung würde die positive Gesamtladung in der Zn2+-Lösung zunehmen, wenn sich das Zinkmetall auflöst, und die positive Gesamtladung in der Cu2+-Lösung würde abnehmen. Die Salzbrücke ermöglicht die Neutralisierung der Ladungen durch einen Fluss von Anionen in die Zn2+-Lösung und einen Fluss von Kationen in die Cu2+-Lösung. Ohne eine Salzbrücke oder eine andere ähnliche Verbindung würde die Reaktion schnell abbrechen, da die elektrische Neutralität nicht aufrechterhalten werden könnte.
Mit einem Voltmeter kann der Unterschied im elektrischen Potenzial zwischen den beiden Kammern gemessen werden. Durch Öffnen des Schalters, der die Drähte mit der Anode und der Kathode verbindet, fließt kein Strom, so dass keine chemische Reaktion stattfindet. Ist der Schalter jedoch geschlossen, ist der externe Stromkreis geschlossen, und es kann ein elektrischer Strom von der Anode zur Kathode fließen. Das in Volt gemessene Potenzial (E_{Zelle}) der Zelle ist die Differenz des elektrischen Potenzials zwischen den beiden Halbreaktionen und steht im Zusammenhang mit der Energie, die benötigt wird, um ein geladenes Teilchen in einem elektrischen Feld zu bewegen. In der von uns beschriebenen Zelle zeigt das Voltmeter ein Potenzial von 1,10 V an (Abbildung \(\PageIndex{3a}\)). Da die Elektronen aus der Oxidationshalbwertszeit an der Anode freigesetzt werden, ist die Anode in einer galvanischen Zelle negativ geladen. Die Kathode, die Elektronen anzieht, ist positiv geladen.
Nicht alle Elektroden erfahren während einer Redoxreaktion eine chemische Umwandlung. Die Elektrode kann aus einem inerten, gut leitenden Metall wie Platin bestehen, um zu verhindern, dass sie während eines Redox-Prozesses reagiert, wo sie in der elektrochemischen Gesamtreaktion nicht auftritt. Dieses Phänomen wird in Beispiel \(\PageIndex{1}\) dargestellt.
Eine galvanische (voltaische) Zelle wandelt die durch eine spontane chemische Reaktion freigesetzte Energie in elektrische Energie um. Eine elektrolytische Zelle verbraucht elektrische Energie aus einer externen Quelle, um eine nicht spontane chemische Reaktion anzutreiben.
Beispiel \(\PageIndex{1}\)
Ein Chemiker hat eine galvanische Zelle konstruiert, die aus zwei Bechern besteht. Ein Becherglas enthält einen Zinnstreifen, der in wässrige Schwefelsäure getaucht ist, das andere eine Platinelektrode, die in wässrige Salpetersäure getaucht ist. Die beiden Lösungen sind durch eine Salzbrücke verbunden, und die Elektroden sind durch einen Draht miteinander verbunden. Der Strom beginnt zu fließen, und an der Platinelektrode bilden sich Gasblasen. Die spontan ablaufende Redoxreaktion wird durch die folgende ausgeglichene chemische Gleichung beschrieben:
\
Schreiben Sie für diese galvanische Zelle,
- die an jeder Elektrode ablaufende Halbreaktion auf.
- Bestimmen Sie, welche Elektrode die Kathode und welche die Anode ist.
- Bestimmen Sie, welche Elektrode die positive und welche die negative Elektrode ist.
Gegeben: galvanische Zelle und Redoxreaktion
Gefragt: Halbreaktionen, Identität von Anode und Kathode und Elektrodenzuordnung als positiv oder negativ
Strategie:
- Bestimmen Sie die Oxidationshalbreaktion und die Reduktionshalbreaktion. Identifiziere dann die Anode und die Kathode aus der Halbreaktion, die an jeder Elektrode auftritt.
- Bestimme anhand der Richtung des Elektronenflusses jede Elektrode als positiv oder negativ.
Lösung
A Bei der Reduktionshalbreaktion wird Nitrat zu Stickstoffoxid reduziert. (Das Stickoxid würde dann mit Luftsauerstoff zu NO2 mit seiner charakteristischen rotbraunen Farbe reagieren.) Bei der Oxidationshalbreaktion wird metallisches Zinn oxidiert. Die Halbreaktionen, die den tatsächlichen Reaktionen im System entsprechen, sind wie folgt:
Reduktion: \
Oxidation: \
Das Nitrat wird also zu NO reduziert, während die Zinn-Elektrode zu Sn2+ oxidiert wird.
Da die Reduktionsreaktion an der Pt-Elektrode stattfindet, ist sie die Kathode. Umgekehrt findet die Oxidationsreaktion an der Zinn-Elektrode statt, so dass sie die Anode ist.
B Elektronen fließen von der Zinn-Elektrode durch den Draht zur Platin-Elektrode, wo sie auf Nitrat übergehen. Der Stromkreis wird durch die Salzbrücke geschlossen, die die Diffusion von Kationen zur Kathode und von Anionen zur Anode ermöglicht. Da die Elektronen von der Zinn-Elektrode abfließen, muss diese elektrisch negativ sein. Im Gegensatz dazu fließen Elektronen in Richtung der Pt-Elektrode, so dass diese Elektrode elektrisch positiv sein muss.
Übung \(\PageIndex{1}\)
Betrachten Sie eine einfache galvanische Zelle, die aus zwei Bechern besteht, die durch eine Salzbrücke verbunden sind. Ein Becherglas enthält eine Lösung von \(\ce{MnO_4^{-}}\) in verdünnter Schwefelsäure und hat eine Pt-Elektrode. Das andere Becherglas enthält eine Lösung von \(\ce{Sn^{2+}}) in verdünnter Schwefelsäure, ebenfalls mit einer Pt-Elektrode. Wenn die beiden Elektroden durch einen Draht verbunden sind, fließt Strom und es kommt zu einer spontanen Reaktion, die durch die folgende ausgeglichene chemische Gleichung beschrieben wird:
\
Schreiben Sie für diese galvanische Zelle,
- die an jeder Elektrode auftretende Halbreaktion.
- Bestimme, welche Elektrode die Kathode und welche die Anode ist.
- Bestimme, welche Elektrode positiv und welche negativ ist.
Antwort a
\ce{Sn^{2+}(aq)} &→ \ce{Sn^{4+}(aq) + 2e^{-}} \end{align*}\]
Antwort b
Die Pt-Elektrode in der Permanganatlösung ist die Kathode, die in der Zinnlösung ist die Anode.
Antwort c
Die Kathode (Elektrode im Becherglas mit der Permanganatlösung) ist positiv, die Anode (Elektrode im Becherglas mit der Zinnlösung) ist negativ.