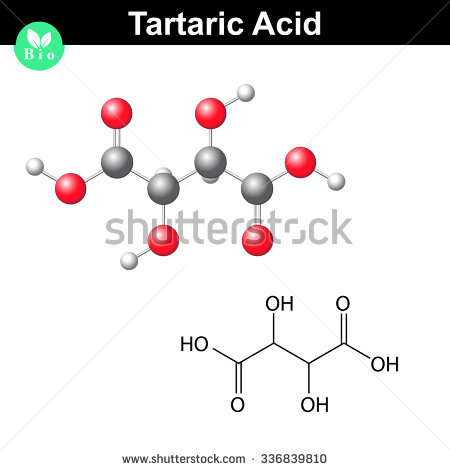
Ich vermute, dass du die Summenformel der Weinsäure bereits kennst und dass du die Summenformel mit Hilfe der molaren Masse finden musst.
Angenommen, der Ausgangspunkt ist die empirische Formel der Weinsäure, dann sieht sie so aus:
#“C“_2 „H“_3 „O“_3 -># empirische Formel
Die empirische Formel einer Verbindung gibt das kleinste ganzzahlige Verhältnis an, das zwischen den Atomen ihrer Bestandteile besteht.
In diesem Fall weißt du, dass die Molekülformel, die dir die genaue Anzahl der Atome sagt, aus denen ein Molekül der besagten Verbindung besteht,
#color(black)(„2 Atome von C“ color(red)(“ für jedes „) {(„3 Atome von H“),(„3 Atome von O“) :}#
Im Wesentlichen suchst du nach einem Vielfachen der empirischen Formel.
Die Weinsäure soll eine molare Masse von #“150 g mol“^(-1)# haben. Ihr Ziel ist es, die molare Masse der Summenformel zu bestimmen und dann mit diesem Wert die Summenformel der Verbindung zu ermitteln.
In diesem Fall haben Sie
#2 xx „12.011 g mol“^(-1) “ „color(blue)(+)#
#3 xx „1.00794 g mol“^(-1)#
#3 xx „15.9994 g mol“^(-1)#
#color(white)(aaaaaaaaaaaaaaaaaa)/color(white)(aaaaaaaaaaaaaaaaa)#
#“75.044 g mol“^(-1) -> #die molare Masse der Summenformel
Wenn also die Summenformel eine molare Masse von #“75.044 g mol“^(-1)#, und die molare Masse der Weinsäure ist #“150 g mol“^(-1)#, so folgt daraus, dass man die empirische Formel mit
#(150 color(red)(cancel(color(black)(„g mol“^(-1)))))/(75.044color(red)(cancel(color(black)(„g mol“^(-1))))) = 1.999 ~~ color(red)(2)#
um die Summenformel zu erhalten. Das bedeutet, dass die Summenformel der Weinsäure
#(„C“_2 „H“_3 „O“_3)_color(red)(2) lautet, was bedeutet color(green)(|bar(ul(color(white)(a/a) „C“_4 „H“_6 „O“_6color(white)(a/a)|)))#
So sieht ein Molekül der Weinsäure aus