Einführung
Das Tethered-Cord-Syndrom (TCS) ist eine neurologische Entwicklungsstörung, die durch einen abnormal niedrigen Conus medullaris verursacht wird. Es tritt typischerweise in der Kindheit auf, kann aber auch bis ins Erwachsenenalter unentdeckt bleiben und mit einem intraduralen Lipom einhergehen. Bei Patienten mit gleichzeitig bestehenden Anomalien (z. B. Myelomeningozele) und deutlichen klinischen Symptomen (z. B. fortschreitende Beinschwäche, Harninkontinenz) kann eine chirurgische Behandlung erforderlich sein. Ziel der Operation ist es, das Rückenmark zu entbinden, um die Dehnung des Rückenmarks zu lindern. Die Indikationen für eine Operation sind jedoch nach wie vor umstritten (1).
Im Gegensatz dazu ist die spinal-durale arteriovenöse Fistel (SDAVF) eine erworbene Erkrankung. Sie ist die häufigste Gefäßfehlbildung an der Wirbelsäule bei Erwachsenen. Sie entsteht im Foramen neurale durch eine abnorme, direkte Verbindung zwischen der Arteria duralis (die die Duralwurzelhülse und die angrenzende Dura spinalis versorgt) und der Vena medullaris (die den koronalen Venenplexus entwässert) (2, 3).
Sie kann mit Rückenschmerzen und fortschreitenden neurologischen Defiziten einhergehen. Eine SDAVF erfordert in der Regel entweder eine chirurgische oder endovaskuläre Behandlung.
Das Zusammentreffen von TCS, Lipom (oder Lipomyelomeningozele) und einer SDAVF auf Sakralniveau ist sehr selten. In dieser Mitteilung berichten wir über zwei solche Patienten. (4-6).
Fallmaterial
Fall 1
Eine 30-jährige Frau stellte sich mit einer 10-jährigen Anamnese von Schmerzen in der lumbosakralen Wirbelsäule vor; sie hatte gelegentlich Bestrahlungen in beiden unteren Gliedmaßen. Nach ihrer ersten Entbindung entwickelte sie Rückenschmerzen. Die MRT zeigte ein Tethered Cord auf der Höhe von L4 und ein Filum terminale Lipom. Die MRT zeigte auch gewundene Venen auf der Oberfläche des Rückenmarks (Abbildung 1C). Neun Jahre später, während der zweiten Schwangerschaft, stellte sie Schwäche und Sensibilitätsverlust, Gleichgewichtsstörungen mit Harn- und Stuhlinkontinenz fest. Bei der Aufnahme wies sie eine beidseitige Plantarflexionsschwäche (Grad 4 nach dem modifizierten System des Medical Research Council) und ein vermindertes Gefühl in den Gesäßregionen und den Beinen sowie eine Plantarreaktion auf. Die Babinski- und Rossolimo-Zeichen waren beidseitig vorhanden. Eine erneute MRT-Untersuchung ergab intraspinale T2-Hyperintensitätsveränderungen in der Brustwirbelsäule und im Konus (Abbildungen 1A, B, D). Diese Veränderungen standen im Einklang mit einem neurologischen Defizit und wurden nach Ausschluss entzündlicher demyelinisierender Erkrankungen auf der Grundlage eines MRT des Gehirns und eines Aquaporin-4-Antikörpertests als Myelopathie diagnostiziert. Aufgrund der beschriebenen geschlängelten Venen auf der Rückenmarksoberfläche (Abbildung 1B) unterzog sich der Patient einer digitalen Subtraktionsangiographie (DSA) der Wirbelsäule. Die DSA reichte von der Th6-Ebene bis zur Arteria coccygea. Die Ergebnisse zeigten keine vaskuläre Fehlbildung. Daher lautete die vorläufige Diagnose symptomatisches TCS und filum terminale lipoma. Angesichts der Schwäche und des neurologischen Defizits wurde eine chirurgische Rückenmarksentfernung ohne Lipomresektion geplant.
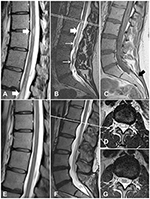
Abbildung 1. MR-Bilder des Rückenmarks von Fall 1, vor und nach der Behandlung. (A) Myelopathische Veränderungen im thorakalen Rückenmark (weiße Pfeile) (B) Myelopathische Veränderungen im Conus medullaris (dicker Pfeil) und verdickte torturale Gefäße (dünne Pfeile). (C) Die T1WI-Sequenz zeigt ein Lipom des Filum terminale (schwarzer Pfeil). (D) Ein Querschnitt auf der Ebene L1/L2 zeigt myelopathische Veränderungen. (E-G) Nachuntersuchungen zeigen, dass sich die myelopathischen Veränderungen zurückgebildet haben und die verdickten Venen verschwunden sind.
Der Sakralkanal wurde durch einen medianen Schnitt eröffnet. Die Dura war dünn und durchsichtig. Nach einem Dura- und Arachnoidalschnitt in der Mittellinie wurde ein Tumor sichtbar, der ein Lipom zu sein schien. Er umschloss das Filum terminale und die Spinalnervenwurzeln kaudal bis zur Höhe von S2. Die Nervenwurzeln S1 und S2 befanden sich seitlich des Tumors. Am Filum terminale wurde auch ein verdicktes, gewundenes, hellrotes Gefäß festgestellt, das in kranialer Richtung verlief. Auf der Suche nach einem SDAVF wurde die äußere Oberfläche der Dura beidseitig auf Höhe des Kreuzbeins erkundet. Ein deutlich sichtbarer Nidus wurde auf der Ebene S3 auf der linken Seite identifiziert. Zur Untermauerung dieses Befundes wurde ein empirischer Test durchgeführt. Ein Clip wurde für einige Minuten intradural an der arterialisierten Vene platziert. Daraufhin verfärbte sich das Gefäß am Filum terminale deutlich von hellrot in bläulich-grau, und seine Spannung nahm ab. Die SDAVF wurde dann intradural abgeklemmt, und der Nidus wurde extradural koaguliert. Außerdem wurde das Filum terminale durchtrennt, und es wurden Proben des Lipoms für die Histologie entnommen. Die Dura wurde wasserdicht vernäht, und die Wunde wurde schichtweise verschlossen.
Der postoperative Verlauf war ereignislos. Einige Tage später konnte der Patient entlassen werden. Eine Nachfolge-MRT zeigte eine Rückbildung der myelopathischen Veränderungen (Abbildungen 1E-G). Bei der Nachuntersuchung nach 1 Jahr hatte sich der Zustand des Patienten erheblich verbessert, ohne Inkontinenz oder motorische Defizite.
Fall 2
Ein 33-jähriger Mann stellte sich mit einer 2-jährigen Anamnese von Schmerzen in der lumbosakralen Wirbelsäule mit fortschreitender Schwäche der unteren Gliedmaßen, Häufigkeit des Wasserlassens und Inkontinenz vor. Die Symptome verstärkten sich nach körperlicher Anstrengung und längerem Stehen. Die MRT der Lendenwirbelsäule zeigte ein Tethered Cord auf der Höhe von L3, ein Lipom des Filum terminale und ein Ödem im Rückenmark. Außerdem zeigten sich gewundene Venen auf der hinteren Oberfläche des Rückenmarks (Abbildungen 2A und D).
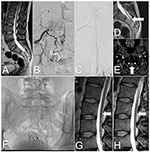
Abbildung 2. Bilder des Rückenmarks von Fall 2, vor und nach der Behandlung. (A) T2-gewichtete MRT: Tethered Cord und sakrales Lipom. (B) DSA: SDAVF auf der Ebene S2-S3, die von den lateralen Sakralarterien versorgt wird. (C) DSA: Gewundene Venen auf der hinteren Oberfläche des zervikalen Rückenmarks. (D) T2-gewichtetes MRT: Gewundene Vene an der hinteren Oberfläche des gefesselten Rückenmarks (Pfeil). (E) TOF-MRT: Drainagevene (Pfeil) auf der Höhe des atlanto-okzipitalen Übergangs. (F) Röntgenbild des Sakralbereichs zeigt Emboliemittel nach drei Embolisationen. (G) Lumbales T2-gewichtetes MRT: Nach der letzten Embolisation sind gewundene Gefäße an der hinteren Oberfläche des Rückenmarks sichtbar (Pfeil). (H) Nachfolge-MRT: 6 Monate nach der Operation sind die gewundenen Gefäße an der hinteren Oberfläche des Rückenmarks nicht mehr zu sehen (Pfeil).
Die neurologische Untersuchung ergab eine beidseitige Hüftgelenksbeugeschwäche (Grad 4 nach dem modifizierten System des Medical Research Council), eine Plantarflexionsschwäche (Grad 3 nach dem modifizierten System des Medical Research Council) und eine verminderte Empfindung in den Dermatomen S2-S3. Die Babinski- und Rossolimo-Zeichen waren beidseitig vorhanden. Aufgrund der klinischen und radiologischen Anzeichen wurde ein SDAVF vermutet. Eine DSA bestätigte die SDAVF auf der Ebene S2-S3, in der Dura, die von den lateralen Sakralarterien und Ästen der Arteria iliaca interna versorgt wird. Verschlungene ableitende Venen waren auf der hinteren Oberfläche des gesamten Rückenmarks vorhanden und endeten intrakraniell (Abbildungen 2B,C,E).
Der Patient wurde dreimal endovaskulär embolisiert, jeweils mit einem anderen Mittel. Zunächst wurde eine Embolisation mit Onyx™ 18 durchgeführt, das über zwei Mikrokatheter verabreicht wurde. Diese Behandlung führte zu einem Verschluss der Fistel. Die Patientin verbesserte sich deutlich, aber aufgrund der schlechten Penetration der ableitenden Vene rekanalisierte die Fistel nach einigen Wochen wieder und die Symptome kehrten zurück.
Eine zweite Embolisation wurde 4 Monate später durchgeführt. Der Gefäßzugang zur Fistel war komplizierter. Eine 25%ige Phil™-Injektion war nur über die kleinen sakralen Äste der linken inneren Beckenarterie möglich. Dieses Verfahren führte zu einer deutlichen Verringerung des Flusses durch die Fistel. Achtzehn Monate später wurde versucht, die Fistel mit verdünntem Klebstoff zu embolisieren. Trotz des guten Verschlusses der Fistel in der DSA blieben die gewundenen Gefäße in der Nachfolge-MRT sichtbar (Abbildungen 2F und G). Die Symptome blieben bestehen, und der Patient wurde für eine chirurgische Behandlung qualifiziert.
Das Ziel der Operation war der Verschluss der ableitenden Vene und des arteriellen Zuflusses sowie die Verkleinerung des Lipoms. Mit einem medianen Schnitt wurde der Sakralkanal auf der rechten Seite eröffnet. Die Dura war dick, und es gab mehrere mit Emboliemitteln gefüllte Gefäße. Ein großes, hellrotes Gefäß befand sich extradural und eines intradural auf der Ebene S2-S3. An die arterialisierte Vene wurde intradural für einige Minuten ein Clip gesetzt. Danach änderte das Gefäß seine Farbe und die Spannung nahm ab. Sowohl die intra- als auch die extraduralen Gefäße wurden koaguliert. Anschließend wurde das Lipom sichtbar gemacht und teilweise entfernt. Die Dura wurde wasserdicht vernäht, und die Wunde wurde schichtweise verschlossen.
Der postoperative Verlauf war ereignislos, und einige Tage später wurde der Patient entlassen. Nach 6 Monaten zeigte eine Nachfolge-MRT das Fehlen gewundener Gefäße an der hinteren Oberfläche des Rückenmarks und einen deutlichen Rückgang der myelopathischen Veränderungen (Abbildung 2H). Bei der Nachuntersuchung ging es der Patientin deutlich besser, sie hatte keine Inkontinenz, eine gewisse Häufigkeit des Wasserlassens und eine leichte Schwäche (Grad 4 nach dem modifizierten System des Medical Research Council).
Diskussion
Das gleichzeitige Auftreten von TCS, einem intraduralen Lipom und einem SDAVF auf Sakralniveau ist zwar außergewöhnlich, sollte aber angesichts der steigenden Zahl der gemeldeten Fälle nicht vergessen werden. In dieser Studie wurden der fünfte und sechste Fall dieser Art mit einem FKS und einem SDAVF auf Sakralniveau beschrieben (Tabelle 1). Kürzlich wurde einer dieser Fälle von Horiuchi et al. aufgeführt, und zwei weitere wurden von Talenti et al. hinzugefügt (6, 8).

Tabelle 1. Literaturübersicht über das Zusammentreffen von sakraler duraler arteriovenöser Fistel (DAVF), Tethered Cord Syndrom (TCS) und Filum terminale Lipom/Lipomyelomeningozele.
Die Ursache für dieses dreifache Zusammentreffen ist rätselhaft. Einerseits wird angenommen, dass die SDAVF eine erworbene Entität ist, im Gegensatz zu primären Wirbelsäulenanomalien. Dieses Merkmal legt nahe, dass die Koexistenz dieser Pathologien zufällig sein könnte. Andererseits haben sowohl Lipome als auch Angiome einen mesenchymalen Ursprung. Frühere Berichte über kombinierte intramedulläre AVM und Lipome lassen vermuten, dass ein Zusammenhang zwischen diesen Ätiologien bestehen könnte (9, 10). Soweit uns bekannt ist, gibt es jedoch keine früheren Studien, in denen die Koexistenz von dysraphischen Anomalien und einer SDAVF auf Sakralniveau, die im Kindesalter auftrat, beschrieben wurde. Auch eine Suche in der Medline-Datenbank ergab keinen Bericht über eine angeborene SDAVF. In mehreren Berichten wurde jedoch eine SDAVF beschrieben, die entweder auf eine Operation oder ein Trauma zurückzuführen ist (11-15). Daher könnte theoretisch eine frühere Operation einer Myelomeningozele die Bildung eines SDAVF auslösen.
Vorangegangene Studien haben berichtet, dass eine venöse Sinusthrombose mit einer damit verbundenen intravenösen Hypertonie und einer venösen Abflussbehinderung die Bildung von Shunts auslösen könnte (16-18). Eine alternative Erklärung für die Koexistenz der in unseren Fällen festgestellten Störungen könnte daher darin bestehen, dass ein Lipom einen Druck verursachte, der den venösen Abfluss behinderte und somit die Bildung eines SDAVF förderte. Dieser alternative Mechanismus hätte nichts mit einem Trauma oder einer Operation in der Vorgeschichte zu tun.
Erworbene SDAVFs sind typischerweise in der thorakolumbalen Region lokalisiert, und das Durchschnittsalter bei der Präsentation liegt bei etwa 60 Jahren (19). Sakrale SDAVFs sind selten, und das mittlere Alter bei der Präsentation von SDAVFs, die gleichzeitig mit einem TCS auftreten, liegt bei 41 Jahren (Tabelle 1). Daher ist es auch möglich, dass eine angeborene Anomalie, wie z. B. ein intradurales Lipom, die Entstehung einer SDAVF in einem jüngeren Alter begünstigen könnte. Kürzlich beschrieben Horiuchi et al. zwei Fälle und überprüften neun zuvor veröffentlichte Fälle von SDAVFs und AVMs, die mit spinalen Lipomen unterschiedlicher Art und auf verschiedenen Ebenen der Wirbelsäule koexistierten (8). Sowohl Djindjian et al. als auch Horiuchi et al. postulierten, dass der wahrscheinlichste Mechanismus, der einer verzögerten SDAVF-Bildung zugrunde liegt, die Freisetzung angiogener Faktoren durch Adipozyten sein könnte; diese Faktoren können die Angiogenese beeinflussen (20) und zu einer lokalen Hypervaskularisierung führen (5, 8). Darüber hinaus schlossen Jellema et al. prothrombotische Faktoren in der Pathogenese von SDAVFs aus (21).
Das symptomatische Zusammentreffen von TCS, sakralem Lipom und SDAVF wirft die Frage auf: Was genau ist die Ursache der Symptome? Talenti et al. beschrieben kürzlich diagnostische und therapeutische Schwierigkeiten bei zwei ähnlichen Fällen (6). Bei diesen beiden Patienten führten eine anfängliche Entfesselung des Rückenmarks und die Entfernung des Lipoms/der Lipomyelomeningozele weder zu einer Verbesserung noch zu einer Verschlechterung. Nach einer Wirbelsäulenangiographie befassten sie sich als nächstes mit der Pathologie der Wirbelsäulengefäße. Der natürliche Verlauf des Filum-terminale-Lipoms ist gutartig; nur 5 % der Patienten weisen TCS-Symptome auf (22). Somit war das Lipom die am wenigsten wahrscheinliche Ursache für neurologische Beeinträchtigungen. Dennoch können TCS und SDAVF bis zu einem gewissen Grad ähnliche Symptome verursachen. Ein TCS wird bei Kindern häufiger symptomatisch als bei Erwachsenen (23). Im Gegensatz dazu entwickeln sich Beeinträchtigungen im Zusammenhang mit SDAVFs bei älteren und mittelalten Menschen. Darüber hinaus verursachen sakrale SDAVFs Hyperintensitäten im Rückenmark, die in T2-gewichteten MRTs sichtbar sind und in der Regel nach erfolgreicher Behandlung wieder verschwinden (24). Ausgehend vom Durchschnittsalter der Patienten, bei denen TCS, sakrales Lipom und SDAVF gleichzeitig auftraten (siehe Tabelle 1), und aufgrund des guten postoperativen Ergebnisses, d. h. der in den MRTs nachgewiesenen Rückbildung der intramedullären Veränderungen, ist das SDAVF daher die wahrscheinlichste Ursache der neurologischen Verschlechterung. Darüber hinaus können sich die SDAVF-Symptome im Gegensatz zu TCS bei körperlicher Anstrengung und bei steigendem intraabdominalen Druck verschlimmern, wie in den beiden in der vorliegenden Studie beschriebenen Fällen.
Bei Patienten mit dieser dreifachen Koinzidenz war die SDAVF immer die direkte Ursache für die zunehmenden Symptome. Daher sollte das Hauptziel der Behandlung der Verschluss sein. In der Literatur scheint die endovaskuläre Embolisation ebenso wirksam zu sein wie die Operation, und die Embolisation war in ähnlichen Fällen die einzige Behandlung (24). Leider war die Embolisation in unseren Fällen entweder nicht durchführbar oder unwirksam. Bei der Operation konnten sowohl die SDAVF als auch die TCS in einem Eingriff untersucht und behandelt werden.
In unserem ersten Fall bestand das ursprüngliche Ziel der Operation darin, das Rückenmark zu lösen, da die SDAVF in einer präoperativen DSA nicht bestätigt wurde. Es stellt sich jedoch die Frage, warum die SDAVF auf der DSA nicht zu erkennen war. Oldfield et al. beschrieben drei Fälle von SDAVFs, die in einer DSA nicht entdeckt wurden, bei denen jedoch aufgrund anderer bildgebender Verfahren ein starker Verdacht bestand. Diese SDAVFs wurden während der Operation erfolgreich abgeklemmt (25). Zu den Faktoren, die die Erkennung von DSAs in der Wirbelsäule erschwerten, gehörten Fettleibigkeit, ein Aortenaneurysma, Aorten-Atherosklerose mit Tortuosität sowie eine Mündungsobstruktion oder Tortuosität der Lendenarterien. In unserem Fall könnte eine mögliche Erklärung für die falsch-negativen DSA-Ergebnisse darin liegen, dass die DSA nicht gründlich genug war; so haben wir den sakralen Zufluss nicht untersucht.
Die beiden hier beschriebenen Fälle zeigen, dass sakrale SDAVFs in DSAs schwer zu erkennen und mit endovaskulärer Embolisation schwer zu verschließen sein können. Frühere Studien, die in Tabelle 1 aufgeführt sind, beschrieben ebenfalls erfolglose Embolisationen bei der Behandlung von SDAVFs (4, 6, 8). Insgesamt gab es 5 erfolglose Versuche der endovaskulären Okklusion in 3 von 6 berichteten Fällen (Tabelle 1). Daher kamen wir zu dem Schluss, dass ein chirurgischer Ansatz der endovaskulären Embolisation überlegen sein könnte, da die Operation eine einstufige Behandlung bietet.
Abschließende Bemerkungen
Das gleichzeitige Auftreten von TCS, Lipom und SDAVF auf Sakralniveau ist außergewöhnlich selten. Frühere Berichte und unsere Ergebnisse zeigen, dass die Chirurgie der endovaskulären Embolisation bei der Behandlung von sakralen SDAVFs mit koexistierenden Entitäten überlegen sein könnte, da die Chirurgie eine einstufige Behandlung bietet. Eine wachsende Zahl von Berichten deutet darauf hin, dass die Symptome dieser dreifachen Störung allein durch das SDAVF und nicht durch das TCS oder das Lipom verursacht werden können, die in der Neurobildgebung deutlich sichtbar sind.
Einverständnis
Für die Veröffentlichung dieses Fallberichts wurde eine schriftliche Einverständniserklärung der Teilnehmer eingeholt.
Beiträge der Autoren
PK hat das Projekt entworfen und kritisch überprüft. ŁP erstellte das Manuskript, sammelte und überprüfte Daten. PJ, MZ und MG sammelten Falldaten. BC überprüfte die Anatomie. AM gab die endgültige Genehmigung für die zu veröffentlichende Version.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
1. Drake JM. Chirurgisches Management des gefesselten Rückenmarks – eine Gratwanderung. Neurosurg Focus. (2007) 23:E4. doi: 10.3171/FOC-07/08/E4
PubMed Abstract | CrossRef Full Text
2. McCutcheon IE, Doppman JL, Oldfield EH. Mikrovaskuläre Anatomie duraler arteriovenöser Anomalien der Wirbelsäule: eine mikroangiographische Studie. J Neurosurg. (1996) 84:215-20. doi: 10.3171/jns.1996.84.2.0215
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Gailloud P. Spinal dural arteriovenous fistula (SDAVF) variant with dual perimedullary and epidural drainage. Eur Spine J. (2017). 27(Suppl 3):375-9. doi: 10.1007/s00586-017-5298-x
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Krisht KM, Karsy M, Ray WZ, Dailey AT. Extraspinale durale arteriovenöse Fistel vom Typ I mit einer lumbosakralen Lipomyelomeningozele: ein Fallbericht und Überblick über die Literatur. Case Rep Neurol Med. (2015) 2015:526321. doi: 10.1155/2015/526321
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Djindjian M, Ayache P, Brugieres P, Poirier J. Sakrales Lipom des Filum terminale mit duraler arteriovenöser Fistel. Fallbericht. J Neurosurg. (1989) 71(5 Pt 1):768-71. doi: 10.3171/jns.1989.71.5.0768
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Talenti G, Vitale G, Cester G, Della Puppa A, Faggin R, Causin F. Rare association between spinal dural arteriovenous fistulas and dysraphisms: report of two cases and review of the literature with a focus on pitfalls in diagnosis and treatment. Intervent Neuroradiol. (2017) 23:458-64. doi: 10.1177/1591019917714636
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Przepiórka Ł, Kunert P, Juszynńska P, Zawadzki M, Ciszek B, Głowacki M, et al. Coincidence of tethered cord, filum terminale lipoma, and sacral dural arteriovenous fistula: report of two cases and a literature review. Front Neurol. (2018) 9:807. doi: 10.3389/fneur.2018.00807
CrossRef Full Text | Google Scholar
8. Horiuchi Y, Iwanami A, Akiyama T, Hikata T, Watanabe K, Yagi M, et al. Spinal arteriovenous fistula coexisting within a spinal lipoma: report of two cases. Spinal Cord Series Cases (2017) 3:17079. doi: 10.1038/s41394-017-0011-1
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Weon YC, Chung JI, Roh HG, Eoh W, Byun HS. Kombinierte spifnale intramedulläre arteriovenöse Malformation und Lipomyelomeningozele. Neuroradiology (2005) 47:774-9. doi: 10.1007/s00234-005-1336-1
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Rice JF, Jelsma RK. Kombinierte arteriovenöse Malformation und intramedulläres Lipom: Operation und Embolotherapie. Am J Neuroradiol. (1986) 7:171-3.
PubMed Abstract | Google Scholar
11. Asakuno K, Kim P, Kawamoto T, Ogino M. Dural arteriovenöse Fistel und progressives Conus medullaris Syndrom als Komplikationen einer lumbalen Diskektomie. Fallbericht. J Neurosurg. (2002) 97(3 Suppl):375-9. doi: 10.3171/spi.2002.97.3.0375
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kang JW, Koo JH, Kim DK, Joo YJ, Kim TH, Song SH. Myelopathie durch spinal-durale arterio-venöse Fistel nach erster Lendenwirbelkörperfraktur – ein Fallbericht. Ann Rehabil Med. (2011) 35:729-32. doi: 10.5535/arm.2011.35.5.729
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Vankan Y, Demaerel P, Heye S, Van Calenbergh F, van Loon J, Maleux G, et al. Dural arteriovenöse Fistel als Spätkomplikation einer Fraktur der oberen Halswirbelsäule. Fallbericht. J Neurosurg. (2004) 100(4 Suppl Spine):382-4. doi: 10.3171/spi.2004.100.4.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Nishimura Y, Natsume A, Ginsberg HJ. Spinale durale arteriovenöse Fistel assoziiert mit L-4 isthmischer Spondylolisthesis. J Neurosurg Spine (2014) 20:670-4. doi: 10.3171/2014.3.SPINE13492
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Khaldi A, Hacein-Bey L, Origitano TC. Spinale epidurale arteriovenöse Fistel mit spät einsetzender perimedullärer venöser Hypertonie nach lumbaler Operation: Fallbericht und Diskussion der Pathophysiologie. Spine (2009) 34:E775-9. doi: 10.1097/BRS.0b013e3181ae4a52
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jablawi F, Nikoubashman O, Mull M. Arterielle Hypertonie ist mit symptomatischen spinalen duralen arteriovenösen Fisteln verbunden. World Neurosurg. (2017) 103:360-3. doi: 10.1016/j.wneu.2017.04.050
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Borden JA, Wu JK, Shucart WA. Eine vorgeschlagene Klassifizierung für spinale und kraniale dural arteriovenöse fistulöse Malformationen und Auswirkungen auf die Behandlung. J Neurosurg. (1995) 82:166-79. doi: 10.3171/jns.1995.82.2.0166
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lawton MT, Jacobowitz R, Spetzler RF. Neu definierte Rolle der Angiogenese in der Pathogenese duraler arteriovenöser Malformationen. J Neurosurg. (1997) 87:267-74. doi: 10.3171/jns.1997.87.2.0267
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Wojciechowski J, Kunert P, Nowak A, Dziedzic T, Czernicki T, Wojtowicz K, et al. Surgical treatment for spinal dural arteriovenous fistulas: Ergebnis, Komplikationen und prognostische Faktoren. Neurol Neurochir Pol. (2017). 51:446-53. doi: 10.1016/j.pjnns.2017.07.001
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lucarelli E, Sangiorgi L, Benassi S, Donati D, Gobbi GA, Picci P, et al. Angiogenesis in lipoma: Eine experimentelle Studie an der Chorioallantoismembran des Hühnerembryos. Int J Mol Med. (1999) 4:593-6. doi: 10.3892/ijmm.4.6.593
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jellema K, Tijssen CC, Fijnheer R, de Groot PG, Koudstaal PJ, van Gijn J. Spinal dural arteriovenous fistulas are not associated with prothrombotic factors. Stroke (2004) 35:2069-71. doi: 10.1161/01.STR.0000135766.22285.dc
CrossRef Full Text | Google Scholar
22. Cools MJ, Al-Holou WN, Stetler WR Jr, Wilson TJ, Muraszko KM, Ibrahim M, et al. Filum terminale lipomas: imaging prevalence, natural history, and conus position. J Neurosurg Pediatr. (2014) 13:559-67. doi: 10.3171/2014.2.PEDS13528
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Al-Holou WN, Muraszko KM, Garton HJ, Buchman SR, Maher CO. Das Ergebnis von Tethered Cord Release bei sekundärem und mehrfach wiederholtem Tethered Cord Syndrom. J Neurosurg Pediatr. (2009) 4:28-36. doi: 10.3171/2009.2.PEDS08339
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gioppo A, Farago G, Giannitto C, Caputi L, Saladino A, Acerbi F, et al. Sacral dural arteriovenous fistulas: a diagnostic and therapeutic challenge – single-centre experience of 13 cases and review of the literature. J Neurointerv Surg. (2017). 10:415-21. doi: 10.1136/neurintsurg-2017-013307
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Oldfield EH, Bennett A 3. Chen MY, Doppman JL. Erfolgreiches Management von spinalen duralen arteriovenösen Fisteln, die durch Arteriographie nicht entdeckt wurden. Bericht über drei Fälle. J Neurosurg. (2002) 96(2 Suppl):220-9. doi: 10.3171/spi.2002.96.2.0220
PubMed Abstract | CrossRef Full Text | Google Scholar