Auf der Tagung der American Academy of Ophthalmology 2013 nahm ich an einer Debatte über die Vor- und Nachteile der Verwendung von Generika gegenüber Markenmedikamenten teil. Ich wurde gebeten, zugunsten von Markenmedikamenten zu argumentieren, aber wie bei den meisten Debatten ist es eine grobe Vereinfachung, sich blind auf die eine oder andere Seite zu schlagen. Die Realität ist viel komplizierter. Bei Generika sprechen die Kosten für sie, aber sie bieten manchmal nicht die gleichen Behandlungsspezifikationen oder Ergebnisse wie Markenmedikamente, trotz der Bemühungen der Food and Drug Administration, dies zu gewährleisten.
Im Folgenden möchte ich auf einige Aspekte eingehen, in denen sich Generika von den Markenarzneimitteln, die sie ersetzen, unterscheiden können und worauf Kliniker achten müssen.
Das Problem der Bioäquivalenz
Die Hürden, die für die Markteinführung eines neuen, „innovativen“ Medikaments erforderlich sind, unterscheiden sich erheblich von denen für ein generisches Nachfolgeprodukt. Das ist natürlich auch der Grund, warum ein Markenmedikament mehr kostet. Während das neuartige Medikament seine Sicherheit und Wirksamkeit in klinischen Studien nachweisen muss, ist für ein Generikum nur der Nachweis der Bioäquivalenz erforderlich.
Bioäquivalenz klingt zwar so, als ob man biologische Studien durchführen müsste, aber die FDA definiert es so, dass man nachweisen muss, dass die Inhaltsstoffe des Generikums eine exakte Kopie der Inhaltsstoffe des Originalmedikaments sind, einschließlich der Wirkstoffe und Hilfsstoffe. (Wenn die Wirk- und Hilfsstoffe nicht identisch sind, wird das Medikament nicht als Generikum betrachtet; es muss wie jedes andere neue Medikament die reguläre FDA-Zulassung durchlaufen). Man geht davon aus, dass das Generikum dadurch die gleiche Sicherheit und Wirksamkeit wie das Markenmedikament aufweist.
Leider ist die Vorstellung, dass Generika mit Markenmedikamenten gleichwertig sind, weil die Inhaltsstoffe identisch sind, nicht unbedingt richtig. Viele Faktoren, die die Wirksamkeit eines topischen Medikaments beeinflussen, sind unabhängig von den Inhaltsstoffen in der Flasche. Zum Beispiel:
– Das Material der Flasche spielt eine Rolle. Die Inhaltsstoffe vieler Markenmedikamente sind auf das Material der Flasche abgestimmt, die verwendet wird. Dies war sicherlich bei Latanoprost der Fall, wo die Kompatibilität mit dem Flaschenmaterial ein wichtiger Teil des Forschungs- und Entwicklungsprozesses war, als Xalatan auf den Markt gebracht wurde. Dies wird von der FDA nicht direkt untersucht.
– Form und Größe der Flasche beeinflussen die Verwendung. Bei den Versuchen mit innovativen Arzneimitteln wird nicht nur das Medikament getestet, sondern auch die Flasche, in der es an die Patienten abgegeben wird, so dass die Auswirkungen von Form und Größe der Flasche berücksichtigt wurden. Die Hersteller von Generika sind jedoch nicht verpflichtet, die Flaschenform und -größe zu kopieren, und dies kann sich darauf auswirken, wie leicht die Patienten das Medikament verwenden können.
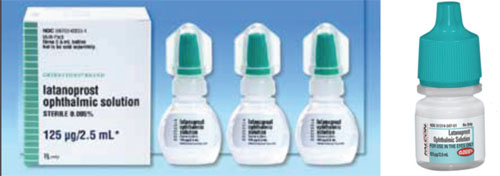
Ein Problem, das bei der Umstellung von einem Markenarzneimittel auf ein Generikum oder von einem Generikum auf ein anderes zu Verwirrung führen kann, sind die Unterschiede in Form und Farbe des Verschlusses.
Xalatan beispielsweise wird in einer flachen, kleinen Flasche geliefert, die nur mit viel Mühe und Geschick zusammengedrückt werden kann, um einen Tropfen einzufüllen. Im Gegensatz dazu sind einige der Generikaflaschen mit Latanoprost rund und steifer, so dass der Patient die Flasche schwerer zusammendrücken kann. (Siehe Beispiele auf der gegenüberliegenden Seite.) Viele unserer Patienten sind älter und haben körperliche Einschränkungen. Wenn sie daran gewöhnt sind, eine bestimmte Flasche zu drücken, die flach und etwas weniger starr ist, und dann zu einer Flasche wechseln, die rund und starrer ist, kann sich der Anwendungsprozess – und die Einhaltung des Medikaments – anders gestalten als bei der vorherigen Flasche. Da Form und Größe der Flaschen von jedem Generikahersteller selbst bestimmt werden, kann es außerdem vorkommen, dass die Patienten das Medikament mal in einer flachen und mal in einer runden Flasche erhalten. Das hat bei unseren Patienten für viel Verwirrung gesorgt.
– Die Farbe des Deckels stimmt nicht immer überein. Die Farben der Flaschenverschlüsse von Augenarzneimitteln sollen je nach Arzneimittelkategorie aufeinander abgestimmt sein. Die FDA versucht sicherzustellen, dass die Farbe korrekt ist, aber es hat Fälle gegeben, in denen eine andersfarbige Kappe durchgerutscht ist. Infolgedessen unterscheiden sich die Verschlusskappen von Generika manchmal in Farbe (sowie Form und Größe) von denen der Markenmedikamente (siehe Beispiel oben). Dies führt zu großer Verwirrung, wenn Patienten versuchen, sich daran zu erinnern, welche von mehreren Tropfen sie zu welchem Zeitpunkt einnehmen sollen.
Selbst wenn ein Patient noch nie das Markenmedikament mit der korrekten Kappenfarbe verwendet hat, ist eine veränderte Farbe immer noch ein Problem; die neue Kappenfarbe könnte tatsächlich die gleiche Farbe wie ein anderes Medikament sein, das der Patient einnimmt. Prostaglandin-Analoga zum Beispiel sollten tealfarbene Kappen haben. Wenn Ihre Patientin ein Generikum verwendet, dessen Flasche eine weiße Kappe hat, könnte sie es mit anderen Medikamentenklassen verwechseln, die eine weiße Kappe haben sollen.
Wenn Sie ein Beispiel für eine falsche Kappenfarbe bemerken, möchte die FDA davon erfahren, damit Schritte unternommen werden können, um die Diskrepanz zu korrigieren.
– Die Tropfengröße kann unterschiedlich sein. Die derzeit auf dem Markt befindlichen topischen Tropfenflaschen bieten eine Dosis von 30 bis 50 µl pro Tropfen. Leider kann es große Unterschiede zwischen Markenprodukten und Generika geben, einfach weil die Spitze ein größeres oder kleineres Loch haben kann. Dies kann sich natürlich darauf auswirken, wie viel des Medikaments tatsächlich in das Auge gelangt; mal ist es weniger, mal mehr.
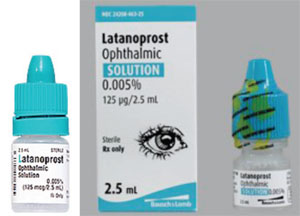
Ein weiteres Problem sind die Unterschiede in der Flaschenform und -steifigkeit, die die Anwendung der Tropfen für ältere Patienten erschweren können. Xalatan wird beispielsweise in einer flachen Flasche geliefert; viele Generika des Medikaments werden in runden Flaschen geliefert, die sich schwerer zusammendrücken lassen.
Noch interessanter ist, dass ein Generikum von Timolol auf den Markt kam, das überhaupt kein Loch in der Spitze hatte; der Patient musste die Spitze anstechen, um das Medikament herauszubekommen, ähnlich wie bei einer Tube Sekundenkleber. Das sorgte bei vielen Patienten für Verwirrung; einige wussten nicht, dass sie das tun sollten, und versuchten, die Tropfen trotzdem zu benutzen. Sie dachten, sie würden einen Tropfen auftragen, aber sie hatten die Flasche nie geöffnet, so dass nichts herauskam. Andere dachten, die Flasche sei defekt oder leer. Außerdem kann ein selbst gemachtes Loch jede beliebige Größe haben, was sich auf die Dosis auswirkt, und der Prozess der Herstellung des Lochs kann leicht die Sterilität des Inhalts beeinträchtigen.
All diese Überlegungen – Flaschenmaterial, Form und Größe, Farbe des Verschlusses und Durchmesser der Tropfenöffnung – sind sowohl für den Arzt als auch für den Patienten sehr wichtig. Leider werden diese Überlegungen oft übersehen, weil der Schwerpunkt auf dem Nachweis der Bioäquivalenz liegt.
– Das Generikum für einen Patienten kann von Monat zu Monat anders aussehen. Dies ist eine weitere unglückliche Nebenwirkung von Generika. Das liegt daran, dass es mehrere Hersteller eines bestimmten Generikums geben kann, von denen jeder eine andere Flasche hat. Beispielsweise gibt es auf dem US-amerikanischen Markt derzeit sechs bis acht verschiedene Hersteller von Latanoprost-Generika. Der Hersteller, den eine bestimmte Apotheke verkauft, kann sich ändern, da eine Kette wie CVS, Walgreens oder Walmart in der Regel den Hersteller wählt, der der Apothekengruppe zu einem bestimmten Zeitpunkt das beste Angebot macht. Infolgedessen kann eine Apotheke das von ihr angebotene Generikum wechseln, wenn ein niedrigeres Angebot eines anderen Generikaherstellers eingeht. Selbst wenn der Patient dieselbe Apotheke aufsucht, kann es also sein, dass er zu verschiedenen Zeitpunkten unterschiedliche Generika erhält. Das kann verwirrend sein, wenn die Flaschen unterschiedlich aussehen und/oder sich unterschiedlich verhalten. (Es könnte sogar ein Unterschied in der Verträglichkeit und der Kontrolle des Augeninnendrucks zwischen den beiden bestehen.)
Der Beipackzettel
Auch wenn sich herausstellt, dass ein Generikum ein Problem hat, hindern die geltenden Vorschriften die Hersteller daran, Ärzte oder Patienten zu warnen. Es gibt eine Vorschrift, nach der die Hersteller von Generika verpflichtet sind, eine exakte Kopie der Packungsbeilage beizulegen, die dem innovativen Medikament beiliegt. Diese Vorschrift sollte die Idee widerspiegeln, dass die Medikamente bioäquivalent sind, hatte aber den unbeabsichtigten Nebeneffekt, dass die Hersteller von Generika nicht die gleichen Sorgfaltspflichten und Sicherheitsanforderungen erfüllen müssen wie die Hersteller von Markenprodukten.
Wenn der Hersteller eines Generikums ein Medikament auf den Markt bringt und einige Nebenwirkungen oder unerwünschte Ereignisse feststellt, die bei dem Generikum auftreten, darf er die Packungsbeilage nicht ändern, um Ärzte und Patienten auf ein mögliches Problem hinzuweisen. Darüber hinaus könnte diese Regelung die Motivation der Generikahersteller verringern, ihre Produkte angemessen zu überwachen; schließlich droht keine Klage, wenn ein Problem auftritt.
Glücklicherweise ist die FDA auf dieses Problem aufmerksam geworden. Im November 2013 schlug die FDA eine Regelung vor, die es Herstellern von Generika erlauben würde, ihre Etiketten zu aktualisieren, wenn sie Informationen über mögliche Sicherheitsbedenken erhalten. Wenn diese Regelung verabschiedet wird, wird sie einen großen Beitrag zur Gewährleistung der Sicherheit unserer Patienten leisten.
Importierte Generika
Ein weiteres Problem bei Generika ist, dass viele von ihnen außerhalb der Vereinigten Staaten hergestellt werden, wo die Qualitätskontrolle manchmal ein echtes Problem darstellt. Die Probleme reichen von mysteriösen Verunreinigungen, die in den Medikamenten gefunden werden, über eine unzureichende Abstimmung der Inhaltsstoffe bis hin zu offenkundig betrügerischen Formulierungen, die keinerlei Nutzen bringen (was in einigen Fällen zu schwerwiegenden Schäden für die Patienten führen kann).
Die Realität ist, dass Generika nicht unbedingt mit den Markenmedikamenten identisch sind – selbst wenn sie die Anforderungen der FDA an die Bioäquivalenz erfüllt haben. Das bedeutet, dass bei der Verwendung von Generika die Last der Gewährleistung von Sicherheit und Wirksamkeit bei uns und unseren Patienten liegt.
Nach Angaben der New York Times liefert die indische Pharmaindustrie derzeit 40 Prozent der rezeptfreien Medikamente und Generika, die in den Vereinigten Staaten konsumiert werden. Viele der indischen Fabriken sind Weltklasse und „praktisch nicht von amerikanischen Produktionsstätten zu unterscheiden“ (so die Times) und produzieren hochwertige, zuverlässige Medikamente. Gleichzeitig schätzt die Weltgesundheitsorganisation, dass eines von fünf in Indien hergestellten Medikamenten gefälscht ist. (Ähnliche Probleme wurden auch bei Arzneimitteln gemeldet, die in anderen Ländern, einschließlich China, hergestellt werden.)
Unsere Gruppe hat vor ein paar Jahren eine Studie durchgeführt, in der in Indien hergestelltes Latanoprost mit Xalatan verglichen wurde. Wir stellten fest, dass die Stabilität der Wirkstoffe im Laufe der Zeit oder bei Hitzeeinwirkung nicht die gleiche war. Darüber hinaus fanden wir in allen importierten Flaschen Verunreinigungen, darunter mikroskopisch kleine Fäden, die wie Schnüre aussahen, und das, was wir „UFOs“ nannten.
Der Punkt ist, dass die Aufsicht über die Herstellungspraktiken, die in Übersee bei nicht in den Vereinigten Staaten ansässigen Unternehmen stattfinden, insbesondere bei Unternehmen, die keine Markenmedikamente auf dem Markt haben, einfach nicht dieselbe ist.
Einige Ärzte mögen annehmen, dass solche importierten Medikamente nur dann ein Problem darstellen, wenn Patienten Medikamente außerhalb der Vereinigten Staaten über das Internet kaufen, um Geld zu sparen, aber die Realität ist, dass diese Importe hier zunehmend erhältlich sind. Indische Formulierungen von Timolol und Travoprost sind derzeit über US-Händler erhältlich, und andere Medikamente wie NSAIDs werden bald verfügbar sein. Natürlich stellen viele Unternehmen außerhalb der Vereinigten Staaten qualitativ hochwertige Generika her; besorgniserregend ist jedoch, dass einige von ihnen dies nicht tun. Das bedeutet, dass Ärzte und Patienten sich vergewissern müssen, dass ein bestimmtes Generikum sicher und wirksam ist. (Zumindest die in den Vereinigten Staaten erhältlichen Medikamente haben den Bioäquivalenzprozess der FDA durchlaufen; die Medikamente, die manche Patienten außerhalb des Landes über das Internet kaufen, haben dies möglicherweise nicht getan, was sie noch suspekter macht.)
Klinische Strategien
Aufgrund all der Variablen, die wir besprochen haben, sollten Ärzte genau darauf achten, was mit den Patienten geschieht, wenn sie von einem Markenmedikament zu einem Generikum oder von einem Generikum zu einem anderen wechseln. Wir müssen wachsam sein, um sicherzustellen, dass die Kontrolle des Augeninnendrucks nicht ins Wanken gerät und dass die Patienten keine neuen Anzeichen und Symptome einer Unverträglichkeit des Medikaments zeigen.
Hier sind einige Dinge, die Sie tun können, um Ihre Patienten (und Ihre Praxis) zu schützen:
– Bitten Sie die Patienten, ihre Tropfen mitzubringen. Ich bitte meine Patienten, dies unabhängig von den Medikamenten zu tun, die sie einnehmen, und viele von ihnen tun es. Das gibt mir die Möglichkeit, zu notieren, welchen Generikahersteller sie verwenden, und ich tue mein Bestes, um dies im Auge zu behalten, so dass ich, wenn ein Problem auftritt oder sich etwas ändert, nach einem möglichen Zusammenhang suchen kann.
– Lassen Sie Patienten, die auf ein neues Generikum umgestellt werden, früher in die Praxis kommen, als Sie es sonst tun würden. So können Sie sicherstellen, dass keine unerwünschten Folgen eintreten. Achten Sie auf Veränderungen in der Wirksamkeit oder auf neue Anzeichen oder Symptome.
– Wenn Sie feststellen, dass bei der Umstellung eines Patienten auf ein Generikum Probleme auftreten, alarmieren Sie die FDA. Denken Sie daran, dass in dieser Situation der Arzt dafür sorgen muss, dass das Generikum wirklich sicher und wirksam ist.
– Wenn ein Patient mit einem Generikum nicht so gut zurechtkommt, sollten Sie sich darum bemühen, dass die Krankenkasse die Kosten für das Markenpräparat übernimmt. Ich hatte schon mit Patienten zu tun, die das Markenmedikament gut vertragen haben, aber Schwierigkeiten hatten, ein Generikum zu vertragen, weil es Nebenwirkungen wie Rötungen oder Reizungen verursacht. In solchen Fällen schreiben wir an die Versicherungsgesellschaft und tun alles, was wir können, damit der Patient wieder auf das Markenpräparat umgestellt wird.
Ein Markenmedikament kann zum Beispiel ein bestimmtes Konservierungsmittel enthalten, während das Generikum ein anderes Konservierungsmittel enthält, auf das der Patient empfindlich reagiert. Travatan Z ist ein Markenmedikament von Alcon, das anstelle von Benzalkoniumchlorid das Konservierungsmittel SofZia enthält; die generischen Versionen enthalten BAK, weil ihre Bioäquivalenz auf der älteren Travoprost-Version basierte. Wenn eine Apotheke einen Patienten, der gegen BAK allergisch ist, auf das Generikum umstellt, wird dies zu einem Problem.
Da wir in unserer Praxis jährlich Tausende von Patienten behandeln, ist es leider sehr schwierig, sicherzustellen, dass wir den Kampf für jeden Patienten gewinnen, der in diese Situation gerät. Aber wir bemühen uns darum.
Die Last liegt bei uns
Generika sind auf dem Vormarsch, und sie werden zu einem wichtigen Bestandteil der Behandlung aller Krankheiten, nicht nur in der Augenheilkunde. Sie sind in der Regel sicher und wirksam, und sie können sowohl für die Patienten als auch für das Gesundheitssystem im Allgemeinen Kosteneinsparungen bringen. Machen Sie keinen Fehler – ich bin ein großer Fan von Kostensenkungen. Wenn wir einen sicheren Weg finden, die Kosten zu senken und gleichzeitig eine hervorragende Versorgung aufrechtzuerhalten, bin ich dafür. Es ist der zweite Teil dieser Gleichung, den wir im Auge behalten müssen.
Ich selbst verwende täglich Generika, und die überwältigende Mehrheit meiner Patienten nimmt jetzt Generika. Es geht ihnen fast allen sehr gut, sie haben eine gute Kontrolle des Augeninnendrucks und vertragen die Medikamente gut. Ich sage also nicht, dass wir auf Generika verzichten sollten. Die Realität sieht jedoch so aus, dass Generika nicht unbedingt mit den Markenmedikamenten identisch sind – selbst wenn sie die Anforderungen der FDA an die Bioäquivalenz erfüllt haben. Das bedeutet, dass bei der Verwendung von Generika die Last der Gewährleistung von Sicherheit und Wirksamkeit bei uns und unseren Patienten liegt. REVIEW
Dr. Kahook ist Inhaber des Slater-Familien-Stiftungslehrstuhls für Augenheilkunde und stellvertretender Vorsitzender für klinische und translationale Forschung an der University of Colorado School of Medicine in Denver. Er ist Berater für Allergan und Alcon und erhält Forschungsunterstützung von ihnen.