Diabetes mellitus ist teuer, aber der Großteil der Kosten entfällt auf Komplikationen und Krankenhausbehandlung.1 Nach Angaben der American Diabetes Association (ADA) beliefen sich die geschätzten Gesamtkosten für Diabetes im Jahr 2012 auf 245 Milliarden US-Dollar.1 Davon entfielen schätzungsweise 43 % auf stationäre Krankenhauskosten und weitere 18 % auf die Verschreibung von Medikamenten zur Behandlung von Diabeteskomplikationen.1
Die meisten dieser Komplikationen können durch eine gezielte Blutzuckereinstellung verhindert werden. Epidemiologische Daten zeigen, dass jeder Prozentpunkt, um den der Hämoglobin-A1c-Wert (HbA1c) sinkt, das Risiko für mikrovaskuläre Komplikationen um 35 % verringert.2 Die gute Nachricht ist, dass die Komplikationsraten bei Diabetes gesunken sind,3 aber dies wurde durch die schiere Zunahme der Zahl der Menschen mit Diabetes, die Komplikationen entwickeln, überholt.
Viele Menschen mit Typ-2-Diabetes können zum Zeitpunkt der Diagnose eine diabetesbedingte Komplikation haben. Sowohl bei Typ-1- als auch bei Typ-2-Diabetes sind einige der Komplikationen, wie Retinopathie und Nephropathie, stumm. Dies erfordert ein aggressives, zielgerichtetes Vorgehen, denn wenn man auf Symptome wartet, ist es zu spät. Selbst die diabetische Neuropathie ist bei bis zu 50 % der Menschen mit messbaren Anomalien asymptomatisch.4
Dieser Artikel gibt einen Überblick über die Empfehlungen der ADA 2017 Standards of Care für mikrovaskuläre Komplikationen und relevante Stellungnahmen und hebt präventive Vorsorgeuntersuchungen und klinische Perlen für den Hausarzt hervor, der Patienten mit Diabetes behandelt.
- Diabetische Retinopathie
- Tabelle 1. Retinopathie-Stadien mit Beschreibung
- Klinische Empfehlungen
- Diabetes Kidney Disease
- Tabelle 2. Ausgewählte wegweisende Studien, die eine glykämische Kontrolle mit einem HbA1c-Wert unter 7 % belegen
- Tabelle 3. Geschätzte GFR mit Stadium und Beschreibung
- Tabelle 4. Albuminurie-Kategorien bei CKD
- Abbildung 1. Empfohlene Häufigkeit der Bewertung (Anzahl der Male pro Jahr) nach eGFR- und Albuminurie-Kategorie
- Tabelle 5. Rote Flaggen, die auf eine nichtdiabetische glomeruläre Erkrankung hindeuten
- Tabelle 6. Dosisanpassungen und Empfehlungen für Glukosesenker bei Patienten mit Niereninsuffizienz
- Klasse
- Medikation
- Klinische Perlen
- Diabetische periphere Neuropathie
- Tabelle 7. Andere Ursachen der Neuropathie67
- Tabelle 8. Häufig verwendete pharmakologische Wirkstoffe für DPN4,69
- Klinische Perlen
- Gastroparese
- Klinische Perlen
- Diabetische Cheiroarthropathie
- Schlussfolgerung
Diabetische Retinopathie
Die diabetische Retinopathie ist eine häufige mikrovaskuläre Komplikation bei Typ-1- und Typ-2-Diabetes. Schätzungsweise 3,7 Millionen Menschen weltweit sind aufgrund einer diabetischen Retinopathie mäßig bis stark sehbehindert, und mehr als 800.000 Menschen weltweit sind aufgrund einer diabetischen Retinopathie erblindet.5 Sie ist die häufigste Ursache für eine neu auftretende Erblindung bei Erwachsenen zwischen 20 und 74 Jahren.6 Es wurden starke Zusammenhänge mit der Blutzuckereinstellung, der Blutdruckkontrolle und der Dauer der Erkrankung festgestellt. Durch frühzeitiges, regelmäßiges Screening und Kontrolle dieser Risikofaktoren kann die diabetische Retinopathie erkannt und behandelt werden, um eine Sehbehinderung zu verhindern.
Die Dauer des Diabetes ist der größte Risikofaktor für das Fortschreiten der diabetischen Retinopathie. Bei Typ-1-Diabetes ist eine Retinopathie in den ersten 3 bis 5 Jahren oder vor der Pubertät selten.7 In den folgenden 20 Jahren entwickeln fast alle Patienten mit Typ-1-Diabetes eine diabetische Retinopathie.7 Bei Patienten mit Typ-2-Diabetes haben bis zu 21 % zum Zeitpunkt der Diagnose einen gewissen Grad an Retinopathie.7 Chronische Hyperglykämie, Nephropathie, Bluthochdruck und Dyslipidämie sind weitere Faktoren, die das Risiko einer diabetischen Retinopathie erhöhen oder mit ihr assoziiert sind.8 Bis zu 50 % der Patienten mit Albuminurie (unabhängig vom geschätzten Wert der glomerulären Filtrationsrate) werden eine Retinopathie haben.9 Tabelle 1 beschreibt die verschiedenen Stadien der Retinopathie.
Tabelle 1. Retinopathie-Stadien mit Beschreibung |
|
|
Stadium |
Beschreibung |
|
Mild NichtProliferative diabetische Retinopathie |
Mikroaneurysmen vorhanden |
|
Moderate nicht-proliferative diabetische Retinopathie |
Mikroaneurysmen, Netzhautpunkt- oder Fleckenblutungen, harte Exsudate, oder Watteflecken können vorhanden sein |
|
Schwere nicht-proliferative diabetische Retinopathie |
Intraretinale Blutungen, venöse Perlen, oder intraretinale mikrovaskuläre Anomalien können vorhanden sein |
|
Proliferative diabetische Retinopathie |
Neovaskularisation, Glaskörper- oder präretinale Blutungen vorhanden |
Pathophysiologie. Milde, nicht-proliferative Anomalien, die durch eine erhöhte Gefäßpermeabilität gekennzeichnet sind, können zu einer mäßigen bis schweren nicht-proliferativen diabetischen Retinopathie (NPDR) fortschreiten.7 Die proliferative diabetische Retinopathie ist durch die Proliferation neuer retinaler Blutgefäße gekennzeichnet.7 Ein Makulaödem, d. h. eine zentrale Netzhautverdickung mit Exsudation und Ödem, kann in jedem Stadium der Retinopathie auftreten.7 Die diabetische Retinopathie kann durch Schwangerschaft, Pubertät, mangelnde glykämische Kontrolle, Bluthochdruck und Kataraktoperationen beschleunigt werden.7
Vorbeugung der diabetischen Retinopathie. Die Kontrolle des Blutzuckerspiegels ist der Schlüssel zur Prävention der diabetischen Retinopathie. In der Diabetes Control and Complications Trial (DCCT) untersuchten die Forscher die Auswirkungen einer strengen Blutzuckereinstellung und das Fortschreiten von keiner oder minimaler Retinopathie bei Studienbeginn zu einer moderaten NPDR.10 Bei Patienten in der Gruppe mit intensiver Therapie, die bei Studienbeginn keine Retinopathie aufwiesen, verringerte sich das durchschnittliche Risiko einer Retinopathie über 36 Monate um 76 %.10 Bei Patienten in der Intensivtherapiegruppe, die bereits eine minimale bis mäßige Netzhauterkrankung aufwiesen, war das Risiko eines Fortschreitens der Erkrankung um 54 % geringer als bei Patienten, die eine konventionelle Behandlung erhielten.10 In der ursprünglichen ACCORD-Studie (Action to Control Cardiovascular Risk in Diabetes) wurden Teilnehmer mit Typ-2-Diabetes seit 10 Jahren und bekannter kardiovaskulärer Erkrankung nach dem Zufallsprinzip einer Intensiv- oder Standardtherapie für Blutzucker, systolischen Blutdruck und Dyslipidämie zugeteilt. Vier Jahre später war das Fortschreiten der Retinopathie bei den Teilnehmern mit intensiver Blutzuckerkontrolle geringer, unabhängig von ähnlichen aktuellen HbA1c-Werten.11 Ähnliche Auswirkungen auf das Erbe wurden in den Gruppen mit intensiver Blutdruckkontrolle oder Fenofibrat gegen Dyslipidämie nicht beobachtet.11
Screening. Da Makulaödeme und proliferative diabetische Retinopathie asymptomatisch sein können, ist ein Screening für die Früherkennung und Behandlung von entscheidender Bedeutung. Bei Patienten mit Typ-1-Diabetes sollte das Screening fünf Jahre nach der Diagnose beginnen.8 Bei Patienten mit Typ-2-Diabetes sollte das Screening zum Zeitpunkt der Diagnose beginnen.8 Das Screening sollte von einem Augenarzt oder Optometristen durchgeführt werden, der Erfahrung mit diabetischer Retinopathie hat. Das Screening sollte mit geweiteten Augen durchgeführt werden. Liegt bereits eine Retinopathie vor, wird eine Überweisung an einen Augenarzt empfohlen.8 Eine Wiederholungsuntersuchung sollte jährlich durchgeführt werden, wenn nur eine minimale oder gar keine Erkrankung festgestellt wird.8
Schwangerschaft ist eine Zeit mit hohem Risiko für proliferative Retinopathie. Bei schwangeren Frauen mit vorbestehendem Typ-1- oder Typ-2-Diabetes sollten Augenuntersuchungen vor der Empfängnis oder im ersten Trimester durchgeführt werden. Die Untersuchungen sollten in jedem Trimester und ein Jahr lang nach der Entbindung wiederholt werden.8 Bei Patientinnen mit Schwangerschaftsdiabetes sind nach der Entbindung keine weiteren Augenuntersuchungen erforderlich.
Schwangerschaft kann bei Patientinnen mit vorbestehendem Typ-1- oder Typ-2-Diabetes zu einem schnellen Fortschreiten der diabetischen Retinopathie führen. Dies gilt insbesondere dann, wenn die Blutzuckereinstellung zum Zeitpunkt der Empfängnis schlecht ist.14 Frauen mit Diabetes, die schwanger sind oder eine Schwangerschaft planen, sollten über das Risiko der Entwicklung oder des Fortschreitens einer diabetischen Retinopathie und die Notwendigkeit einer Blutzuckereinstellung vor der Empfängnis aufgeklärt werden.8 Eine rasche Umsetzung einer intensiven glykämischen Behandlung kann jedoch zu einer frühzeitigen Verschlechterung der Retinopathie führen, wenn bereits eine Retinopathie vorhanden ist.8 Schwangerschaftsdiabetes scheint nicht das gleiche Risiko für die Entwicklung einer diabetischen Retinopathie während der Schwangerschaft zu bergen.8
Behandlung. Zusätzlich zur Blutzuckerkontrolle hat sich gezeigt, dass eine Blutdruckkontrolle (< 140 mmHg systolisch) das Fortschreiten der diabetischen Retinopathie verringert, aber es gibt keinen zusätzlichen Nutzen einer strengen Kontrolle des systolischen Blutdrucks < 120 mmHg.12 Fenofibrat kann ebenfalls das Fortschreiten der diabetischen Retinopathie verlangsamen, insbesondere bei sehr leichter NPDR, bei Patienten mit Dyslipidämie.13 Aspirin hat nachweislich keinen Einfluss auf das Fortschreiten der Retinopathie, die Entwicklung einer Glaskörperblutung oder die Dauer der Glaskörperblutung und kann sicher für andere medizinische Indikationen verwendet werden, ohne das Auge zu gefährden.7
Die Behandlung von Patienten mit Diabetes sollte Empfehlungen für körperliche Betätigung beinhalten. Patienten mit leichter nichtproliferativer Retinopathie können gefahrlos mit körperlicher Betätigung beginnen. Patienten mit mäßiger nichtproliferativer Retinopathie sollten jedoch Aktivitäten vermeiden, die den Blutdruck stark erhöhen, wie z. B. Kraftdreikampf.15 Patienten mit schwerer nichtproliferativer oder instabiler Retinopathie sollten jede starke körperliche Aktivität (Springen, Rütteln), alle Aktivitäten mit dem Kopf nach unten und das Anhalten des Atems vermeiden.15 Im Falle einer Glaskörperblutung sollte keine körperliche Betätigung erfolgen.15
Die frühzeitige Erkennung der diabetischen Retinopathie ist wichtig, da eine Behandlung den Verlust des Sehvermögens verhindern oder umkehren kann. In der Diabetic Retinopathy Study (DRS) fanden Forscher heraus, dass die Photokoagulation eine wirksame Behandlung der diabetischen Retinopathie ist. Die Studie zur frühzeitigen Behandlung der diabetischen Retinopathie und die DRS zeigten, dass die Photokoagulation das Risiko eines Sehkraftverlusts verringerte, wobei der größte Nutzen bei Patienten mit einer weiter fortgeschrittenen Grunderkrankung zu verzeichnen war.16,17 Aktuelle Daten belegen, dass intravitreale Wirkstoffe gegen den endothelialen Gefäßwachstumsfaktor (Anti-VEGF) bei der Behandlung des Makulaödems wirksamer sind als eine Monotherapie oder eine Kombinationstherapie mit der Laserkoagulation.8 Darüber hinaus kann Anti-VEGF die Sehkraft verbessern, während die Photokoagulation lediglich einen weiteren Sehkraftverlust verhindert.18,19 Ein Nachteil von Anti-VEGF ist, dass in den ersten 12 Monaten eine monatliche intravitreale Therapie erforderlich ist.
Klinische Empfehlungen
- Es gibt keine spezifischen Anzeichen oder Symptome für eine frühe diabetische Retinopathie.
- Eine Untersuchung auf diabetische Retinopathie sollte bei Patienten erfolgen:
– mit Typ-1-Diabetes fünf Jahre nach der Diagnose.
– bei Patienten mit Typ-2-Diabetes zum Zeitpunkt der Diagnose.
- Diabetische Frauen, die eine Schwangerschaft planen, sollten beraten und verstärkt untersucht werden, da die diabetische Retinopathie während der Schwangerschaft rasch zunehmen kann.
- Eine strenge Blutzuckereinstellung und Blutdruckkontrolle (< 140 mmHg systolisch) kann die Entwicklung einer diabetischen Retinopathie verhindern.
- Bis zu 50 % der Patienten mit Albuminurie (unabhängig vom eGFR-Wert) werden eine Retinopathie haben.9
- Die Behandlung mit Photokoagulation kann das Fortschreiten der Krankheit verhindern, und eine Anti-VEGF-Behandlung kann den Sehkraftverlust aufgrund eines Makulaödems rückgängig machen.
Diabetes Kidney Disease
Diabetes Kidney Disease (DKD), die von der ADA bevorzugte Terminologie, ist die Hauptursache für chronische Nierenerkrankungen (CKD) in den Vereinigten Staaten.20,21 DKD hat erhebliche langfristige Auswirkungen auf die Lebensqualität von Diabetespatienten und ist für bis zu 40 % der Nierenerkrankungen im Endstadium (ESRD) verantwortlich.20 Auf der Grundlage der Kidney Disease Outcomes Quality Initiative (KDOQI) der National Kidney Foundation und der ADA 2017 Standards of Care wird in diesem Abschnitt ein Leitfaden für HbA1c-Zielwerte, das Medikamentenmanagement und die therapeutische Behandlung von Patienten mit DKD vorgestellt.
Die KDOQI stratifiziert die HbA1c-Zielwerte nach dem Hypoglykämierisiko und den Begleiterkrankungen des Patienten. Diese Initiative stützt sich auf drei Veröffentlichungen, die zeigen, dass eine Blutzuckereinstellung mit einem HbA1c-Wert unter 7 % das Fortschreiten der Nierenerkrankung bei Patienten mit Typ-2-Diabetes verhindert oder verringert.22,23,24 Diese Studien sind in Tabelle 2 zusammengefasst. Die ADA empfiehlt, bei Patienten mit erhöhtem Hypoglykämierisiko den HbA1c-Wert auf über 7 % anzuheben.8 Die KDOQI empfiehlt Patienten mit CKD-Stadium 4 und 5, die eine begrenzte Lebenserwartung haben, einen HbA1c-Wert von über 7 % einzuhalten.25
Tabelle 2. Ausgewählte wegweisende Studien, die eine glykämische Kontrolle mit einem HbA1c-Wert unter 7 % belegen |
|
|
Studie |
Ergebnisse |
|
Wirkung bei Diabetes und Gefäßerkrankungen: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE) Trial22 |
21% Reduktion neuer Makroalbuminurie und Nierenersatztherapie mit A1c unter 7% |
|
Veterans Affairs Diabetes Trial (VADT)23 |
37% Reduktion der Makroalbuminurie und 32 % weniger Mikroalbuminurie bei einem A1c-Wert unter 7 % |
|
Die ACCORD-Studie (Action to Control Cardiovascular Risk in Diabetes)24 |
2% Reduktion der Makroalbuminurie und 21% Reduktion der Mikroalbuminurie bei einem A1c-Wert unter 7% |
Epidemiologie. Männer und Frauen sind gleichermaßen von der diabetischen Nephropathie betroffen.20 Die höchste Inzidenz für die Entwicklung einer diabetischen Nephropathie liegt 15 Jahre nach der Diagnose.21 Afroamerikaner haben ein drei- bis fünfmal höheres Risiko, eine diabetische Nephropathie zu entwickeln als Weiße.20 Mexikanische Amerikaner und Pima-Indianer haben ebenfalls ein höheres Risiko für die Entwicklung einer diabetischen Nephropathie.20
Proteinurie ist ein Prädiktor für kardiovaskuläre Morbidität und Gesamtmortalität bei Diabetes.21 Das Vorliegen einer diabetischen Nephropathie ist ein Faktor für ein erhöhtes Risiko für kardiovaskuläre Erkrankungen. Patienten mit DKD sind durchweg mit einer höheren Sterblichkeitsrate an Herz-Kreislauf-Erkrankungen konfrontiert.26 Darüber hinaus ist die Gesamtmortalität bei Patienten mit DKD höher.21
Bei Typ-1-Diabetes beginnen sich mikrovaskuläre Komplikationen wie DKD etwa 10-20 Jahre nach der Diagnose zu entwickeln; bei Typ-2-Diabetes ist der genaue Beginn oft unbekannt und rechtfertigt daher ein früheres Screening.27
Pathophysiologie und Pathogenese. Man geht davon aus, dass Hyperglykämie drei wesentliche histologische Veränderungen an den Glomeruli hervorruft, die zu DKD führen: 1) Mesangialerweiterung, 2) Verdickung der glomerulären Basalmembran und 3) glomeruläre Sklerose.28 Obwohl die genaue Pathogenese, warum DKD auftritt, nicht bekannt ist, geht man davon aus, dass Hyperglykämie zunächst Hyperfiltration und Nierenschädigung infolge histologischer Veränderungen und Aktivierung von Zytokinen verursacht.20 Typischerweise kann Albuminurie das erste Anzeichen einer DKD sein.29
Dies wird durch komorbide Zustände wie Hyperlipidämie, Arteriosklerose, Bluthochdruck und Fettleibigkeit noch verschlimmert, die alle zur Nierenschädigung und zum nachfolgenden Funktionsverlust beitragen. Die zentrale Adipositas führt durch die Hyperaktivierung des Renin-Angiotensin-Aldosteron-Systems und des sympathischen Nervensystems zu Bluthochdruck.20 Darüber hinaus kommt es mit der Arteriosklerose des Nierengefäßsystems zu einer verstärkten Progression der diabetischen Nephropathie. Ein wichtiges Unterscheidungsmerkmal der diabetischen Nephropathie im Vergleich zu anderen Formen der CKD ist, dass die Glomeruli und Nieren anfangs in der Regel normal oder vergrößert sind.20
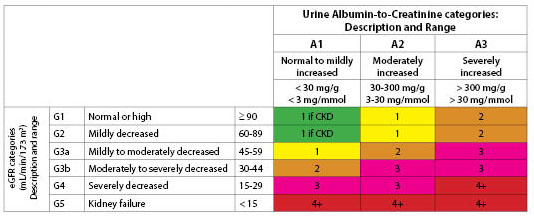
Klassifizierung. Sowohl die eGFR als auch das Vorhandensein von Albuminurie werden zur Einstufung von CKD verwendet.30,31 Die eGFR basiert auf Rasse, Alter, Geschlecht, Gewicht und Serumkreatininwerten. (Siehe Tabelle 3.) In der Vergangenheit wurde der Begriff Mikroalbuminurie verwendet, um mäßig erhöhte Albuminwerte zu definieren. Die National Kidney Foundation empfiehlt jetzt die Verwendung der Begriffe „leicht“, „mäßig“ oder „stark erhöht“ zur Beschreibung der Albuminurie-Werte auf der Grundlage der in Tabelle 4 dargestellten Werte.31 Das Albumin-Kreatinin-Verhältnis ist der erste Test, der zur Feststellung einer Albuminurie verwendet wird.
Tabelle 3. Geschätzte GFR mit Stadium und Beschreibung |
||
|
Stadium |
GFR (mL/min pro 1.73 m2) |
Beschreibung |
|
90+ |
Glomeruläre Hyperfiltration |
|
|
Mildlich reduzierte Nierenfunktion |
||
|
3A |
Mäßig eingeschränkte Nierenfunktion |
|
|
3B |
||
|
Stark eingeschränkte Nierenfunktion |
||
|
< 15 oder an der Dialyse |
End-Stadium des Nierenversagens |
|
Tabelle 4. Albuminurie-Kategorien bei CKD |
||
|
Kategorie |
Albumin zuKreatinin-Werte |
Beschreibung |
|
A1 |
< 30 |
Normal bis leicht erhöht |
|
A2 |
Mäßig erhöht |
|
|
A3 |
> 300 |
Schwer erhöht |
Die beiden Klassifizierungsschemata repräsentieren den doppelten Weg zur Entwicklung von CKD. Der eine führt über eine Erhöhung des Kreatinins und eine Verschlechterung der GFR. Der andere Weg führt über die Entwicklung einer Albuminurie. Auf eine zunehmende Albuminurie folgt häufig eine Verschlechterung der eGFR;32 dies kann jedoch durch den Einsatz von Angiotensin-Converting-Enzym (ACE)-Hemmern oder Angiotensin-Rezeptor-Blockern (ARB) und eine Kontrolle des Blutzuckerspiegels verhindert werden. (Siehe Abbildung 1.)
Abbildung 1. Empfohlene Häufigkeit der Bewertung (Anzahl der Male pro Jahr) nach eGFR- und Albuminurie-Kategorie
Abgedruckt mit Genehmigung von Kidney Disease: Improving Global Outcomes (KDIGO).
Gängige Symptome. Die meisten Menschen haben keine Symptome der diabetischen Nephropathie. Oft haben die Patienten Anzeichen oder Diagnosen anderer mikrovaskulärer Komplikationen.20 Eine frühe DKD ist typischerweise asymptomatisch. Ein Spätbefund der DKD ist schaumiger Urin. Wenn ein Patient stark hypoalbuminämisch ist, kann er außerdem ein Fußödem und Müdigkeit aufweisen.20 Patienten mit diabetischer Nephropathie haben typischerweise eine systemische Hypertonie. Patienten mit diabetischer Nephropathie weisen typischerweise auch eine Retinopathie und Neuropathie auf.8
Diagnostische Möglichkeiten. Da es keine Symptome gibt, ist ein routinemäßiges Screening entscheidend. Die ADA empfiehlt ein jährliches Screening des Albumin-Kreatinin-Verhältnisses im Urin.8 Darüber hinaus sollte bei Patienten mit Typ-1-Diabetes mit einer Dauer von fünf Jahren und bei allen Patienten mit Typ-2-Diabetes oder Patienten mit einer Kombination aus Bluthochdruck und Diabetes mindestens einmal jährlich die eGFR getestet werden.8 Es gibt keine eindeutige Empfehlung für die Durchführung von bildgebenden Verfahren, wie z. B. Ultraschall, zur Diagnose einer DKD.
Differenzialdiagnose. Einige Anzeichen können darauf hindeuten, dass Diabetes nicht die einzige Ursache für CKD ist. Wenn eine Person eine fortgeschrittene CKD ohne Anzeichen anderer mikrovaskulärer Komplikationen hat, ist dies ein Warnzeichen. Eine übermäßige Proteinurie mit plötzlichem Auftreten (weniger als fünf Jahre nach Beginn des Diabetes) eines Urinsediments mit dysmorphen Erythrozyten und Gipsen oder eine abrupte Abnahme der GFR deuten auf eine Nierenerkrankung nichtdiabetischer Ätiologie hin.20 Bei Verdacht auf ein multiples Myelom kann eine Serum- oder Urin-Elektrophorese durchgeführt werden. Das Fehlen einer Albuminurie bei reduzierter eGFR und Diabetes erfordert eine Untersuchung auf andere CKD-Ursachen als DKD.21 In Tabelle 5 sind Red Flags aufgeführt, die auf eine nichtdiabetische glomeruläre Erkrankung hindeuten.
Tabelle 5. Rote Flaggen, die auf eine nichtdiabetische glomeruläre Erkrankung hindeuten
- Beginn der Proteinurie < 5 Jahre nach dem dokumentierten Beginn des Typ-1-Diabetes oder dem akuten Beginn der Nierenerkrankung
- Akuter Abfall der eGFR; diabetische Nephropathie
- Urin-Sediment mit dysmorphen Erythrozyten oder zellulären Ablagerungen
- Abwesenheit anderer mikrovaskulärer Komplikationen wie Neuropathie oder Retinopathie
- Anzeichen und/oder Symptome einer anderen systemischen Erkrankung
Behandlung. Ein wesentliches Merkmal der Diabetes-Nephropathie ist das Management von Glukose, Salzreduktion, Blutdruck und Dyslipidämie. Außerdem sollten die Patienten nephrotoxische Medikamente und Nahrungsergänzungsmittel wie Aminoglykoside und nichtsteroidale Entzündungshemmer vermeiden. Im Stadium IV der Nierenerkrankung oder bei rascher Verschlechterung der Nierenfunktion sollten die Patienten an einen Nephrologen überwiesen werden. Andere Indikationen für eine Überweisung hängen von der Komplexität des Falles ab. Neuere orale Diabetesmedikamente können dazu beitragen, das Fortschreiten der Niereninsuffizienz zu verhindern.
Glykämische Kontrolle. Die Auswahl der Medikamente, die Überwachung und die Pharmakologie sind bei Patienten mit diabetischer Nephropathie von Bedeutung. Wenn die eGFR eines Patienten abnimmt, müssen einige orale Wirkstoffe in der Dosis angepasst werden. Insulin bleibt die zentrale Therapie zur Blutzuckerkontrolle bei Patienten mit Diabetes und fortgeschrittener CKD.31 Tabelle 6 zeigt die empfohlenen Dosisanpassungen für blutzuckersenkende Medikamente bei Patienten mit Nierenerkrankungen. Im Jahr 2016 wurde gezeigt, dass sowohl Empagliflozin als auch Canagliflozin das Fortschreiten der CKD und die Mikroalbuminurie verringern.33,34 Empagliflozin senkte die Raten des Fortschreitens der Nephropathie und verringerte das Risiko größerer unerwünschter kardiovaskulärer Ereignisse im Vergleich zu Placebo, wenn es in der wegweisenden Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG)-Studie zur Standardbehandlung von Typ-2-Diabetes hinzugefügt wurde.33
Tabelle 6. Dosisanpassungen und Empfehlungen für Glukosesenker bei Patienten mit Niereninsuffizienz |
||
|
Glukose-Blutzuckersenker |
Dosierungsanpassungen bei Niereninsuffizienz |
|
Klasse |
Medikation |
|
|
Biguanide |
Metformin |
eGFR 30 bis 45 mL/min/1.73 m2: Es wird nicht empfohlen, eine Therapie einzuleiten. Falls nach Beginn der Therapie, Nutzen/Risiken der Fortsetzung der Therapie abwägen. eGFR < 30 mL/min/1,73 m2: Die Anwendung ist kontraindiziert |
|
Sulfonylharnstoffe |
Glimepirid |
Milde bis mäßige Beeinträchtigung: Mit 1 mg einmal täglich beginnen Schwerwiegende Beeinträchtigungen: Die Anwendung ist kontraindiziert |
|
Glipizid |
Verlängerte Wirkstofffreisetzung: Beginnen Sie mit 2,5 mg einmal täglich |
|
|
Glyburid |
eGFR < 60 mL/min/1,73 m2: Verwendung wird nicht empfohlen |
|
|
Meglitinide |
Nateglinid |
Keine Dosisanpassung erforderlich |
|
Repaglinid |
CrCl 20 bis 40 mL/min: Initiate at 0.5 mg zu den Mahlzeiten CrCl < 20 mL/min: Keine Angaben |
|
|
Thiazolidindione |
Pioglitazon |
Keine Dosisanpassung erforderlich |
|
Rosiglitazon |
Keine Dosisanpassung erforderlich |
|
|
α-Glucosidasehemmer |
Acarbose |
SCr > 2.0 mg/dL: Verwendung wird nicht empfohlen |
|
Miglitol |
CrCl < 25 mL/min oder SCr >2.0 mg/dL: Verwendung wird nicht empfohlen |
|
|
DPP-4-Hemmer |
Alogliptin |
CrCl 30 bis 60 mL/min: 12.5 mg einmal täglich CrCl < 30 mL/min: 6,25 mg einmal täglich ESRD, das Hämodialyse erfordert: 6.25 mg einmal täglich und unabhängig vom Zeitpunkt der Hämodialyse verabreichen |
|
Linagliptin |
Keine Dosisanpassung erforderlich |
|
|
Saxagliptin |
CrCl ≤ 50 mL/min: 2.5 mg einmal täglich ESRD, die eine Hämodialyse erfordert: 2.5 mg einmal täglich und nach Hämodialyse verabreichen |
|
|
Sitagliptin |
CrCl 30 bis 50 mL/min: 50 mg einmal täglich CrCl < 30 mL/min: 25 mg einmal täglich ESRD, das Hämodialyse oder Peritonealdialyse erfordert: 25 mg einmal täglich und unabhängig vom Zeitpunkt der Hämodialyse verabreichen |
|
|
Vildagliptin |
CrCl < 50 mL/min: 50 mg einmal täglich |
|
|
Gallensäure-Sequestrierungsmittel |
Colesevelam |
Keine Dosisanpassung erforderlich |
|
Dopamin-2-Agonisten |
Bromocriptin |
Keine Angaben |
|
SGLT-2-Hemmer |
Canagliflozin |
eGFR 45 bis 60 mL/min/1.73 m2: Nicht mehr als 100 mg einmal täglich eGFR < 45 mL/min/1,73 m2: Es wird nicht empfohlen, die Therapie zu beginnen. Bei Patienten mit einer eGFR von dauerhaft < 45 mL/min/1,73 m2 ist die Therapie abzubrechen. eGFR < 30 mL/min/1,73 m2/ESRD/Hämodialyse: Die Anwendung ist kontraindiziert |
|
Dapagliflozin |
eGFR < 60 mL/min/1,73 m2: Es wird nicht empfohlen, die Therapie einzuleiten. Bei Patienten mit einer eGFR zwischen 30 und < 60 mL/min/1,73 m2 ist die Therapie abzubrechen. eGFR < 30 mL/min/1,73 m2/ESRD/Hämodialyse: Die Anwendung ist kontraindiziert |
|
|
Empagliflozin |
eGFR < 45 mL/min/1,73 m2: Es wird nicht empfohlen, die Therapie einzuleiten. Bei Patienten mit einer eGFR von dauerhaft < 45 mL/min/1,73 m2 ist die Therapie abzubrechen. eGFR < 30 mL/min/1,73 m2. ESRD/Hämodialyse: Verwendung ist kontraindiziert |
|
|
GLP-1-Rezeptor-Agonisten |
Albiglutid |
Keine Dosisanpassung erforderlich |
|
Dulaglutid |
Keine Dosisanpassung erforderlich |
|
|
Exenatid |
CrCl 30 bis 50 mL/min: Keine Angaben. Mit Vorsicht zu verwenden. CrCl < 30 mL/min/ ESRD: Verwendung wird nicht empfohlen |
|
|
Liraglutid |
Keine Angaben |
|
|
Lixisenatid |
eGFR 15 bis 29 mL/min/1.73 m2: Keine Angaben. Auf erhöhte unerwünschte Wirkungen im Magen-Darm-Trakt achten, die zu Dehydratation und Verschlechterung der Nierenfunktion führen können. eGFR <15 mL/min/1.73 m2/ ESRD: Die Anwendung wird nicht empfohlen |
|
|
Amylin-Mimetika |
Pramlintid |
CrCl ≥15 mL/min: Keine Dosisanpassung erforderlich ESRD: Keine Angaben |
|
Insuline |
Rapid-wirkende Analoga
Kurz wirkendes
Intermediäres-Insulinanaloga
Basisinsulinanaloga
|
Der Insulinbedarf kann sich aufgrund von Veränderungen der Insulin-Clearance oder des Insulinstoffwechsels verringern. Überwachen Sie den Blutzucker genau. |
Blutdruck. Die Behandlung des Blutdrucks sollte bei Patienten mit Diabetes und diabetischer Nierenerkrankung bei 140/90 mmHg beginnen.37 In der United Kingdom Prospective Diabetes Study (UKPDS) wurde eine 12%ige Verringerung des Risikos diabetischer Komplikationen mit jeder Senkung des systolischen Drucks um 10 mmHg bis zu einem Druck von 120 mmHg festgestellt.38 Die Medikamente der Wahl sind nach wie vor ACE-Hemmer oder ARBs für Personen mit Bluthochdruck und Diabetes, DKD und CKD. Es hat sich gezeigt, dass die ACE-Hemmung die Entwicklung von DKD verzögert, wenn sie bei Patienten mit leicht erhöhter Albuminurie eingesetzt wird. Der Kreatininwert kann bei Beginn der Behandlung mit einem ACE-Hemmer oder ARB um bis zu 30 % ansteigen.39 Wenn der Kreatininwert stärker ansteigt, sollte eine Untersuchung auf andere zugrundeliegende Nierenerkrankungen in Betracht gezogen werden.
Die KDOQI empfiehlt, Patienten mit Typ-2-Diabetes, die normotensiv und normoalbuminurisch sind, keine ACE/ARBs zu verabreichen.40,41,42 ACE-Hemmer oder ARB werden für Diabetes-Patienten empfohlen, die normotensiv sind und eine Mikroalbuminurie aufweisen.31,37 Für diese Patienten gibt es keine spezifische Dosis oder Titration. Eine doppelte Blockade des Renin-Angiotensin-Systems durch ACE und ARB wird wegen des erhöhten Risikos für Hyperkaliämie, eingeschränkte Nierenfunktion und Hypotonie nicht empfohlen.43
Salzreduktion. Die 2012 durchgeführte Studie zur Reduktion von Endpunkten bei nicht insulinabhängigem Diabetes mellitus mit dem Angiotensin-II-Antagonisten Losartan (RENAAL) und die Irbesartan-Studie zur diabetischen Nephropathie (IDNT) haben gezeigt, dass eine natriumarme Ernährung die nephroprotektive und kardioprotektive Wirkung von ARB bei Patienten mit Typ-2-Diabetes und diabetischer Nephropathie erhöht.44,45
Nierendialyse und Nierentransplantation. Patienten mit terminaler Niereninsuffizienz sollten an die Nephrologie überwiesen werden. Zu den Behandlungsmöglichkeiten gehören Peritonealdialyse oder Hämodialyse, Nierentransport oder die Möglichkeit, die Behandlung abzubrechen und eine Palliativ- oder Hospizversorgung zu beginnen. Eine Beobachtungsstudie ergab, dass Patienten, die in einem jüngeren Alter (< 60 Jahre) mit der Dialyse begannen, ein schlechteres Überleben hatten.46
Überweisung. Abbildung 1 enthält Indikationen für die Überweisung auf der Grundlage der GFR- und Albuminurie-Klassifikation. Es sollten auch andere Ursachen für eine Nierenerkrankung in Betracht gezogen werden, die nichts mit dem Diabetes zu tun haben, insbesondere bei Patienten mit Typ-1-Diabetes, bei denen die Retinopathie nicht vor der Entwicklung der Nephropathie auftritt.21 Nephrologen können bei der Klärung der Diagnose, der Kontrolle der resistenten Hypertonie und der Hyperkaliämie sowie bei der Vorbereitung der Patienten auf die Dialyse helfen.8
Es muss auch berücksichtigt werden, dass die Entwicklung der Nephropathie möglicherweise nicht mit dem Diabetes selbst zusammenhängt. Bei Patienten mit Typ-1-Diabetes geht das Auftreten einer Retinopathie in der Regel der Entwicklung einer Nephropathie voraus.47 Eine Person, die eine Nephropathie, aber keine Retinopathie aufweist, sollte auf andere Ursachen hin untersucht werden. Eine Überweisung an einen Nephrologen sollte erfolgen, um die Ursache der Nephropathie festzustellen, wenn diese unklar ist oder wenn schwer zu behandelnde Probleme im Zusammenhang mit der Nierenerkrankung vorliegen, einschließlich Anämie, Hyperparathyreoidismus und fortschreitender Nierenerkrankung mit einer eGFR < 30 mL/min/1,73 m2.8 Die Hinzuziehung eines Nephrologen bei der Entwicklung von CKD im Stadium 4 (eGFR < 30 mL/min/1,73 m2) ist mit einer geringeren Morbidität, geringeren Kosten im Gesundheitswesen und einer verzögerten Dialyse verbunden.48 Erwägen Sie eine Überweisung im Stadium 3B, um die Patienten früher vorzubereiten und die Nephrologie in die Lage zu versetzen, eine maximale medizinische Behandlung durchzuführen.
Klinische Perlen
- Das jährliche Screening auf DKD sollte durch einen Urin-Albumin-Test und eine Messung der eGFR erfolgen.
- Blutdruck- und Blutzuckerkontrolle können das Fortschreiten der Nephropathie verhindern. Bei Patienten mit Diabetes und CKD sollte der Blutdruck < 140/90 mmHg gehalten werden. ACE-Hemmer oder ARB sollten die Behandlung der Wahl sein.
- ACE-Hemmer und ARB sollten nicht zur Vorbeugung einer Nephropathie eingesetzt werden, wenn Blutdruck und Eiweißausscheidung normal sind. ACE-Hemmer und ARB sollten nicht in Kombination verwendet werden.
- Patienten mit CKD-Stadien 3-5 haben ein erhöhtes Risiko für Hypoglykämie. Bei oralen Wirkstoffen wie Sulfonylharnstoffen ist Vorsicht geboten.
- Bei einigen Patienten mit CKD ist es angebracht, den HbA1c-Zielwert auf > 7 % festzulegen, insbesondere wenn das Risiko einer Hypoglykämie groß ist.
Diabetische periphere Neuropathie
Eine weithin akzeptierte Definition der diabetischen peripheren Neuropathie (DPN) in der klinischen Praxis ist „das Vorhandensein von Symptomen und/oder Anzeichen einer peripheren Nervenfunktionsstörung bei Menschen mit Diabetes nach Ausschluss anderer Ursachen.“49 Die ADA-Klassifikation der distalen symmetrischen Polyneuropathie lautet: 1) primär kleinfaserige Neuropathie, 2) primär großfaserige Neuropathie und 3) gemischte klein- und großfaserige Neuropathie (am häufigsten).
Pathophysiologie und Pathogenese. Die Entwicklung und das Fortschreiten der DPN ergeben sich aus den komplexen Beziehungen zwischen den Nerven und den sie umgebenden Zellen.50 Sowohl vaskuläre Faktoren als auch metabolische Interaktionen tragen zu allen Stadien der DPN bei.51 Das allgemein akzeptierte Verständnis, dass Diabetes beim Menschen zur Entwicklung von DPN führt, ist die komplexe Interaktion zwischen Hyperglykämie, Dauer des Diabetes, altersbedingten neuronalen Schäden, dem Grad der Blutdruck- und Blutfettkontrolle und dem Gewicht.52,53,54,55 Hyperglykämie aktiviert zahlreiche biochemische Stoffwechselwege, die den Stoffwechselzustand einer Nervenzelle bestimmen, und trägt in Kombination mit einer beeinträchtigten Nervendurchblutung zum Fortschreiten von Neuropathien bei. Eine wegweisende Studie, die DCCT, untermauert die Bedeutung der Hyperglykämie in der Pathogenese der Neuropathie.10,56,57 Ein weiterer mit der Hyperglykämie zusammenhängender Mechanismus, der zu DPN führt, ist der durch Hyperglykämie induzierte oxidative und nitrosative Stress mit einer Zunahme der Produktion freier Radikale.58,59
Neben der Hyperglykämie wird seit kurzem vermutet, dass eine geringgradige Entzündung möglicherweise eine wichtige Rolle bei der Pathogenese diabetischer Neuropathien spielt und zu Defiziten in peripheren und autonomen Nervenfasern führt.51,60 Das komplexe Zusammenspiel von metabolischen und vaskulären Faktoren führt zu einem Ungleichgewicht zwischen Schäden und Reparaturen in den Nervenfasern, das insbesondere die distalen sensorischen Fasern betrifft und zum allmählichen Verlust der Empfindung beiträgt, der sich in den klinischen Symptomen der diabetischen Polyneuropathie manifestiert.58,61
Häufige Symptome. Wenn Sie sich nach den Symptomen der DPN erkundigen, notieren Sie die Lokalisation (am ehesten in Händen und Füßen zu spüren), die auslösenden Faktoren, die Charakteristika der Beschwerden sowie das Auftreten und die Häufigkeit der nächtlichen Verschlimmerung, da die Symptome patientenspezifisch sind.4 Sowohl kleine als auch große Fasern sind von erhöhtem Blutzucker betroffen, und die auftretenden Symptome variieren je nach der Klasse der betroffenen sensorischen Fasern. Wenn überwiegend kleine Nervenfasern betroffen sind, sind die ausgelösten Symptome in der Regel Schmerzen (stechend, lanzinierend, prickelnd, brennend, schmerzend, bohrend und übermäßig empfindlich), Dysästhesien (unangenehme Empfindungen wie Brennen, Kribbeln, Stechen und Stechen) und Taubheit.4
Die Intensität der Beschwerden kann vom Gefühl geringer abnormaler Empfindungen bis hin zur Behinderung durch die Schmerzen reichen, die sich nachts verschlimmern und den Schlaf stören können, was nachweislich mit Depressionen in Verbindung gebracht wird, weil die Lebensqualität als vermindert empfunden wird.4
Sind hingegen vorwiegend große Fasern betroffen, können die Patienten Taubheitsgefühle und Kribbeln in den Extremitäten verspüren, unsicherer gehen und das Gleichgewicht verlieren (was zu Stürzen führen kann).4 Bei einigen Patienten können sich die Symptome verschlimmern, wenn ihr Blutzuckerspiegel aufgrund einer intensiveren therapeutischen Behandlung des Diabetes sinkt. Patienten können asymptomatisch sein, aber verschiedene Grade von sensorischem Verlust aufweisen; ein unerwünschtes Ergebnis von schwerem sensorischem Verlust aufgrund von diabetischer Neuropathie kann eine schmerzlose Verletzung sein, die zu einem erhöhten Risiko von Fußulzerationen oder in schweren Fällen zu Amputationen führt.62
Die häufigste Form der diabetischen peripheren Neuropathie ist die distale symmetrische Polyneuropathie mit einem fortschreitenden Verlust von sensorischen Nervenfasern.4 Das typische „Strumpfmuster“ auf beiden Seiten entsteht durch die Schädigungen, die an den distalsten Abschnitten der längsten Nerven (die zuerst betroffen sind) auftreten.63,64,65 Mit fortschreitender Zeit entsteht durch das proximale Fortschreiten der Nervendefizite ein „Strumpfhandschuh“-Muster, das den sensorischen Verlust und die typischen Symptome der DNP fördert.4
Klinische Diagnostik. Die klinische Diagnose einer DPN kann auf der Grundlage der neuropathischen Anzeichen und Symptome eines Patienten mit Diabetes gestellt werden, nachdem andere Ursachen für eine Neuropathie ausgeschlossen wurden.66 Eine asymptomatische periphere diabetische Neuropathie kann bei bis zu 50 % der Betroffenen auftreten; daher ist die Durchführung einer präventiven Fußpflege unerlässlich, insbesondere für diejenigen, die ein hohes Risiko für Verletzungen aufgrund von insensiblen Füßen aufweisen.4 Ein jährliches Screening auf DPN sollte bei allen Patienten mit Diabetes durchgeführt werden, und zwar mittels Nadelstich, Temperatur, Vibrationswahrnehmung (mit einer 128-Hz-Stimmgabel), 10-g-Monofilament-Druckempfindung und tiefem Sehnenreflex am Knöchel; potenzielle Fußgeschwüre können durch einen Verlust der 10-g-Monofilament-Empfindung (Verlust der Schutzempfindung) und eine verminderte Vibrationswahrnehmung vorhergesagt werden.63 Die ADA-Richtlinien für die medizinische Versorgung bei Diabetes (2017) empfehlen weiterhin einen jährlichen 10-g-Monofilament-Test, um Patienten zu identifizieren, bei denen ein Risiko für die Entwicklung von Ulzerationen und Amputationen besteht.8 Darüber hinaus empfehlen die ADA-Richtlinien 2017 ein Screening auf DPN bei der Diagnose von Typ-2-Diabetes und fünf Jahre nach der Diagnose von Typ-1-Diabetes.8
Im Jahr 2009 aktualisierte das Toronto Consensus Panel on Diabetic Neuropathies die Diagnosekriterien, um diagnostische Kategorien bereitzustellen. Darüber hinaus können mehrere gut validierte Screening-Instrumente von Gesundheitsdienstleistern in den Diagnoseprozess einbezogen werden, darunter das Michigan Neuropathy Screening Instrument (MNSI), der Toronto Clinical Neuropathy Score und die Utah Neuropathy Scale. Tabelle 7 beschreibt andere Ursachen für Neuropathie, die ausgeschlossen werden sollten.
Tabelle 7. Andere Ursachen der Neuropathie67
- Alkohol oder andere Gifte
- Neurotoxische Medikamente, insbesondere Chemotherapie
- Vitamin B12-Mangel
- Schilddrüsenunterfunktion
- Nierenerkrankungen
- Malignome (Multiples Myelom, Bronchialkarzinom)
- Humanes Immundefizienz-Virus (HIV)
- Chronische entzündliche demyelinisierende Neuropathie, vererbte Neuropathien und Vaskulitis
Diagnostische Untersuchungen. Es gibt mehrere diagnostische Tests, um das Vorliegen einer DPN zu bestätigen. Nervenleitfähigkeitsuntersuchungen gelten seit Jahren als der diagnostische Goldstandard für DPN, da sie objektiv und ohne Patientenreaktionen durchgeführt werden können, was zu einer hohen Zuverlässigkeit führt.4 Quantitative sensorische Tests bewerten die Fähigkeit der Patienten, leichte Berührungen, Vibrationen und Temperaturunterschiede zu erkennen, was ein gewisses Maß an Subjektivität voraussetzt.4 Andere Methoden, einschließlich Hautbiopsie und intraepidermale Nervenfaserdichte und konfokale Hornhautmikroskopie, werden in der klinischen Praxis nicht routinemäßig eingesetzt, können aber in klinischen Studien verwendet werden.4
Behandlungsmöglichkeiten: Pharmakologische Behandlung. Die pharmakologische Behandlung der DPN dient der symptomatischen Verbesserung, d. h. die verwendeten Medikamente sind nicht dazu gedacht, ein Fortschreiten der Erkrankung zu verhindern. In Tabelle 8 sind Medikamente aus den drei am häufigsten verwendeten Klassen (Antikonvulsiva, Antidepressiva und Opioide) zur Kontrolle neuropathischer Symptome zusammengefasst. Obwohl mehrere Wirkstoffe häufig als erster Ansatz für die Behandlung von DPN verwendet werden, sind nur Pregabalin und Duloxetin von der FDA für die Behandlung dieser Erkrankung zugelassen; daher wird einer dieser Wirkstoffe als erste Wahl für symptomatische neuropathische Schmerzen empfohlen.4 Gabapentin ist zwar nicht von der FDA für die Behandlung von DPN zugelassen, wird aber häufig als erster Ansatz verwendet, der eine vergleichbare Wirksamkeit wie die von der FDA zugelassenen Wirkstoffe aufweist. Trizyklische Antidepressiva (z. B. Amitriptylin) – nicht von der FDA zugelassene DPN-Wirkstoffe – sind bei der Behandlung von DPN wirksam, sollten aber wegen des höheren Risikos von Nebenwirkungen mit Vorsicht eingesetzt werden.
Tabelle 8. Häufig verwendete pharmakologische Wirkstoffe für DPN4,69 |
|||||
|
Pharmazeutischer Wirkstoff (NNT-Bereich 30-50%ige Verbesserung*) |
Max. Tagesdosis für DNP (mg/Tag) |
Gebräuchliche Nebenwirkungen |
Dosisanpassungen erforderlich? |
Kontraindikationen |
Berücksichtigung bei der Verschreibung |
|
Antikonvulsiva
|
|||||
|
Pregabalin (3.3-8.3) |
Schwindel Somnolenz Gewichtszunahme Periphere Ödeme Verschwommenes Sehen Verstopfung |
Renal: Ja Hepatisch: Nein |
Überempfindlichkeit gegen Pregabalin |
Strong evidence; FDA approved; controlled substance |
|
|
Gabapentin (3.3-7.2) |
3,600 |
Schwindel Ataxie Somnolenz Kopfschmerzen Übelkeit Durchfall Gewichtszunahme |
Renal: Ja Hepatisch: Nein |
Überempfindlichkeit gegen Gabapentin |
Mäßige Evidenz; nicht von der FDA zugelassen |
|
Antidepressiva
|
|||||
|
Amitriptylin (2.1-4.2) |
Schwere Sedierung; Verwirrung; anticholinerge Wirkungen (Verstopfung, verschwommenes Sehen) |
Renal: Nein Hepatisch: Nein Bei älteren Patienten werden niedrigere Dosen empfohlen |
Überempfindlichkeit gegen Amitriptylin; gleichzeitige Verabreichung mit oder innerhalb von 14 Tagen nach MAOs; gleichzeitige Verabreichung mit Cisaprid; Akute Erholungsphase nach Myokardinfarkt |
Mäßige Evidenz; nicht von der FDA zugelassen; mit Vorsicht anwenden bei Personen mit einer Vorgeschichte von Herz-Kreislauf-Erkrankungen |
|
|
Duloxetin (3.8-11) |
(USA) |
Brechreiz; Sedierung; generalisierte Schläfrigkeit |
Renal: Ja Leber: Anwendung bei Leberfunktionsstörungen vermeiden |
Überempfindlichkeit; gleichzeitige Verabreichung mit oder innerhalb von 14 Tagen nach MAOs; Einleitung bei Personen, die Linezolid oder IV-Methylenblau erhalten |
Moderate Evidenz; FDA zugelassen; kann zu Pregabalin oder Gabapentin hinzugefügt werden |
|
Venlafaxin (5.2-8.4) |
Brechreiz; Sedierung; generalisierte Schläfrigkeit |
Renal: Ja Hepatic: Ja |
Schwache Evidenz; nicht von der FDA zugelassen; kann zu Gabapentin hinzugefügt werden |
||
|
Opioide
|
|||||
|
Tramadol (2.1-6.4) |
Somnolenz Brechreiz Erbrechen Verstopfung Schwindel Kopfschmerzen |
Renal: Ja Hepatisch: Nein |
Überempfindlichkeit gegen Tramadol, Opioide oder einen Bestandteil der Formulierung; ER-Formulierung: erhebliche Atemdepression und akutes oder schweres Asthma; IR-Formulierung: Akute Intoxikation mit Alkohol, Hypnotika, Narkotika, zentral wirkenden Analgetika, Opioiden oder Psychopharmaka |
Niedriges Missbrauchspotenzial (kontrollierte Substanz der Liste IV); nicht zur Verwendung als Erst- oder Zweitlinientherapeutikum empfohlen |
|
|
Tapentadol (N/A) |
Mittelfreigabe: Verlängerte Wirkstofffreisetzung: |
Somnolenz Übelkeit Erbrechen Verstopfung Schwindel |
Renal: Verwendung nicht empfohlen, wenn Hepatisch: Nein |
Überempfindlichkeit gegen Tapentadol; erhebliche Atemdepression; akutes oder schweres Asthma; paralytischer Ileus; innerhalb von 14 Tagen nach Einnahme von MAO-Hemmern |
FDA-zugelassen; kontrollierte Substanz der Liste II; nicht zur Verwendung als Erst- oder Zweitlinientherapeutikum empfohlen |
|
Die Informationen beziehen sich auf pharmazeutische Wirkstoffe, die aus den jeweiligen Packungsbeilagen entnommen wurden (mit Verweis auf die Handelsnamen) |
|||||
Die Leitlinie der American Academy of Neurology (AAN) empfiehlt die folgenden topischen Mittel: Capsaicin und Isosorbiddinitrat-Spray (moderate Evidenz) und Lidoderm-Pflaster (schwache Evidenz).69 Oxcarbazepin, Lamotrigin, Lacosamid, Clonidin, Pentoxifyllin und Mexiletin werden in der AAN-Leitlinie für die Behandlung von DPN nicht empfohlen.69
Darüber hinaus werden Opioide von einigen Patienten für die Behandlung von refraktärer DPN empfohlen. Zu den in der AAN-Leitlinie empfohlenen Opioiden gehören Dextromethorphan (400 mg/Tag), Morphinsulfat (titriert auf 120 mg/Tag) und Oxycodon (durchschnittlich 37 mg/Tag, maximal 120 mg/Tag); es liegen jedoch keine ausreichenden Daten vor, um den Einsatz eines Wirkstoffs gegenüber einem anderen zu empfehlen.69 Die Autoren dieses Papiers empfehlen den Einsatz von Opioiden nur in schweren refraktären Fällen mit genauer Überwachung der Patienten, die durch Opioide eine echte funktionelle Verbesserung erfahren. Die Autoren folgen der Stellungnahme der Centers for Disease Control and Prevention aus dem Jahr 2016, wonach Opioide bei Schmerzen, die nicht auf Krebs zurückzuführen sind, nur begrenzt langfristig eingesetzt werden können.70
Eine der Herausforderungen bei der pharmakologischen Behandlung von DPN sind unzureichende Head-to-Head-Studien, die Ergebnisse zur Lebensqualität berücksichtigen.4 Eine kürzlich durchgeführte Studie, die eine achtwöchige Therapie mit hochdosiertem Pregabalin, hochdosiertem Duloxetin oder einer Kombination verglich, fand keine signifikanten Unterschiede in der durchschnittlichen Schmerzveränderung zwischen der Monotherapie und der Kombinationstherapie.71 Es werden mehr Studien benötigt, die zwei Wirkstoffe miteinander vergleichen, um einen Einblick in die Verbesserung der Versorgung von Menschen mit diabetischer peripherer Neuropathie zu erhalten.
Nicht-pharmakologische Behandlung. Verfahren. In der ANN-Leitlinie wird empfohlen, die perkutane elektrische Nervenstimulation für drei bis vier Wochen zur Behandlung der DPN in Betracht zu ziehen.69 Eine randomisierte, kontrollierte Pilotstudie mit Akupunktur in zwei Phasen72 und eine randomisierte, placebokontrollierte Einzelblindstudie73 , in der die Wirksamkeit der Akupunktur bei DPN untersucht wurde, zeigten beide Verbesserungen bei den mit Schmerzen verbundenen Ergebnisgrößen. Es sind jedoch weitere Studien erforderlich, um die Rolle der Akupunktur bei der Behandlung von DPN zu bestätigen.
Alpha-Liponsäure. Einiges deutet darauf hin, dass die Verwendung des Antioxidans Alpha-Liponsäure dazu beitragen könnte, den durch freie Radikale vermittelten oxidativen Stress zu reduzieren und folgende Vorteile zu bieten: gezielte Bekämpfung der Pathogenese, Verlangsamung der Entwicklung und Verbesserung der Symptome von DPN.74,75
Prävention. Änderungen des Lebensstils mit Schwerpunkt auf gesunder Ernährung und körperlicher Aktivität verringern nachweislich kontinuierlich die Prävalenz von Diabetes und seinen Komplikationen, einschließlich der diabetischen peripheren Neuropathie.68 Eine intensive glykämische Kontrolle trägt nachweislich dazu bei, das Risiko einer diabetischen Neuropathie bei Patienten mit Diabetes durch Verbesserung der Nervenfunktion zu senken.61,76,77 Die DCCT hat die Rolle der glykämischen Kontrolle bei der Verhinderung und Beendigung des Fortschreitens der diabetischen Neuropathie bei Typ-1-Diabetes nachgewiesen.10,56
Klinische Perlen
- Bis zu 50 % der Patienten können eine schmerzlose oder asymptomatische periphere Neuropathie haben.
- Patienten mit Neuropathie wird empfohlen, eine Fußpflegeausbildung (tägliche Selbstinspektion der Füße) und eine regelmäßige podologische Versorgung für ausgewählte Patienten zu erhalten.
- Patienten mit DPN, die Anzeichen für einen Verlust des schützenden Gefühls mit oder ohne Deformität aufweisen, sollte geraten werden, alle drei bis sechs Monate einen Arzt aufzusuchen, um vorbeugende Maßnahmen zu ergreifen.64
- Um die Symptome der DPN effektiv zu behandeln, ist ein multidisziplinärer Ansatz unerlässlich; dieser umfassende Ansatz kann pharmakologische, psychologische und/oder physikalische Therapie beinhalten.
- Eine neue Stellungnahme der ADA zur diabetischen Neuropathie empfiehlt ein Screening auf DPN bei Patienten mit Prädiabetes, die Symptome einer peripheren Neuropathie aufweisen.4
- Personen mit einer peripheren Erkrankung, einer nicht-sensorischen Neuropathie oder einem Charcot-Fuß müssen speziell betreut werden.
Gastroparese
Eine weitere Form der Diabetes-Neuropathie ist die Gastroparese. Diese Erkrankung geht mit Symptomen des oberen Magen-Darm-Trakts einher, darunter Übelkeit, Erbrechen, frühzeitiges Sättigungsgefühl oder postprandiales Völlegefühl, Bauchschmerzen und Blähungen, ohne dass jedoch eine Obstruktion der Ausgänge vorliegt. Obwohl es eine Reihe von Ursachen für Gastroparese gibt, schätzt man, dass Diabetes für etwa ein Drittel aller Fälle verantwortlich ist.78
Pathophysiologie. Zu den vorgeschlagenen pathophysiologischen Mechanismen der diabetischen Gastroparese gehören eine gestörte glykämische Kontrolle, eine vagale oder prävertebrale sympathische Ganglienneuropathie, Anomalien der interstitiellen Cajal-Zellen, ein Verlust der Stickstoffmonoxid-Synthase und möglicherweise eine Myopathie.79,80
Klinische Präsentation. Zu Beginn dieser Erkrankung sind die Patienten in der Regel asymptomatisch. Es gibt keine lineare Beziehung zwischen den Symptomen und dem Schweregrad der Neuropathie. Die große Vielfalt der Symptome erschwert die Diagnose der Erkrankung. Zu den weiteren klinischen Erscheinungsbildern gehören Anorexie, Unterernährung, Gewichtsverlust und Hypoglykämie, die auf ein Missverhältnis zwischen der Aufnahme von Nahrung und Insulin zurückzuführen ist. Schmerzen werden möglicherweise nicht ausreichend wahrgenommen, sind aber für viele Menschen von Bedeutung. In einem von den NIH finanzierten Konsortium hatten 72 % der Patienten mit Gastroparese Bauchschmerzen.81 Bei 18 % dieser Patienten war dies das vorherrschende Symptom. Die Schmerzen wurden durch das Essen ausgelöst (72 %), traten nachts auf (74 %) und beeinträchtigten den Schlaf (66 %) dieser Patienten.81
Wie häufig ist die Diabetes-Gastroparese? Die kumulative 10-Jahres-Inzidenz der Gastroparese wird bei Typ-1-Diabetes auf 5,2 % und bei Typ-2-Diabetes auf 1 % der Patienten mit Diabetes in der Gemeinschaft geschätzt.82 Andere Studien haben Raten zwischen 5 und 12 % ermittelt.83,84 Die Raten sind jedoch viel höher, wenn die Diagnose auf Symptomen und nicht auf der Magenentleerungsstudie beruht.
Gastroparese ist bei Typ-1-Diabetes häufiger als bei Typ-2-Diabetes, und sie tritt am häufigsten auf, wenn die Person seit mehr als 10 Jahren an Diabetes leidet und die anderen mikrovaskulären Komplikationen wie Retinopathie, Nephropathie und periphere Neuropathie entwickelt hat. Tritt die Gastroparese bei einem Patienten früher als erwartet auf, sollten andere Ursachen untersucht werden, am häufigsten perioperative vagale Nervenverletzungen oder pharmakologische Wirkungen von Inkretin-basierten Wirkstoffen – Glucagon-like Peptide-1-Rezeptor-Agonisten (GLP-1RA) und Dipeptidyl-Peptidase-4-Inhibitoren (DPP-4-Inhibitoren).
Wenn ein Patient einmal Gastroparese-Symptome entwickelt hat, bleiben diese in der Regel bestehen und sind über 12-25 Jahre stabil. Dies gilt selbst dann, wenn sich die Blutzuckereinstellung verbessert hat,85 außer im Falle einer Pankreas- oder Nierentransplantation.86 Obwohl es keine eindeutigen Beweise dafür gibt, dass Gastroparese die Sterblichkeit erhöht, schränkt sie alle Aspekte der Lebensqualität erheblich ein.87
Diagnostik. Eine Reihe von Tests kann bei der Diagnose helfen. Der Goldstandard für diese Diagnose ist die gastroösophageale Szintigraphie. Sie ist nicht invasiv, prüft die Physiologie und liefert quantitative Ergebnisse. Eine Gastroparese kann diagnostiziert werden, wenn eine fettarme Standardmahlzeit vier Stunden nach dem Verzehr zu mindestens 35 % zurückgehalten wird.80
Um möglichst genaue Testergebnisse zu erhalten, sollte das Protokoll vor dem Test das Absetzen aller motilitätsverändernden Medikamente für mindestens zwei bis drei Tage vor dem Test beinhalten, einschließlich Prokinetika, Opiate und Anticholinergika. Inkretinwirkstoffe wie GLP-1-Agonisten und DPP-4-Inhibitoren sollten ebenfalls abgesetzt werden, da sie bekanntermaßen die Magenentleerung verzögern. Auch eine Hyperglykämie verzögert nachweislich die Magenentleerung, und der Blutzuckerspiegel sollte vor Beginn der Studie unter 275 mg/dL liegen.79,88
Patienten sollten am Testtag nicht rauchen und keinen Alkohol konsumieren, da beides die Magenentleerung verlangsamen kann.89 Darüber hinaus können GLP-1RAs die Gastroparese verschlimmern, da sie die Magenentleerung verlangsamen. Außerdem kann bei manchen Menschen eine subklinische Gastroparese vorliegen, die bei Beginn der Einnahme eines GLP-1RA entdeckt wird.
Behandlung. Die Behandlung der Gastroparese hängt weitgehend von der Schwere der Symptome ab. Zu den allgemeinen Behandlungsprinzipien gehören unterstützende Behandlungen (Flüssigkeit, Elektrolyte, Glukosekontrolle und Ernährung), medikamentöse Behandlungen (Prokinetika, Antiemetika und Schmerzlinderung) und invasive Behandlungen (Chirurgie, Botox-Injektionen, Magenschrittmacher oder elektrische Stimulation).79
Die unterstützende Behandlung wird in der Regel im Krankenhaus begonnen und konzentriert sich auf die Normalisierung von Flüssigkeits-, Elektrolyt- und Ernährungsstörungen. Bei der Ernährungsunterstützung wird die enterale Ernährung der parenteralen Ernährung vorgezogen, da sie physiologischer ist und zur Erhaltung der Darmflora beitragen kann. Außerdem kann eine Ernährungsumstellung bei Gastroparese sehr hilfreich sein. Für Patienten mit Gastroparese werden ballaststoff-, fett- und rückstandsarme Diäten empfohlen.85 Ballaststoffreiche Diäten können die Symptome verstärken, da sie mehr Verdauung erfordern.
Medikamente. Prokinetika: In den Vereinigten Staaten sind Metoclopramid und Erythromycin die am häufigsten verwendeten Medikamente zur Behandlung der Gastroparese. Metoclopramid ist jedoch wegen des Risikos einer Spätdyskinesie mit einer Blackbox-Warnung versehen. Die Entwicklung dieses Zustands steht in direktem Zusammenhang mit der Dauer der Metoclopramideinnahme und der Anzahl der eingenommenen Dosen. Bei der Anwendung dieses Medikaments ist es am besten, es nur bei symptomatischen Patienten einzusetzen und mit der niedrigsten wirksamen Dosis 15 Minuten vor den Mahlzeiten zu beginnen. Medikamentenpausen können manchmal dazu beitragen, die Dauer der Wirkung zu verlängern.90
Domperidon ist ein selektiverer Dopaminagonist, der ebenso wirksam ist wie Metoclopramid, aber weniger Nebenwirkungen auf das zentrale Nervensystem hat.91
Antiemetika: Antiemetika können zur Linderung der Symptome eingesetzt werden. Das Risiko von Wechselwirkungen mit anderen Medikamenten ist jedoch beträchtlich und sollte sorgfältig überwacht werden.
Die Behandlung von Schmerzen kann bei Patienten mit Gastroparese eine Herausforderung darstellen. Trizyklische Antidepressiva werden häufig als Erstlinientherapie für Schmerzen bei Gastroparese eingesetzt. Als Zweitlinientherapie werden der schwache mu-Opioidrezeptor-Agonist Tramadol, der auch Serotonin freisetzt und die Wiederaufnahme von Noradrenalin hemmt, und das Gamma-Aminobuttersäure-Analogon Gabapentin eingesetzt. Die Verwendung von Narkotika bei Gastroparese wird jedoch nicht empfohlen, da sie zu Verstopfung und einer Verschlimmerung der Symptome beitragen können.
Invasive Behandlungen: Botox-Injektionen werden häufig bei der Behandlung von Gastroparese eingesetzt, aber ihre Verwendung ist nicht durch klinische Studien belegt.92,93
Das elektrische Magenstimulationsgerät wurde im Jahr 2000 von der FDA im Rahmen einer humanitären Ausnahmegenehmigung zugelassen.94 Das elektrische Magenstimulationsgerät gibt hochfrequente elektrische Stimulationen mit niedriger Energie an den Magen ab. Es ist bei diabetischer Gastroparese hilfreicher als bei idiopathischer Gastroparese. Eine Meta-Analyse ergab eine erhebliche Verbesserung der Symptome der Patienten. Der genaue Mechanismus des Nutzens ist noch nicht bekannt.95 Es wurde vorgeschlagen, dass die elektrische Magenstimulation zu Veränderungen in den zentralen Mechanismen führt, die Übelkeit und Erbrechen kontrollieren, die vagale Funktion steigert und zu einer geringeren Empfindlichkeit gegenüber Blähungen führt.97 Patienten, die gut darauf ansprechen, reagieren in der Regel schnell. Dies hat einige dazu veranlasst, zunächst einen Versuch mit einer vorübergehenden Elektrodenplatzierung zu empfehlen, bevor eine langfristige Anwendung erfolgt.
Klinische Perlen
- Die diabetische Gastroparese tritt häufiger bei Menschen mit langjährigem Diabetes und anderen mikrovaskulären Komplikationen auf.
- Der Goldstandard für die Diagnose der Gastroparese ist die gastroösophageale Szintigraphie.
- Bei diabetischer Gastroparese wird eine ballaststoff-, fett- und rückstandsarme Ernährung empfohlen.
- Pharmakologische und interventionelle Behandlungen haben einen begrenzten Nutzen und ein erhebliches Langzeitrisiko.
Diabetische Cheiroarthropathie
Eine der weniger bekannten Diabeteskomplikationen ist die Cheiroarthropathie. Sie ist gekennzeichnet durch eine eingeschränkte Beweglichkeit der Gelenke aufgrund einer Verdickung der Haut bei Menschen mit langjährigem Diabetes. Sie war wahrscheinlich die erste Komplikation, die bei Typ-1-Diabetes festgestellt wurde. Die Prävalenzraten schwanken zwischen 8 und 50 %.98
Es wird angenommen, dass die Cheiroarthropathie durch die Glykosylierung und Vernetzung von Kollagen verursacht wird. Sie kann die Haut und die Sehnen betreffen und zu einer eingeschränkten Beweglichkeit der Gelenke, meist der Finger, Steifheit und Schmerzen führen. Das klassische Anzeichen für eine diabetische Cheiropathie ist das „Gebetszeichen“. In diesem Fall ist die Person nicht in der Lage, ihre Hände zum „Beten“ vollständig zu strecken, so dass eine Lücke zwischen den Fingern der linken und rechten Hand entsteht. Es gibt Hinweise darauf, dass Menschen, die eine Cheiropathie entwickeln, ein dreimal höheres Risiko für mikrovaskuläre Komplikationen haben.99
Die diabetische Cheiropathie ist typischerweise bei Menschen mit langjährigem oder schlecht eingestelltem Blutzuckerspiegel schlimmer. Glücklicherweise erfahren viele Menschen eine Linderung der Symptome und eine verbesserte Mobilität, wenn sich die Blutzuckereinstellung verbessert.100
Schlussfolgerung
Die Behandlung von Diabeteskomplikationen erfordert ein multidisziplinäres Team. Ein frühzeitiges Screening auf Retinopathie, Nephropathie und Neuropathie ist angesichts der asymptomatischen Natur der Krankheit unerlässlich. Das Hauptmerkmal des Diabetesmanagements für alle Komplikationen ist nach wie vor die Kontrolle des Blutzuckerspiegels und des Blutdrucks.
- American Diabetes Association. Cost of Diabetes. Available at: http://www.diabetes.org/advocacy/news-events/cost-of-diabetes.html?referrer=https://www.google.com/. Updated June 22, 2015. Accessed Feb. 8, 2017.
- UK Prospective Diabetes Study Group. Intensive Blutzuckerkontrolle mit Sulfonylharnstoffen oder Insulin im Vergleich zu konventioneller Behandlung und Risiko von Komplikationen bei Patienten mit Typ-2-Diabetes. Lancet 1998;352:837-853.
- Gregg EW, Yanfed L, Wang J. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med 2014;370:1514-1523.
- Pop-Busui R, Boulton A, Feldman E, et al. Diabetes neuropathy: A position statement by the American Diabetes Association. Diabetes Care 2017;40:136-154.
- Leasher JL, Bourne RR, Flaxman SR, et al. Global estimates on the number of people blind or visually impaired by diabetic retinopathy: A meta-analysis from 1990 to 2010. Diabetes Care 2016;39:1643-1649.
- National Eye Institute. Facts about diabetic eye disease. Available at: https://nei.nih.gov/health/diabetic/retinopathy. Updated Sept. 2015. Accessed Feb. 8, 2017.
- Fong, DS, Aiello L, Gardner TW, et al. Retinopathy in diabetes. Diabetes Care 2004;27(Suppl 1):S84-S87.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017. Diabetes Care 2017;40:(Suppl 1):S4-S5.
- Doggen K, Nobels F, Scheen AJ, et al. Cardiovascular risk factors and complications associated with albuminuria and impaired renal function in insulin-treated diabetes. J Diabetes Complications 2013;27:370-375.
- The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-986.
- Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Eye Study Group und die Action to Control Cardiovascular Risk in Diabetes Follow-On (ACCORDION) Study Group. Anhaltende Auswirkungen einer intensiven Blutzuckerkontrolle auf die Retinopathie bei Typ-2-Diabetes in der Action to Control Cardiovascular Risk in Diabetes (ACCORD) Follow-On Studie. Diabetes Care 2016;39:1089-1100.
- ACCORD Study Group, ACCORD Eye Study Group, Chew EY, et al. Effects of medical therapies on retinopathy progression in type 2 diabetes. N Engl J Med 2010;363:233-244.
- Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: The Action to Control Cardiovascular Risk in Diabetes (ACCORD) Eye Study. Ophthalmology 2014;121:2443-2451.
- Diabetes Control and Complications Trial Research Group. Auswirkung der Schwangerschaft auf mikrovaskuläre Komplikationen in der Diabetes Control and Complications Trial. Diabetes Care 2000;23:1084-1091.
- Colberg SR, Sigal RJ, Yardley JE, et al. Physical activity/exercise and diabetes: A position statement of the American Diabetes Association. Diabetes Care 2016;39:2065-2079.
- The Diabetic Retinopathy Study Research Group. Preliminary report on effects of photocoagulation therapy. Am J Ophthalmol 1976;81:383-396.
- Early Treatment Diabetic Retinopathy Study Research Group. Photocoagulation for diabetic macular edema: Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-1806.
- Nguyen QD, Brown DM, Marcus DM, et al. Ranibizumab for diabetic macular edema: Ergebnisse aus 2 randomisierten Phase-III-Studien: RISE and RIDE. Ophthalmology 2012;119:789-801.
- Wong TY, Cheung CMG, Larsen M, et al. Diabetic retinopathy. Nat Rev Disease Prim doi:10.1038/nrdp.2016.12; published online March 17, 2016.
- Batuman V, Soman AS, Schmidt RJ, Soman SS. Diabetes nephropathy. Medscape Available at: http://emedicine.medscape.com/article/238946-overview. Updated Sept. 30, 2016. Accessed Feb. 12, 2017.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: A report from an ADA Consensus Conference. Diabetes Care 2014;37:2864-2883. https://doi.org/10.2337/dc14-1296
- Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-2572.
- Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129-139.
- Ismail-Beigi F, Craven T, Banerji MA, et al. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: Eine Analyse der randomisierten ACCORD-Studie. Lancet 2010;376:419-430.
- National Kidney Foundation. KDOQI-Leitlinie für die klinische Praxis bei Diabetes und CKD: Update 2012. Am J Kidney Dis 2012;60:850-886.
- Fox CS, Matsushita K, Woodward M, et al. Chronic Kidney Disease Prognosis Consortium. Assoziationen von Nierenerkrankungen mit Sterblichkeit und Nierenerkrankungen im Endstadium bei Menschen mit und ohne Diabetes: A meta-analysis. Lancet 2012;380:1662-1673.
- Hahr AJ, Molitch ME. Management des Diabetes mellitus bei Patienten mit chronischer Nierenerkrankung. Clin Diabetes Endocrinol 2015. doi: 10.1186/s40842-015-0001-9.
- Alsaad KO, Herzenberg AM. Die Unterscheidung der diabetischen Nephropathie von anderen Fällen von Glomerulosklerose: An update. J Clin Pathol 2007;60:18-26.
- Narva AS, Bilous RW. Laborbeurteilung der diabetischen Nierenerkrankung. Diabetes Spectr 2015;28:162-166.
- Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
- National Kidney Foundation. KDOQI-Richtlinien für die klinische Praxis bei chronischer Nierenerkrankung: Bewertung, Klassifizierung und Stratifizierung. Am J Kidney Dis 2002;39(2 Suppl 1):S1-S266.
- de Boer IH, Rue TC, Cleary PA, et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: Eine Analyse der Kohorte des Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications. Arch Intern Med 2011;171:412-420.
- Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and progression of kidney disease in type 2 diabetes. N Engl J Med 2016;375:323-334.
- Heerspink HJL, Desai M, Jardine M, et al. Canagliflozin verlangsamt das Fortschreiten der Verschlechterung der Nierenfunktion unabhängig von der glykämischen Wirkung. J Am Soc Nephrol 2016;28:1-8.
- Lexi-Drugs. Lexicomp. Wolters Kluwer Health, Inc. Riverwoods, IL. Available at: http://online.lexi.com. Accessed Oct. 31, 2016.
- Micromedex Solutions. Truven Health Analytics, Inc. Ann Arbor, MI. Available at: http://www.micromedexsolutions.com. Accessed Oct. 31, 2016.
- James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults. JAMA 2014;311:507-520.
- King P, Peacock I, Donnelly R. The United Kingdom Prospective Diabetes Study (UKPDS): Klinische und therapeutische Implikationen für Typ-2-Diabetes. Br J Clin Pharmacol 1999;48:643-648.
- Jackevicius CA, Wong J, Aroustamian I, et al. Rates and predictors of ACE inhibitor discontinuation subsequent to elevated serum creatinine: A retrospective cohort study. BMJ Open 2014;4:e005181.
- Mauer M, Zinman B, Gardiner R, et al. Renal and retinal effects of enalapril and losartan in type 1 diabetes. N Engl J Med 2009;361:40-51.
- Bilous R, Chaturvedi N, Sjølie AK, et al. Effect of candesartan on microalbuminuria and albumin excretion rate in diabetes: Drei randomisierte Studien. Ann Intern Med 2009;151:11-20.
- Haller H, Ito S, Izzo JL Jr, et al. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes. N Engl J Med 2011;364:907-917.
- Makani H, Bangalore S, Desouza KA, et al. Efficacy and safety of dual blockade of the renin-angiotensin system: Meta-Analyse von randomisierten Studien. BMJ 2013;346:f360.
- Miao Y, Ottenbros SA, Laverman GD, et al. Effect of a reduction in uric acid on renal outcomes during losartan treatment: A post-hoc analysis of the reduction of endpoints in non-insulin-dependent diabetes mellitus with the Angiotensin II Antagonist Losartan Trial. Hypertension 2011;58:2-7.
- Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Eng J Med 2001;354:851-860.
- Adler A, Casula A, Steenkamp R, et al. Association between glycemia and mortality in diabetic individuals on renal replacement therapy in the U.K. Diabetes Care 2014;37:1304-1311.
- Sharma SG, Bomback AS, Radhakrishnan J, et al. The modern spectrum of renal biopsy findings in patients with diabetes. Clin J Am Soc Nephrol 2013;8:1718-1724.
- Smart NA, Dieberg G, Ladhani M, Titus T. Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev 2014;6:CD007333.
- Boulton AJM, Gries FA, Jervell JA. Leitlinien für die Diagnose und das ambulante Management der diabetischen peripheren Neuropathie. Diabet Med 1998;15:508-514.
- O’Brien PD, Hinder LM, Sakowski SA, Feldman EL. ER-Stress bei diabetischer peripherer Neuropathie: A new therapeutic target. Antioxid Redox Signal 2014;21:621-633.
- Cameron NE, Cotter MA. Pro-inflammatorische Mechanismen bei diabetischer Neuropathie: Focus on the nuclear factor kappa B pathway. Curr Drug Targets 2008;9:60-67.
- Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341-350.
- Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlated with progression of diabetic neuropathy. Diabetes 2009;58:1634-1640.
- Stella P, Ellis D, Maser RE, Orchard TJ. Kardiovaskuläre autonome Neuropathie (Verhältnis von Exspiration und Inspiration) bei Typ-1-Diabetes. Inzidenz und Prädiktoren. J Diabetes Complications 2000;14:1-6.
- Witten DR, Tesfaye S, Chaturvedi N, et al. Risk factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005;48:164-171.
- Diabetes Control and Complication Trial (DCCT) Research Group. Auswirkung einer intensiven Diabetesbehandlung auf die Nervenleitfähigkeit im Diabetes Control and Complications Trial. Ann Neurol 1995;38:869-880.
- Diabetes Control and Complication Trial (DCCT) Research Group. Der Effekt einer intensiven Diabetestherapie auf die Funktion des autonomen Nervensystems im Diabetes Control and Complications Trial (DCCT). Diabetologia 1998;41:416-423.
- Edwards JL, Vincent AM, Cheng HT, Feldman EL. Diabetic neuropathy: Mechanisms to management. Pharmacol Ther 2008;120:1-34.
- Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetic neuropathy: Cellular mechanisms a therapeutic target. Nat Rev Neurol 2011;7:573-583.
- Kellogg AP, Wiggin T, Larkin D, et al. Protective effects of cyclooxygenase-2 gene inactivation against peripheral nerve dysfunction and intraepidermal nerve fibers loss in experimental diabetes. Diabetes 2007;56:2997-3005.
- Callaghan BC, Cheng HT, Stables CL, et al. Diabetic neuropathy: Klinische Manifestationen und aktuelle Behandlungen. Lancet Neurol 2012;11:521-534.
- Boulton AJM, Kirsner RS, Vileikyte L. Clinical practice: Neuropathic diabetic foot ulcers. N Eng J Med 2004;351:48-55.
- Boulton AJM, Vinik AI, Arezzo JC, et al. Diabetic neuropathies: Eine Erklärung der American Diabetes Association. Diabetes Care 2005;28:956-962.
- Boulton AJM, Armstrong DG, Albert SF, et al. Comprehensive foot examination and risk assessment: Ein Bericht der Task Force der Foot Care Interest Group der American Diabetes Association, mit Unterstützung der American Association of Clinical Endocrinologists. Diabetes Care 2008;31:1679-1685.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: Update zu Definitionen, Diagnosekriterien, Einschätzung des Schweregrads und Behandlungen. Diabetes Care 2010;33:2285-2293.
- Dyke PJ, Albers JW, Andersen H, et al. Diabetic polyneuropathies: Update zu Forschungsdefinition, diagnostischen Kriterien und Einschätzung des Schweregrads. Diabetes Metab Res Rev 2011;27:620-628.
- Freeman R. Not all neuropathy is diabetes is of diabetic etiology: Differentialdiagnose der diabetischen Neuropathie. Curr Diabe Rep 2009;9:423-431.
- Balducci S, Iacobellis G, Parisi L, et al. Exercise training can modify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006;20:216-223.
- Bril V, England J, Franklin GM, et al. Evidenzbasierte Leitlinie: Behandlung der schmerzhaften diabetischen Neuropathie. Bericht der American Academy of Neurology, der American Association of Neuromuscular and Electrodiagnostic Medicine, und der American Academy of Physical Medicine and Rehabilitation. Neurology 2011;76:1758-1765.
- Dowell D, Haegerich TM, Chou R. CDC Guideline for prescribing opioids for chronic pain – United States 2016. MMWR Recomm Rep 2016;65:1-49.
- Tesfaye S, Wilhelm S, Lledo A, et al. Duloxetine and pregabalin: High-dose monotherapy or their combination? Die „COMBO-DN-Studie“ – eine multinationale, randomisierte, doppelblinde, Parallelgruppenstudie bei Patienten mit diabetischen peripheren neuropathischen Schmerzen. Pain 2013;154:2616-2625.
- Ahn AC, Bennani T, Freeman R, et al. Two styles of acupuncture for treating painful diabetic neuropathy – a pilot randomized control trial. Acupunct Med 2007;25:11-17.
- Garrow A, Xing M, Vere J, et al. Role of acupuncture in the management of diabetic painful neuropathy (DPN): A pilot RCT. Acupunct Med 2014;32:242-249.
- Ziegler D, Nowak H, Kempler P, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: A meta-analysis. Diabet Med 2004;21:114-121.
- Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: The NATHAN 1 trial. Diabetes Care 2011;34:2054-2060.
- Kuwabara S, Ogawara K, Harrori T, et al. The acute effects of glycemic control on axonal excitability in human diabetic nerves. Intern Med 2002;41:360-365.
- Peltier A, Goutman SA, Callaghan BC. Painful diabetic neuropathy. BMJ 2014;348:g1799.
- Soykan I, Sivri B, Sarosiek I, et al. Demographie, klinische Charakteristika, psychologische und Missbrauchsprofile, Behandlung und langfristige Nachsorge von Patienten mit Gastroparese. Dig Dis Sci 1998;43:2398-2404.
- Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms, and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9:5-12.
- Shin AS, Camilleri M. Diagnostic assessment of diabetic gastroparesis. Diabetes 2013;62:2667-2673.
- Hasler WL, Wilson L, Parkman HP, Lee L. Importance of abdominal pain as a symptom in gastroparesis: Beziehung zu klinischen Faktoren, Krankheitsschwere, Lebensqualität, Magenverhaltung und Medikamenteneinsatz. Gastroenterology 2010;138. doi: 10.1016/S0016-5085(10)62131-2.
- Choung RS, Locke GR 3rd, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107:82-88.
- Maleki D, Locke GR III, Camilleri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-2816.
- Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: Eine bevölkerungsbezogene Erhebung bei 15.000 Erwachsenen. Arch Intern Med 2001;161:1989-1996.
- Jones KL, Russo A, Berry MK, et al. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002;113:449-455.
- Gaber AO, Hathaway DK, Abell T, et al. Improved autonomic and gastric function in pancreas-kidney vs kidney-alone transplantation contributes to quality of life. Transplant Proc 1994;26:515-516.
- Punkkinen J, Färkkilä M, Mätzke S, et al. Upper abdominal symptoms in patients with Type 1 diabetes: Kein Zusammenhang mit Beeinträchtigung der Magenentleerung durch autonome Neuropathie. Diabet Med 2008;25:570-577.
- Schvarcz E, Palmer M, Aman J, et al. Physiological hyperglycemia slows gastric emptying in normal subjects and patients with insulin-dependent diabetes mellitus. Gastroenterology 1997;113:60-66.
- Miller G, Palmer KR, Smith B, et al. Smoking delays gastric emptying of solids. Gut 1989;30:50-53.
- Rao AS, Camilleri M. Review article: Metoclopramid und tardive Dyskinesie. Aliment Pharmacol Ther 2010;31:11-19.
- Patterson D, Abell T, Rothstein R, et al. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999;94:1230-1234.
- Arts J, Holvoet L, Caenepeel P, et al. Clinical trial: Eine randomisiert-kontrollierte Crossover-Studie zur intrapylorischen Injektion von Botulinumtoxin bei Gastroparese. Aliment Pharmacol Ther 2007;26:1251-1258.
- Friedenberg FK, Palit A, Parkman HP, et al. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008;103:416-423.
- Humanitarian Device Exemption for Enterra Device. Fed Reg 2000;65:78495-78496.
- O’Grady G, Egbuji JU, Du P, et al. High-Frequency gastric electrical stimulation for the treatment of gastroparesis: A meta-analysis. World J Surg 2009;33:1693-1701.
- Reddymasu SC, Sarosiek I, McCallum RW. Severe Gastroparesis: Medizinische Therapie oder elektrische Stimulation des Magens. Clin Gastroenterol Hepatol 2010;8:117-124.
- McCallum RW, Dusing RW, Sarosiek I, et al. Mechanisms of symptomatic improvement after gastric electrical stimulation in gastroparetic patients. Neurogastroenterol Motil 2010;22:161-167.
- Douloumpakas I, Pyrpasopoulou A, Triantafyllou A, et al. Prevalence of musculoskeletal disorders in patients with type 2 diabetes mellitus: Eine Pilotstudie. Hippokratia 2007;11:216-218.
- Rosenbloom AL, Silverstein JH, Lezotte DC. Eingeschränkte Gelenkbeweglichkeit bei Diabetes mellitus im Kindesalter deutet auf ein erhöhtes Risiko für mikrovaskuläre Erkrankungen hin. N Engl J Med 1981;305;191-194.
- Lister DM, Graham-Brown RAC, Burden AC. Auflösung der diabetischen Cheiroarthropathie. Br Med J 1986;293:1537.