- Was ist Säure?
- Was ist der pH-Wert?
- Warum ist der Säuregehalt wichtig?
- Symptome eines zu niedrigen pH-Werts (das Substrat ist zu sauer)
- Symptome eines zu hohen pH-Wertes (Substrat ist zu alkalisch)
- Was bestimmt den pH-Wert?
- Messung des pH-Wertes
- Probenentnahme
- Die richtigen pH-Werte für jedes Medium
- Korrektur des pH-Wertes
Was ist Säure?
Säure ist für das Leben auf der Erde unerlässlich. Der Säuregehalt bestimmt oft die Eigenschaften, die Qualität, die Aufnahmefähigkeit und die Löslichkeit vieler Stoffe. So funktionieren Enzyme, die für fast alle biologischen Vorgänge in Organismen verantwortlich sind, aber nur mit dem richtigen Säuregrad. Eine kleine Schwankung des Säuregehalts im Blut ist tödlich.
Was ist der pH-Wert?
Der pH-Wert (pondus Hydrogenii) gibt an, wie sauer oder alkalisch eine Lösung ist. Der pH-Wert schwankt normalerweise zwischen 0 und 14. Eine Lösung mit einem pH-Wert zwischen 0 und 7 ist sauer und eine zwischen 7 und 14 ist alkalisch. Essig und Cola haben einen pH-Wert von weniger als 3. Soda und Seife haben einen pH-Wert von über 8. Ein pH-Wert von 7 gilt als neutral. Reines Wasser hat bei Raumtemperatur einen pH-Wert von 7. Der pH-Wert von Leitungswasser ist im Allgemeinen etwas höher, weil es Kalzium enthält.
Viele natürliche Umgebungen wie unsere Haut, Pflanzensubstrate und Nährböden sind leicht sauer und haben einen pH-Wert zwischen 5 und 6,5. Wenn wir uns die Dinge ansehen, die Menschen mögen, stellen wir fest, dass es sich im Allgemeinen um leicht saure oder neutrale Substanzen wie Wasser handelt. Auch Pflanzen bevorzugen leicht saure Stoffe. Ein pH-Wert von etwa 5,5 kommt in der Natur so häufig vor, dass einige Pflanzenexperten diesen Wert als „neutral“ bezeichnen.
Warum ist der Säuregehalt wichtig?
Der Säuregehalt hat einen erheblichen Einfluss auf die Aufnahmefähigkeit und Löslichkeit einer Reihe von Nahrungsbestandteilen (siehe Abbildung 1).
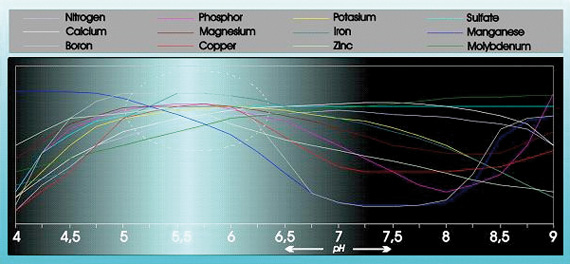
Abbildung 1
Außerdem hat der Säuregehalt einen erheblichen Einfluss auf die Struktur, den Abbau organischer Substanzen und das Mikroleben im Boden. Der pH-Wert beeinflusst auch die Art und Weise, wie Nahrungsbestandteile, Schwermetalle, Pestizide und andere Mikroorganismen aus dem Boden ausgeschwemmt werden.
Ein zu niedriger oder zu hoher pH-Wert kann sich nachteilig auf Ihre Pflanzen auswirken, daher ist es wichtig, ihn richtig einzustellen. Aber woher weiß man, wann der pH-Wert falsch ist? Aus Erfahrung! Um Ihnen zu helfen, haben wir einige der Symptome zusammengestellt, die Sie beobachten können:
Symptome eines zu niedrigen pH-Werts (das Substrat ist zu sauer)
- Die meisten Nährstoffe lassen sich leicht auflösen, was zu einem Überschuss an Mangan, Aluminium und Eisen führen kann;
- Phosphor-, Kalium-, Magnesium- und Molybdänmangel kann durch übermäßiges Spülen verursacht werden;
- Magnesiummangel, besonders in kalten Substraten;
- Der Boden ist im Allgemeinen arm;
- Das Bodenleben wird gehemmt.
Symptome eines zu hohen pH-Wertes (Substrat ist zu alkalisch)
- Die meisten Nährstoffe lösen sich schlechter auf, wodurch Kalzium-, Eisen- und Phosphatverbindungen ausfallen;
- Verringerte Aufnahme vor allem von Mangan, Phosphat und Eisen, aber auch von Kupfer, Zink und Bor. Dies führt zu Mangelerscheinungen, insbesondere bei nassen, kalten Kultursubstraten.
- In sandigen Böden nimmt der Abbau organischer Substanzen bei hohem pH-Wert erheblich zu.
Was bestimmt den pH-Wert?
Einer der wichtigsten Faktoren, die den pH-Wert in einer Lösung oder im Substrat bestimmen, ist die Pufferkapazität. Die Pufferkapazität bedeutet in diesem Fall, dass eine Art Gleichgewicht vorhanden ist, das sich ständig wiederherstellt. Gibt man zum Beispiel einen Tropfen Säure in 1 Liter Leitungswasser, das einen pH-Wert von 7 hat, so hat dies kaum Einfluss auf den Säuregehalt. Wenn man jedoch einen Tropfen Säure in 1 Liter entmineralisiertes Wasser (Batteriewasser) gibt, sinkt der pH-Wert sofort drastisch. Das liegt daran, dass Leitungswasser Bikarbonat enthält, entmineralisiertes Wasser dagegen nicht. Bicarbonat ist die wichtigste Puffersubstanz für pH-Werte zwischen 5,5 und 7,5 im Wasser.
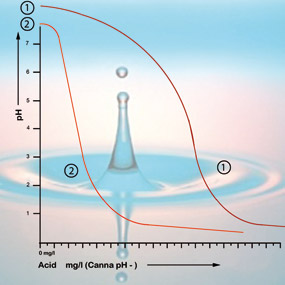 Bicarbonat bindet sich an die Säure in der Lösung, die Kohlendioxid in die Atmosphäre abgibt. Auf diese Weise wird die Säure neutralisiert, und die Veränderungen des Säuregehalts sind nur geringfügig, solange noch Bikarbonat vorhanden ist.
Bicarbonat bindet sich an die Säure in der Lösung, die Kohlendioxid in die Atmosphäre abgibt. Auf diese Weise wird die Säure neutralisiert, und die Veränderungen des Säuregehalts sind nur geringfügig, solange noch Bikarbonat vorhanden ist.
Bei einem pH-Wert von 5,3 ist das gesamte Bikarbonat verbraucht, und die Lösung hat keine Puffer mehr. Der pH-Wert ist nun instabil und ändert sich sofort, wenn Säure zugegeben wird (siehe Abbildung 2). Die Säuremenge, die benötigt wird, um eine Futterlösung auf den richtigen Säuregrad zu bringen, kann daher anhand des Bicarbonatgehalts berechnet werden. Der Bikarbonatgehalt von Leitungswasser wird in der Regel von den Wasserwerken in Milligramm pro Liter angegeben.
Die Pufferkapazität und der Säuregehalt des Substrats hängen von dessen Zusammensetzung und Frische ab. Das Vorhandensein von organischem Material, Kalzium und Bikarbonat bestimmen im Allgemeinen den pH-Wert. Lehm enthält immer Kalziumkarbonat und hat einen relativ hohen pH-Wert, der schwer zu ändern ist, während Torf und Sandböden sauer sind.
Auch die Pflanze selbst hat großen Einfluss auf den Säuregrad. Je nach Entwicklungsstadium der Pflanze, dem Nahrungsangebot, den Temperaturunterschieden im Wurzelbereich und der Lichtintensität scheiden die Wurzeln entweder saure oder alkalische Unterstände aus. Sie sehen also, warum der pH-Wert der Wurzelumgebung ständig schwanken kann. Ein ausgeklügeltes Nährstoffgleichgewicht während der verschiedenen Entwicklungsphasen hält den pH-Wert in der Wurzelumgebung innerhalb akzeptabler Grenzen.
Mikroleben, CO2-Gehalt und Algenwachstum können sich ebenfalls auf den Säuregehalt der Wurzelumgebung und des Nährstofftanks auswirken.
Messung des pH-Wertes

Es ist recht einfach, den pH-Wert zu messen – man benötigt einige pH-Indikatoren wie Lackmuspapier oder ein pH-Test-Set. Diese sind relativ billig, sind aber nicht immer genau und können manchmal um 1 bis 2 pH-Einheiten abweichen. Alle pH-Meter sind im Allgemeinen teurer und die Genauigkeit hängt von der Art des Messgeräts und der regelmäßigen Kalibrierung mit Kalibrierungsflüssigkeit ab.
Probenentnahme

Der pH-Wert des Wassers, das zur Bewässerung der Pflanzen verwendet wird, ist wichtig, aber der Säuregehalt um die Wurzeln herum ist entscheidend. Bei der Messung des pH-Wertes ist es also sehr wichtig, die Probe richtig zu entnehmen, um gute Ergebnisse zu erhalten. Die Probe hat den Säuregrad in der Wurzelumgebung.
In einem Kreislaufsystem ist es einfach, Proben zu nehmen und den pH-Wert zu messen, indem man einfach die umgewälzte Nährlösung misst.
In Substratsystemen ohne Kreislauf wird die Nährlösung an mehreren Stellen aus dem Substrat (Steinwolle, Agroschaum usw.) entnommen. Seit Jahr und Tag diskutieren die Fachleute über die Frage, an welchen Stellen die Proben entnommen werden sollen. Wir empfehlen, genau wie eine Reihe renommierter Labors, Proben an den Stellen zu nehmen, an denen sich die Wurzeln befinden, d. h. unter und um die Tropfstelle herum. Nehmen Sie kleine Proben an möglichst vielen Stellen. Entnehmen Sie immer alle Proben zur gleichen Zeit und vorzugsweise nach der zweiten Tröpfchenfütterung während des Licht-Tages-Zyklus.
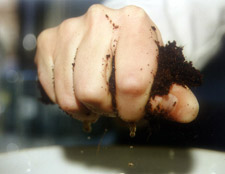 Bei Erde, Kokos- und Torfsubstraten nehmen Sie einfach eine kleine Menge Substrat von mehreren Stellen.
Bei Erde, Kokos- und Torfsubstraten nehmen Sie einfach eine kleine Menge Substrat von mehreren Stellen.
Sie können den Säuregehalt Ihrer Probe am besten mit der „1:1,5 Volumenextrakt“-Methode messen. Das kannst du leicht selbst machen, indem du das Kultursubstrat so nass machst, dass das Wasser durch deine Finger läuft, wenn du es kräftig knetest und drückst (Foto 1). Verwenden Sie z. B. einen 250-ml-Messbecher. Füllen Sie den Messbecher bis zu 150 ml mit entmineralisiertem Wasser. Füge Nährboden hinzu, bis das Volumen 250 ml beträgt (Foto 2). Schütteln Sie es gut und lassen Sie es einige Stunden stehen. Dann filtern Sie es und messen den pH-Wert.

Die richtigen pH-Werte für jedes Medium
Bei der Kultivierung im Substrat sind pH-Werte zwischen 5,0 und 6,4 für das Wurzelmilieu in Ordnung. Etwas höhere oder niedrigere Werte haben keine nachteiligen Auswirkungen. Unmittelbare negative Auswirkungen sind nur bei Werten unter 4 und über 8 zu beobachten, ein pH-Wert unter 4 führt oft zu einer sofortigen Schädigung der Wurzeln. Außerdem werden Schwermetalle, einschließlich Mangan und Eisen, so gut absorbiert, dass sie die Pflanze vergiften können (Nekrose). Werte zwischen 7 und 8 sind nicht unmittelbar schädlich für die Pflanze. Nährstoffe wie Eisen, Phosphat und Mangan sind dann weniger verfügbar, was langfristig zu Mangelerscheinungen (Chlorose und Entwicklungsstörungen) führt.
Korrektur des pH-Wertes
 Wenn der Säuregehalt in der Wurzelumgebung zwischen 5 und 6,4 liegt, ist der pH-Wert Ihrer Kulturumgebung in Ordnung und Sie müssen keine Korrekturmaßnahmen ergreifen. Versuchen Sie, den pH-Wert nicht zu korrigieren, wenn es nicht wirklich notwendig ist. Das würde eher schaden als nützen, denn die Pflanze mag ihre Ruhe. Wichtiger ist es, zu beobachten, wie sich der Säuregehalt über einen längeren Zeitraum verändert. Sinkt der Wert unter pH 5 oder steigt er über pH 6,4, dann ist es ratsam, allmählich mit einer Anpassung zu beginnen.
Wenn der Säuregehalt in der Wurzelumgebung zwischen 5 und 6,4 liegt, ist der pH-Wert Ihrer Kulturumgebung in Ordnung und Sie müssen keine Korrekturmaßnahmen ergreifen. Versuchen Sie, den pH-Wert nicht zu korrigieren, wenn es nicht wirklich notwendig ist. Das würde eher schaden als nützen, denn die Pflanze mag ihre Ruhe. Wichtiger ist es, zu beobachten, wie sich der Säuregehalt über einen längeren Zeitraum verändert. Sinkt der Wert unter pH 5 oder steigt er über pH 6,4, dann ist es ratsam, allmählich mit einer Anpassung zu beginnen.
Die Korrektur des Säuregehalts erfolgt am einfachsten durch eine Absenkung des Säuregehalts der Nährlösung mit Salpetersäure während der Wachstumsphase und Phosphorsäure während der Blütephase bzw. durch eine Anhebung mit Kalilauge, Kaliumbicarbonat und CANNA RHIZOTONIC. Achten Sie darauf, dass der pH-Wert der verwendeten Lösung nicht zu weit unter 5,0 sinkt. Beim Anbau in Steinwolle werden die Fasern geschädigt, so dass bei sehr niedrigen pH-Werten viel alkalisches Material freigesetzt wird. Außerdem ist der pH-Wert wegen des fehlenden Bikarbonats schwieriger zu kontrollieren
Ein hoher pH-Wert in der Wurzelumgebung kann auch durch Bikarbonat verursacht werden, das sich gebildet hat. Um hier Abhilfe zu schaffen, halten Sie eine 20%ige Drainage aufrecht oder spülen Sie mit einer saureren Lösung durch.
Es ist nützlich, die pH-Messungen sowohl von der zugegebenen Lösung als auch von der Nährlösung im Substrat zu notieren. So erhält man einen guten Überblick über den Verlauf des pH-Wertes und die Wirkung der getroffenen Maßnahmen.
- Eiweißspaltende Enzyme benötigen ein saures Milieu (Magensaft) und kohlenhydratspaltende Enzyme ein alkalisches Milieu (Speichel).
- Der Säuregrad einer Lösung wird durch das Verhältnis von Wasserstoffionen (= sauer) und Hydroxidionen (= alkalisch) bestimmt.
- Es kann zu Engpässen kommen, weil die Pflanze Protonen ausscheiden muss, um diese Moleküle aufnehmen zu können. Ein Kultursubstrat mit einem niedrigen pH-Wert hat bereits eine sehr große Menge an Protonen. Diese Elemente werden auch ausgespült, weil die Protonen die Moleküle aus dem Medium im Substrat abstoßen.
- Bikarbonat ist die Substanz, die in Verbindung mit Kalzium für Kesselstein verantwortlich ist. In Kombination mit Natrium wird Bicarbonat in Medikamenten gegen überschüssige Magensäure eingesetzt (Alka-seltzer).
- Einige Labore arbeiten auch mit der Bicarbonathärte. Um diese in mg/l Bikarbonat umzurechnen, muss man die Bikarbonathärte mit 21,8 multiplizieren.
Zum Beispiel: Die Bikarbonathärte beträgt 11, dann enthält 1 Liter Wasser (11 x 21.8=) 240 mg/Liter Bikarbonat. -
Sandiger Boden: Grasboden pH 4.6 … 5.2 Bauland pH 5.0 … 5.6 Ton: Meereston pH 6,0 … 7,2 Flusston pH 6,2 … 6,4 Torf: unbearbeitet pH 4.0 - Bei starkem Algenwachstum steigt der pH-Wert, weil Kohlendioxid aus der Lösung entfernt wird. Bakterien können bestimmte Formen von Stickstoff so umwandeln, dass sie eine säuernde Wirkung haben. Große Mengen an CO2 in der Luft erzeugen mehr Kohlendioxid in der Nährlösung und umgekehrt.
- Verwenden Sie Soda nur in kleinen Mengen, da es Natrium enthält und Pflanzen nur eine sehr geringe Menge Natrium benötigen. Denken Sie daran, dass hohe Konzentrationen von Natrium die Pflanze schädigen.
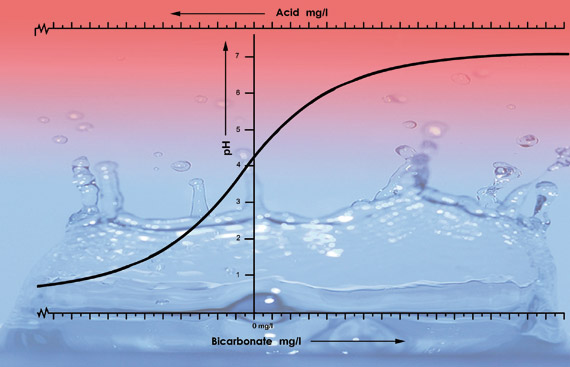
Illustration der pH-Werte von Leitungswasser aus verschiedenen Gebieten mit unterschiedlichem Bikarbonatgehalt. Zu jeder 100-Liter-Probe jedes Wassertyps wurden 33 ml Salpetersäure (38 %) hinzugefügt. Die pH-Kurve fällt nach pH 5,3 schneller ab, da bei diesem Wassertyp die Säure das gesamte Bikarbonat neutralisiert. Unterhalb von pH 5,3 nimmt der Säuregehalt schnell zu.
In Kreislaufsystemen kann der pH-Wert stärker schwanken als in Durchlaufsystemen. Das Gleiche gilt für den EC, ppm-Wert. Wenn Sie mehr über EC, pH und ppm erfahren möchten, empfehlen wir Ihnen, unseren Artikel Alles über EC, pH und ppm mit AQUA zu lesen.