History
In het begin van de 20e eeuw ontdekten onderzoekers dat de opname van grote hoeveelheden rauw eiwit in het dieet van ratten symptomen van toxiciteit veroorzaakte. In 1926 noemde Boas deze toxiciteitssymptomen het ei-witletselsyndroom. De belangrijkste bevindingen waren ernstige dermatitis, haaruitval en gebrek aan spiercoördinatie. Boas merkte ook op dat gist, lever en verschillende andere voedingsmiddelen een stof bevatten die ratten beschermde tegen het eiwitschuursyndroom. Een zoektocht naar deze beschermende factor leidde in 1936 tot de ontdekking van biotine.
De biochemische basis voor het ei-wit letselsyndroom werd snel opgehelderd toen rauw eiwit de glycoproteïne avidine bleek te bevatten, die een opmerkelijke affiniteit heeft voor biotine. De biotine-avidinebinding is in wezen onomkeerbaar; als gevolg daarvan komt biotine niet vrij uit voedsel en gaat het biotine-avidinecomplex verloren in de feces. De laatste stap in de oplossing van het mysterie van het eiwitschadesyndroom was de demonstratie dat het syndroom kon worden voorkomen door het eiwit te verhitten, een proces dat avidine denatureert en zijn affiniteit voor biotine vernietigt.
Structuur
Biotine is een bicyclisch molecuul dat bestaat uit een ureido-ring die versmolten is met een tetrahydrothiofeenring.
De ureido-ring is betrokken bij de hoge affiniteit van biotine voor avidine, een glycoproteïne dat in eiwit wordt aangetroffen. Aan een van de 2 koolstofatomen van de tetrahydrothiofeenring is een valerinezuursubstituent gehecht. Via deze carboxylgroep is biotine covalent verbonden met de β-amino groep van lysine in 5 carboxylases die een cruciale rol spelen in het intermediaire metabolisme.
FUNCTIES VAN BIOTIN
Naast de bekende rol van biotine als cofactor in carboxyleringsreacties, hebben recente studies aangetoond dat biotine een belangrijke rol speelt in de regulering van genexpressie en immuunfunctie.
Biotine-afhankelijke carboxyleringsreacties
Biotine fungeert als co-enzym in carboxyleringsreacties waarbij lipiden-, glucose- en aminozuurmetabolisme betrokken zijn. Er zijn 5 biotine-afhankelijke carboxylases, die elk in een inactieve apovorm bestaan. Het enzym holocarboxylase synthetase (HCLS ) katalyseert de toevoeging van biotine (biotinylering) aan de inactieve apovorm, wat leidt tot de vorming van het actieve carboxylase. In alle 5 carboxylases fungeert biotine als een co-enzym of prosthetische groep die dient als drager voor CO2 in een meerstapsreactie.
De vijf biotine-afhankelijke carboxylases en hun functies worden hieronder kort beschreven:
Pyruvaat carboxylase (PC) katalyseert de vorming van oxaloacetaat uit pyruvaat, een stap die belangrijk is in de TCA-cyclus, gluconeogenese en lipogenese; gebrek aan deze functie kan leiden tot hypoglykemie, ketose en melkzuurocidose.
Propionyl-CoA carboxylase (PCC) katalyseert de omzetting van propionyl-CoA in methylmalonyl-CoA, dat op zijn beurt isomeriseert tot succinyl-CoA, en in de TCA-cyclus (Kreb’s) terechtkomt. PCC is belangrijk voor het metabolisme van vetzuren met oneven ketens en de aminozuren isoleucine, valine, methionine en threonine. Gebrek aan deze enzymfunctie kan leiden tot propionzuurremie. Het PCC-niveau in lymfocyten is een gevoelige indicator voor de biotinestatus.
3-Methylcrotonoyl-CoA-carboxylase (MCC) is betrokken bij het katabolisme van het vertakte-keten-aminozuur leucine. Gebrek aan biotine kan leiden tot het omleiden van leucinekataboliseringsproducten naar een alternatieve katabole route die leidt tot de productie van 3-hydoxyisovalerinezuur dat vervolgens wordt uitgescheiden in de urine.
Acetyl-CoA carboxylase I (ACC I) katalyseert de omzetting van acetyl-CoA in malonyl-CoA, in het cytosol, een stap die belangrijk is bij de lipidensynthese.
Acetyl-CoA carboxylase II (ACC II), katalyseert een identieke reactie in de mitochondriën; het resulterende malonyl-CoA speelt een regulerende rol bij de vetzuuroxidatie.
ACC I is een cytosolisch enzym; de overige carboxylases bevinden zich in de mitochondria.
Clinische manifestaties van biotinetekort kunnen ook optreden als gevolg van genetische aandoeningen die een tekort aan het enzym holocarboxylase synthetase of tekorten aan de afzonderlijke carboxylase-enzymen veroorzaken.
Genexpressie
Studies hebben aangetoond dat biotinylering van histon-eiwitten een rol kan spelen bij de genexpressie. In menselijke histonen zijn meerdere plaatsen geïdentificeerd die zich aan biotine binden. Biotine kan ook via andere mechanismen de genexpressie beïnvloeden. In menselijke cellen zijn een paar duizend biotine-afhankelijke genen bekend. Sommige van de genen die door biotine beïnvloed worden, coderen voor enzymen die betrokken zijn bij het glucosemetabolisme (bv. glucokinase), cytokines zoals interleukine-2 en de insulinereceptor.
Immuunfunctie
Studies wijzen op een rol voor biotine bij de productie van antilichamen, de werking van macrofagen, de differentiatie van T- en B-lymfocyten, en de normale werking van natuurlijke killercellen. Terugkerende infecties, vooral schimmelinfecties, komen vaak voor bij patiënten met een biotinedeficiëntie.
Rol van biotine bij hooggedoseerde biotine-responsieve neurologische aandoeningen
Biotine-thiamine-responsieve basale ganglia ziekte (BTBGD) is een zeldzame neurologische aandoening die zich kan presenteren met aanvallen en encefalopathie die kan leiden tot coma en de dood. Hoge doses biotine (5-10 mg/kg/dag) zijn gebruikt om deze aandoening met succes te behandelen, maar het werkingsmechanisme is onbekend.
Nu is gebleken dat een behandeling met hoge doses biotine (100-300 mg/dag) de symptomen verbetert bij een subgroep van patiënten met multiple sclerose. Men denkt dat de verbetering van de neurologische symptomen te maken kan hebben met een verbeterde myeline productie als gevolg van het effect van hoge doses biotine op de synthese van lange-keten vetzuren.
Rol van biotine bij mensen met haar-, huid- en nagelaandoeningen
Biotinesupplementen worden veel gebruikt door mensen die gezonder haar, een gezondere huid en gezondere nagels hopen te krijgen. Er is echter beperkt bewijs voor de werkzaamheid van biotine voor dit gebruik. Biotine in hoge doses is nuttig gebleken bij twee zeldzame aandoeningen: familiair onkambaar haar syndroom en broze nagels syndroom. In een studie van 541 vrouwen met haarverlies werd bij 38% van de patiënten een laag biotinegehalte in het serum vastgesteld. De auteur concludeert dat de etiologie van haaruitval multifactorieel is en dat biotine supplementen kunnen worden overwogen als biotine tekort is aangetoond en andere oorzaken zijn uitgesloten.
Bronnen van biotine
Biotine is aanwezig in een grote verscheidenheid van voedingsmiddelen (vlees, zuivel, groenten, zaden en noten) en wordt ook geproduceerd door darmbacteriën. Bovendien kan een aanzienlijk deel van de mensen biotine bevattende voedingssupplementen consumeren.
Biotinefysiologie
Geïntegreerde biotine is aanwezig in vrije en eiwit-gebonden vormen. Eiwitgebonden vormen worden verteerd door gastro-intestinale proteasen en peptidasen om biocytine en biotine-oligopeptiden te vormen. Vrije biotine wordt vrijgemaakt uit biocytine en biotine-oligopeptiden door de werking van intestinale biotinidase. Vrije biotine wordt vervolgens in de dunne darm geabsorbeerd via een Na+-afhankelijk, carrier-gemedieerd mechanisme, dat ook twee andere voedingsstoffen, pantotheenzuur en lipoaat, transporteert en daarom bekend staat als de natrium-afhankelijke multivitaminetransporter (SMVT). Het menselijke SMVT-gen bevindt zich op chromosoom 2p23. De activiteit van SMVT wordt gereguleerd door het biotinegehalte; de activiteit wordt verhoogd bij een biotinetekort en verlaagd bij een teveel aan biotine. Bacterieel gesynthetiseerde biotine is aanwezig in de ongebonden vorm en wordt in de dikke darm geabsorbeerd via een soortgelijk carrier-gemedieerd mechanisme. De totale dagelijkse biotine-afgifte in de urine en de ontlasting is groter dan de biotine-inname via de voeding, wat wijst op de belangrijke rol van de darmflora als bron van biotine.
Eenmaal geabsorbeerd, wordt biotine beschikbaar voor verschillende biotinyleringsprocessen. Biotine bindt zich aan elk van de 5 apocarboxylasen om de overeenkomstige holocarboxylase te vormen (zie de afbeelding hieronder) via de werking van het enzym holocarboxylase synthetase.
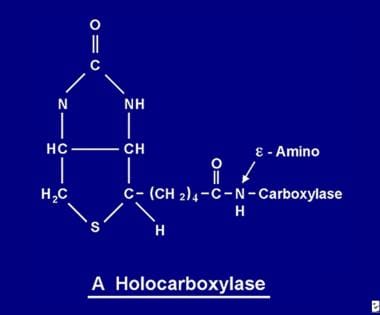 De biotinemolecule wordt aan het eiwit gebonden door een peptidebinding aan een e-aminogroep van een apocarboxylase om een holocarboxylase te vormen.
De biotinemolecule wordt aan het eiwit gebonden door een peptidebinding aan een e-aminogroep van een apocarboxylase om een holocarboxylase te vormen. Recyclage van biotine
Nadat het holocarboxylase-enzym verschillende carboxyleringen heeft uitgevoerd, wordt het opgevangen door cellulaire lysosomen. In de lysosomen breken verschillende proteolytische enzymen het holocarboxylase af tot biocytine, dat op zijn beurt door het enzym biotinidase wordt gehydrolyseerd tot biotine en lysine. Vrije biotine is dan beschikbaar om in een apocarboxylase te worden ingebracht om een nieuw holocarboxylase-molecuul te vormen. Dit recyclageproces is niet 100% efficiënt. Daardoor ontsnappen kleine hoeveelheden vrije biotine (en wat biocytine) aan de cyclus en gaan verloren in de ontlasting en de urine. Daarom moet biotine aan de darm worden toegediend, om de door het lichaam verloren biotine aan te vullen. De stappen die betrokken zijn bij de recycling van biotine – het binnenkomen in de darm, de absorptie, de opname in holocarboxylasen, die op hun beurt worden afgebroken om vrije biotine vrij te maken – vormen de biotine-cyclus en worden weergegeven in de onderstaande afbeelding.
Het enzym biotinidase is essentieel voor de biotine recycling en personen met biotinidase deficiëntie zullen zich daarom presenteren met tekenen en symptomen van biotine deficiëntie.
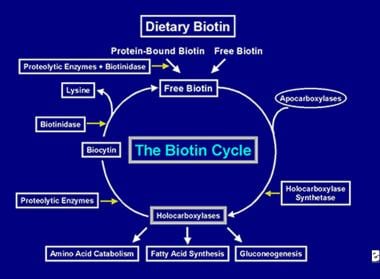 Afbeelding van de stroom van biotine in de biotine-cyclus.
Afbeelding van de stroom van biotine in de biotine-cyclus. VOORZIENINGEN VAN BIOTINETEKORT
Zoals eerder vermeld is biotine ruim voorhanden in voedingsmiddelen, wordt het ook geproduceerd door de darmflora en wordt het uitgebreid gerecycleerd in het lichaam met behulp van het enzym biotinidase; vandaar dat biotinetekort bij gezonde mensen die een normaal dieet volgen zeldzaam is. Omstandigheden die kunnen leiden tot biotinegebrek worden hieronder beschreven:
Excessieve consumptie van rauw eiwit: Avidine in rauw eiwit heeft een hoge affiniteit voor biotine, waardoor het niet beschikbaar is voor absorptie. Hitte vernietigt de avidine, dus wie gekookte eieren eet loopt geen risico op een biotinetekort. Rauw eiwit leidt alleen tot biotinegebrek als het in excessieve hoeveelheden wordt gegeten (misschien een dozijn of meer per dag).
Totale parenterale voeding zonder biotine-suppletie: Er zijn verschillende gevallen gemeld van biotinedeficiëntie bij patiënten die langdurige totale parenterale voeding (TPN) therapie kregen zonder toegevoegde biotine. Daarom moeten alle patiënten die TPN krijgen ook biotine krijgen in de aanbevolen dagelijkse dosis, vooral als TPN-therapie naar verwachting langer dan een week zal duren. Alle ziekenhuisapotheken bevatten momenteel biotine in TPN-preparaten.
Gebruik van zuigelingenvoeding met onvoldoende biotine: Er zijn biotinedeficiënties gemeld bij zuigelingen die hypoallergene zuigelingenvoeding kregen.
Chronische anticonvulsieve therapie: Langdurig gebruik van de anticonvulsiva fenobarbital, fenytoïne, primidon, en carbamazepine zijn in verband gebracht met biotinegebrek. Mogelijke mechanismen zijn onder meer remming van de biotine-opname door het darmslijmvlies, versneld biotinekatabolisme en verminderde renale reabsorptie van biotine. Daarom wordt aangeraden biotinesupplementen toe te dienen aan patiënten die worden behandeld met anticonvulsiva die in verband worden gebracht met biotinetekort.
Duurzame orale antibioticatherapie: Langdurig gebruik van orale antibiotica is in verband gebracht met biotinedeficiëntie. Er wordt verondersteld dat remming van de darmflora die biotine produceert, de basis is voor biotinetekort. Een ander mogelijk mechanisme is antibiotica-geïnduceerde overgroei van bacteriën die biotine verbruiken.
Roken en chronisch alcoholisme: Studies hebben aangetoond dat roken het biotine katabolisme kan versnellen, vooral bij vrouwen. Chronisch alcoholisme kan leiden tot intestinale malabsorptie van biotine.
Kortedarmsyndroom en inflammatoire darmziekten: Personen met het kortedarmsyndroom en inflammatoire darmziekten lopen ook risico op biotinetekort als gevolg van intestinale malabsorptie van biotine.
Marginale biotinedeficiëntie tijdens zwangerschap en borstvoeding: Recente studies hebben verlaagde biotinespiegels aangetoond bij een aanzienlijk deel van de zwangere vrouwen en vrouwen die borstvoeding geven. Er bestaat bezorgdheid dat marginale biotinedeficiëntie tijdens de zwangerschap teratogeen kan zijn en sommige deskundigen hebben zwangere vrouwen een hogere biotine-inname aanbevolen.
Zekere aangeboren afwijkingen van het biotinemetabolisme kunnen ook leiden tot biotinetekort.
Biotinidase-deficiëntie (BTD) erft autosomaal recessief over en komt voor bij ongeveer 1 op 60.000 levendgeborenen; naar schatting 1 op 120 personen is heterozygoot voor de aandoening. Bij homozygote personen zijn de biotinidasespiegels < 30% normaal, wat leidt tot biotinedeficiëntie als gevolg van onvoldoende vrije biotine-afgifte door verminderde biotine-recycling. Symptomen van BTD ontwikkelen zich meestal tussen 1 week en 1 jaar oud. De ernst van de enzymdeficiëntie kan variëren. Bij mensen met een ernstige biotinidasedeficiëntie zijn de BTD-spiegels minder dan 10% normaal, terwijl bij mensen met een gedeeltelijke biotinidasedeficiëntie de enzymspiegels tussen 10-30% normaal zijn. In de VS en veel andere landen wordt bij de screening van pasgeborenen ook op BTD-deficiëntie getest. Er zijn ongeveer 150 mutaties in het BTD-gen gerapporteerd die biotinidasedeficiëntie veroorzaken. Het BTD-gen bevindt zich op chromosoom 3p25. Een muismodel van biotinidase deficiëntie is ontwikkeld om verschillende aspecten van de aandoening te bestuderen.
Holocarboxylase Synthetase (HCLS) deficiëntie is ook een autosomaal recessieve aandoening en kan prenataal worden gediagnosticeerd. Zoals eerder besproken, is het enzym HCLS nodig voor de biotinylering van de apocarboxylase enzymen tot de actieve holocarboxylase vormen; daarom leidt deficiëntie tot meervoudige carboxylase deficiëntie. Zuigelingen met deze aandoening vertonen in de eerste levensmaanden acidose, hyperammonemie, hypotonie, toevallen en ontwikkelingsachterstand. Mutaties in het HCLS-gen veroorzaken HCLS-deficiëntie.
Omdat zowel biotinidase- als HCLS-deficiëntie leidt tot verlaagde niveaus van de biotine-afhankelijke carboxylases, zijn de twee aandoeningen ook wel geclassificeerd als meervoudige carboxylase-deficiëntie. Ernstige biotinidasedeficiëntie stond vroeger bekend als vroege meervoudige carboxylasedeficiëntie, partiële biotinidasedeficiëntie als late of juveniele meervoudige carboxylasedeficiëntie en HCLS-deficiëntie als neonatale of vroege meervoudige carboxylasedeficiëntie.
Zelden kunnen ook geïsoleerde tekorten van elk van de vijf individuele biotine-afhankelijke carboxylases voorkomen.
Biotinedeficiëntie als gevolg van een defect in het biotinetransport is ook beschreven.
Onafhankelijk van de etiologie van biotinedeficiëntie zijn de klinische verschijnselen vergelijkbaar. De leeftijd waarop de ziekte ontstaat, de snelheid waarmee de symptomen zich ontwikkelen en de volgorde waarin de symptomen verschijnen, kunnen echter sterk verschillen. De mechanismen die verantwoordelijk zijn voor de ontwikkeling van de verschijnselen zijn niet allemaal vastgesteld.