Co to jest zsiadanie?
W kuchni, zsiadanie jest rozbijanie emulsji lub koloidu na duże części o różnym składzie poprzez fizyko-chemiczne procesy flokulacji, kremowania i koalescencji. Zsiadanie mleka jest celowe i pożądane przy produkcji serów i tofu; niezamierzone i niepożądane przy produkcji sosów i kremów. Zsiadanie występuje naturalnie w mleku, jeśli mleko nie jest używane przez datę ważności, lub jeśli mleko pozostaje w ciepłej temperaturze.
Mleko składa się z kilku związków, głównie tłuszczu, białka i cukru. Białko w mleku jest zwykle zawieszone w roztworze koloidalnym, co oznacza, że małe cząsteczki białka pływać wokół swobodnie i niezależnie. Te pływające cząsteczki białka załamują światło i przyczyniają się (wraz z zawieszonym tłuszczem) do białego wyglądu mleka. Normalnie te cząsteczki białka odpychają się od siebie, co pozwala im unosić się w powietrzu bez zbijania się w grudki, ale kiedy zmienia się pH roztworu, mogą się przyciągać i tworzyć grudki. To właśnie dzieje się, gdy mleko się zsiada, gdy pH spada i staje się bardziej kwaśne, cząsteczki białka (kazeiny i innych) przyciągają się wzajemnie i stają się „zsiadłe”, pływające w roztworze półprzezroczystej serwatki. Ta reakcja zbrylania zachodzi szybciej w cieplejszych temperaturach niż w temperaturach zimnych.
Jakie są podukty w mleku, które pozwalają mu się zsiadać?
Mleko jest emulsją lub koloidem kulek tłuszczu masła w mieszaninie zawierającej wodę, węglowodany, minerały i białka.
Jaka jest zawartość tłuszczu w mleku?
Zgodnie z The Dairy Council, mleko pełne ma 3.9% tłuszczu (tj. zawiera 3.9g tłuszczu na 100g), mleko półtłuste ma 1.7% tłuszczu, mleko o 1% tłuszczu ma 1% tłuszczu, a mleko odtłuszczone ma 0.3% tłuszczu.
Jakie białka są zawarte w mleku?
Większość mleka wypijanego w USA pochodzi z gruczołów mlecznych krów. Główne białka znajdujące się w mleku są unikalne i nie występują w tkankach innych niż gruczoły sutkowe. Białka mleka, zwłaszcza kazeiny, mają skład aminokwasów pomocnych dla wzrostu i rozwoju młodych. Inne białka w mleku obejmują szereg enzymów, białek zaangażowanych w transport składników odżywczych, białek zaangażowanych w odporność na choroby (przeciwciała i inne), czynniki wzrostu itp. (patrz odnośnik 1). Kazeina stanowi 79,5% białek występujących w mleku krowim.
Mleko zawiera 3,3% białka całkowitego. Białka mleka zawierają wszystkie 9 niezbędnych aminokwasów wymaganych przez ludzi. Białka mleka są syntetyzowane w gruczole mlekowym, ale 60% aminokwasów użytych do budowy białek pochodzi z diety krowy. Całkowita zawartość białka mleka i skład aminokwasowy różnią się w zależności od rasy krów i genetyki poszczególnych zwierząt.(2)
Białko serwatki stanowi 19,3% białka zawartego w mleku. W mleku większości gatunków występują 3 lub 4 kazeiny; różne kazeiny są odrębnymi cząsteczkami, ale mają podobną strukturę. Wszystkie inne białka występujące w mleku są zgrupowane razem pod nazwą białek serwatkowych. Głównymi białkami serwatkowymi w mleku krowim są beta-laktoglobulina i alfa-laktalbumina.
β-Laktoglobulina jest głównym białkiem serwatkowym mleka krowiego i owczego i jest również obecna u wielu innych gatunków ssaków; godnym uwagi wyjątkiem jest człowiek.

Cząsteczka kazeiny
Rodzina pokrewnych fosfoprotein (αS1, αS2, β, κ).
Kazeina zawiera dużą liczbę reszt prolinowych, które nie wchodzą ze sobą w interakcje. Nie ma również mostków disulfidowych. W związku z tym ma stosunkowo mało struktury trzeciorzędowej. Jest stosunkowo hydrofobowa, co sprawia, że jest słabo rozpuszczalna w wodzie. Występuje w mleku w postaci zawiesiny cząstek, zwanych micelami kazeinowymi,
Kazeina zawiera dużą liczbę reszt prolinowych, które nie wchodzą w interakcje. Nie ma też mostków disulfidowych. W związku z tym ma stosunkowo mało struktury trzeciorzędowej. Jest stosunkowo hydrofobowa, co sprawia, że jest słabo rozpuszczalna w wodzie. Występuje w mleku w postaci zawiesiny cząsteczek, zwanych micelami kazeinowymi,
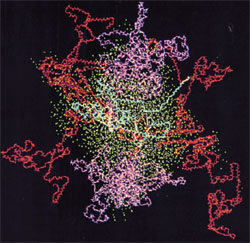
Obraz: Micela kazeinowa, kazeina kappa na niebiesko, kazeina alfa na czerwono, kazeina beta na magenta, tlen z wody na cyjan. Źródło: Kumosinski, T.F., King, G. and Farrell, H.M., Jr. (1994).Comparison of the three dimensional molecular models of bovine submicellar caseins with small-angle X-ray scattering.
Kazeiny w mleku krowim mogą zawierać różne formy, przy czym mleko krowie zazwyczaj zawiera jeden z dwóch typów kazeiny beta. w zależności od indywidualnego profilu genetycznego krowy, produkowane mleko będzie zawierało kazeiny A1-beta lub A2-beta.
Wszystkie cząsteczki kazeiny mają co najmniej jeden fosforan związany estrem. Żadne z białek serwatkowych tego nie posiada.
Punkt izoelektryczny kazeiny wynosi 4,6. Ponieważ pH mleka wynosi 6,6, kazeina ma w mleku ładunek ujemny.
Kazeiny mają bardzo nierównomierne rozłożenie ładunków wzdłuż cząsteczki, podczas gdy w głównych białkach serwatki, ładunki są bardziej równomiernie rozłożone. To odpowiada za jedną z głównych właściwości kazein w mleku, ich amfifilowy charakter. Naładowane regiony są, ogólnie rzecz biorąc, lubiące wodę lub hydrofilowe, a nienaładowane regiony wzdłuż cząsteczki są bardziej hydrofobowe lub nienawiązujące do wody. Ponieważ te regiony są nierównomiernie rozmieszczone wzdłuż cząsteczki, są one bardziej narażone.
W białkach z równomiernym rozłożeniu, hydrofilowe i hydrofobowe regiony w zasadzie znoszą się nawzajem. To właśnie z powodu amfifilowej natury cząsteczek kazeiny wyłania się jedna z najważniejszych właściwości kazeiny, micela kazeinowa. Większość kazein w mleku występuje w skomplikowanych, luźnych agregacjach zwanych micelami.
Micela kazeiny jest stabilizowana na dwa sposoby. Po pierwsze fosforan wapnia znajduje się w wysokich stężeniach w mleku i w samej miceli kazeinowej. Stężenie jest takie, że małe agregacje fosforanu tworzą. Część fosforanu może stosunkowo swobodnie przechodzić do i z miceli, a część fosforanu jest silnie związana z białkiem. Ten związany fosforan znajduje się w małych agregacjach nierozpuszczonego (koloidalnego) fosforanu wapnia. Te mają tendencję do cementu miceli razem stabilizując jego strukturę.
k-kazeina i ścinanie mleka
Inny efekt stabilizujący jest ze względu na właściwość K-kazeiny. K-kazeina ma w swojej strukturze grupę węglowodanową, która jest zestryfikowana z treoniną w białku. Ta grupa węglowodanowa zawiera pewne ujemnie naładowane grupy. W wyniku tego K-kazeina staje się bardziej hydrofilna w jednej części cząsteczki. W miceli, K-kazeina i do pewnego stopnia B-kazeina, samoczynnie lokuje się w pobliżu lub rozszerzając się do granicy wodnej miceli. Stabilizuje to micelę zapobiegając agregacji miceli poprzez odpychanie steryczne (uniemożliwiając bliskie zbliżenie między micelami kazeiny) W przypadku K-kazeiny wiązanie peptydowe między 105. i 106. aminokwasem jest podatne na hydrolizę przez enzymy proteolityczne (koagulator mikrobiologiczny lub podpuszczkę). Jest to mechanizm powstawania skrzepu (poprzez usunięcie części białka zawierającej węglowodany, a tym samym zmniejszenie stabilności sterycznej). Utrata ochrony K-kazeiny pozwala micelom kazeinowym na agregację i tworzenie spójnego skrzepu.
Aby zrozumieć, w jaki sposób podpuszczka koaguluje mleko, trzeba wiedzieć coś o białkach mleka. Większość białek mleka to kazeina i istnieją cztery główne typy cząsteczek kazeiny: alfa-s1, alfa-s2, beta i kappa. Kazeiny alfa i beta są białkami hydrofobowymi, które łatwo ulegają wytrąceniu przez wapń – normalne stężenie wapnia w mleku znacznie przewyższa to, które jest wymagane do wytrącenia tych białek. Jednakże kazeina kappa jest zupełnie inną cząsteczką – nie jest wytrącającą się pod wpływem wapnia. Kiedy kazeiny są wydzielane, samoistnie łączą się w agregaty zwane micelami, w których kazeiny alfa i beta są powstrzymywane przed wytrąceniem przez ich interakcje z kazeiną kappa. W istocie, kazeina kappa normalnie utrzymuje większość białek mleka w stanie rozpuszczalnym i zapobiega ich spontanicznej koagulacji.
Enter chymozyna
Chymozyna proteolitycznie tnie i inaktywuje kazeinę kappa, przekształcając ją w para-kappa-kazeinę i mniejsze białko zwane makropeptydem. Para-kappa-kazeina nie ma zdolności do stabilizacji struktury micelarnej i nierozpuszczalne w wapniu kazeiny wytrącają się, tworząc twaróg.
Cząsteczki kazeiny mogą być również oddzielone od serwatki przez wytrącenie kazeiny kwasem (podobne do tego, co dzieje się w żołądku, gdy mleko jest spożywane) lub przez zakłócenie struktury micelarnej przez częściową hydrolizę cząsteczek białka za pomocą enzymu proteolitycznego. W żołądku młodych osobników wielu gatunków znajduje się enzym zwany renniną, który specyficznie hydrolizuje część miceli kazeiny, co prowadzi do powstania skrzepu. Klasyczna metoda wytrącania kazeiny z mleka krowiego, którą wykonuje się w laboratorium, polega na powolnym dodawaniu HCl (0,1 N), aby obniżyć pH mleka do 4,6. Kazeina będzie stopniowo tworzyć osad, podczas gdy stosunkowo niewiele innych białek mleka będzie się wytrącać. Różne kombinacje kontrolowanego strącania kwasem i enzymatycznej hydrolizy kazeiny są podstawą przemysłu serowarskiego. Często specyficzne kultury bakterii są używane do ustalenia warunków dla obniżonego pH i wydzielania enzymów proteolitycznych, które tworzą różne rodzaje sera.
Co to jest serwatka?
Serwatka jest płynem pozostałym po zsiadłym i odcedzonym mleku. Białka serwatki składają się z α-laktoalbuminy, β-laktoglobuliny, albuminy surowicy, immunoglobulin,
Białko serwatki jest wysokiej jakości białkiem naturalnie występującym w produktach mlecznych. Jest to białko „kompletne”, zawierające wszystkie niezbędne aminokwasy wymagane przez organizm ludzki i jest łatwo trawione.
Białka serwatkowe, zwane również białkami surowicy, nie zawierają fosforu i nie koagulują przy pH 4,6.
Serwatka może być używana do produkcji sera ricotta. Tradycyjnie serwatka z mleka owczego jest gotowana, aż do uzyskania miękkiego, puszystego twarogu.
Wpływ pH
Jak pH spada i staje się bardziej kwaśne, cząsteczki białka (kazeiny) przyciągają się wzajemnie i stają się „zsiadłe”, pływające w roztworze półprzezroczystej serwatki. Ta reakcja zbrylania zachodzi szybciej w cieplejszych temperaturach niż w temperaturach zimnych.
Skrzepy są produktem mlecznym otrzymywanym przez koagulację mleka w procesie zwanym zsiadaniem. Koagulacja może być spowodowana przez dodanie podpuszczki lub jakiejkolwiek jadalnej kwaśnej substancji, takiej jak sok z cytryny lub ocet, a następnie pozostawienie jej na miejscu.