Vad är ostmassa?
I matlagning innebär ostmassa att en emulsion eller kolloid bryts upp i stora delar av olika sammansättning genom de fysikalisk-kemiska processerna utflockning, gräddning och koalescens. Koagulering är avsiktlig och önskvärd vid tillverkning av ost och tofu, oavsiktlig och oönskad vid tillverkning av såser och vaniljsåser. Koagulering uppstår naturligt i mjölk om mjölken inte används före utgångsdatumet eller om mjölken står ute i varm temperatur.
Mjölk består av flera föreningar, främst fett, protein och socker. Proteinet i mjölk är normalt suspenderat i en kolloidal lösning, vilket innebär att de små proteinmolekylerna flyter runt fritt och självständigt. Dessa flytande proteinmolekyler bryter ljuset och bidrar (tillsammans med det suspenderade fettet) till mjölkens vita utseende. Normalt stöter dessa proteinmolekyler bort varandra, vilket gör att de kan flyta omkring utan att klumpa ihop sig, men när pH-värdet i lösningen ändras kan de dra till sig varandra och bilda klumpar. När pH sjunker och blir surare drar proteinmolekylerna (kasein och andra) till sig varandra och blir till ”grumlingar” som flyter i en lösning av genomskinlig vassle. Denna klumpningsreaktion sker snabbare vid varmare temperaturer än vid kalla temperaturer.
Vad är det som gör att mjölken kan koagulera?
Mjölk är en emulsion eller kolloid av smörfettkulor i en blandning som innehåller vatten, kolhydrater, mineraler och proteiner.
De viktigaste beståndsdelarna i mjölk är vatten, fett, proteiner, laktos (mjölksocker) och mineraler (salter). Mjölk innehåller också spår av andra ämnen som pigment, enzymer, vitaminer, fosfolipider (ämnen med fettliknande egenskaper) och gaser.
Vad är fetthalten i mjölk?
Enligt The Dairy Council har helmjölk 3,9 % fett (dvs. innehåller 3,9 g fett per 100 g), halvmjölk 1,7 % fett, mjölk med 1 % fett 1 % fett och skummjölk 0,3 % fett.
Vilka proteiner ingår i mjölk?
Den mesta mjölken som dricks i USA kommer från mjölkkor från kor. De viktigaste proteinerna som finns i mjölk är unika och finns inte i andra vävnader än bröstkörtlarna. Mjölkproteiner, särskilt kaseinerna, har en aminosyrasammansättning som är nyttig för tillväxt och utveckling av unga människor. Andra proteiner i mjölk omfattar en rad enzymer, proteiner som är involverade i transport av näringsämnen, proteiner som är involverade i sjukdomsresistens (antikroppar och andra), tillväxtfaktorer osv. (se referens 1). Kasein utgör 79,5 procent av de proteiner som finns i komjölk.
Mjölk innehåller 3,3 procent totalt protein. Mjölkproteiner innehåller alla 9 essentiella aminosyror som människan behöver. Mjölkproteiner syntetiseras i mjölkkörteln, men 60 % av de aminosyror som används för att bygga upp proteinerna kommer från kos diet. Det totala mjölkproteininnehållet och aminosyrasammansättningen varierar med ko-rasen och enskilda djurs genetik.(2)
Mjölkprotein utgör 19,3 % av proteininnehållet i mjölk. Det finns 3 eller 4 kaseiner i mjölken hos de flesta arter; de olika kaseinerna är skilda molekyler men liknar varandra till strukturen. Alla andra proteiner som finns i mjölk grupperas under namnet vassleproteiner. De viktigaste vassleproteinerna i komjölk är beta-laktoglobulin och alfa-laktalbumin.
β-laktoglobulin är det viktigaste vassleproteinet i komjölk och fårmjölk och finns även i många andra däggdjursarter; ett anmärkningsvärt undantag är människan.

Kaseinmolekylen
En familj av besläktade fosforproteiner (αS1, αS2, β, κ).
Kasein innehåller ett stort antal prolinrester som inte interagerar. Det finns inte heller några disulfidbroar. Som ett resultat av detta har det relativt lite tertiärstruktur. Den är relativt hydrofob, vilket gör den svårlöslig i vatten. Det finns i mjölk som en suspension av partiklar, så kallade kaseinmiceller,
Kasein innehåller ett stort antal prolinrester, som inte interagerar med varandra. Det finns inte heller några disulfidbroar. Som ett resultat av detta har det relativt lite tertiärstruktur. Den är relativt hydrofob, vilket gör den svårlöslig i vatten. Det finns i mjölk som en suspension av partiklar, så kallade kaseinmiceller,
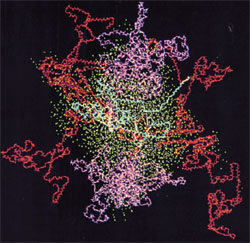
Bild: Bild: Kaseinmiceller, kappakasein i blått, alfakasein i rött, betakasein i magenta, syre från vatten i cyan. Källa: Kumosinski, T.F., King, G. och Farrell, H.M., Jr. (1994).Comparison of the three dimensional molecular models of bovine submicellar caseins with small-angle X-ray scattering.
Kaseinerna i komjölk kan innehålla olika former, där komjölk typiskt sett innehåller en av två typer av betakasein. beroende på en enskild kos genetiska profil kommer den producerade mjölken att innehålla antingen A1-betakasein eller A2-betakasein.
Alla kaseinmolekyler har minst en esterbunden fosfat. Inget av vassleproteinerna har detta.
Den isoelektriska punkten för kasein är 4,6. Eftersom mjölkens pH är 6,6 har kasein en negativ laddning i mjölk.
Kaseinerna har en mycket ojämn fördelning av laddningarna längs molekylen medan laddningarna i de större vassleproteinerna är mer jämnt fördelade. Detta förklarar en av de viktigaste egenskaperna hos kaseinerna i mjölk, nämligen deras amfifila natur. Laddade områden är i allmänhet vattenälskande eller hydrofila och de oladdade områdena längs molekylen är mer hydrofoba eller vattenhatande. Eftersom dessa områden är ojämnt fördelade längs molekylen är de mer exponerade.
I proteiner med jämn fördelning tar de hydrofila och hydrofoba regionerna i princip ut varandra. Det är på grund av kaseinmolekylernas amfifila natur som en av kaseinets viktigaste egenskaper framträder, kaseinmicellen. De flesta kaseiner i mjölk finns i intrikata lösa aggregat som kallas miceller.
Kaseinmicellen stabiliseras på två sätt. För det första finns kalciumfosfat i höga koncentrationer i mjölk och i själva kaseinmicellen. Koncentrationen är sådan att små aggregationer av fosfatet bildas. En del av fosfatet är relativt fritt att passera in i och ut ur micellen och en del av fosfatet är starkt bundet till proteinet. Detta bundna fosfat finns i små aggregat av olöst (kolloidalt) kalciumfosfat. Dessa har en tendens att cementera ihop micellen och stabilisera dess struktur.
K-kasein och ostmassa i mjölk
Den andra stabiliserande effekten beror på en egenskap hos K-kasein. K-kasein har i sin struktur en kolhydratgrupp som är esterifierad till threonin i proteinet. Denna kolhydratgrupp innehåller några negativt laddade grupper. Resultatet är att K-kasein blir mer hydrofilt i en del av molekylen. I micellen lokaliserar sig K-kasein och i viss mån B-kasein nära micellens vattengränssnitt eller sträcker sig in i det. Detta stabiliserar micellen genom att förhindra aggregering av micellerna genom sterisk repulsion (genom att förhindra att kaseinmicellerna närmar sig varandra). För K-kasein är peptidbindningen mellan den 105:e och 106:e aminosyran sårbar för hydrolys av proteolytiska enzymer (mikrobiell koagulering eller löpe). Detta är mekanismen för ostmassabildning (genom att avlägsna den kolhydratinnehållande delen av proteinet och därmed minska den steriska stabiliteten). Om K-kaseinet förlorar sitt skydd kan kaseinmicellerna aggregera och bilda en sammanhängande ostmassa.
För att förstå hur kymosin koagulerar mjölk måste man veta något om mjölkproteiner. Majoriteten av mjölkproteinerna är kasein och det finns fyra huvudtyper av kaseinmolekyler: alfa-s1, alfa-s2, beta och kappa. Alfa- och betakaseinerna är hydrofoba proteiner som lätt fälls ut av kalcium – den normala kalciumkoncentrationen i mjölk är långt över den som krävs för att fälla ut dessa proteiner. Kappakasein är dock en helt annan molekyl – den kan inte fällas ut av kalcium. När kaseinerna utsöndras bildar de aggregat, så kallade miceller, där alfa- och betakaseinerna hindras från att fällas ut genom att de interagerar med kappakasein. I huvudsak håller kappa-kasein normalt majoriteten av mjölkproteinet lösligt och hindrar det från att spontant koagulera.
Enter chymosin
Chymosin skär proteolytiskt sönder och inaktiverar kappa-kasein och omvandlar det till para-kappa-kasein och ett mindre protein som kallas makropeptid. Para-kappa-kasein har inte förmågan att stabilisera den micellära strukturen och de kalciumolösliga kaseinerna fälls ut och bildar en ostmassa.
Kaseinmolekylerna kan också separeras från vasslen genom utfällning av kaseinet med syra (liknande det som sker i magen när mjölk konsumeras) eller genom att störa den micellära strukturen genom partiell hydrolys av proteinmolekylerna med ett proteolytiskt enzym. I magen hos unga djur av många arter finns ett enzym som kallas rennin och som specifikt hydrolyserar en del av kaseinmicellen, vilket leder till att ostmassa bildas. En klassisk utfällningsmetod för kasein i komjölk som görs i laboratoriet är att långsamt tillsätta HCl (0,1 N) för att sänka mjölkens pH-värde till 4,6. Kaseinet kommer gradvis att bilda en utfällning medan relativt lite av de andra mjölkproteinerna fälls ut. Olika kombinationer av kontrollerad syrautfällning och enzymatisk hydrolys av kasein utgör grunden för ostindustrin. Ofta används särskilda bakteriekulturer för att skapa förutsättningar för sänkt pH och utsöndring av proteolytiska enzymer som bildar de olika osttyperna.
Vad är vassle?
Vassle är den vätska som återstår efter att mjölk har stelnat och silats. Vassleproteiner består av α-laktalbumin, β-laktoglobulin, serumalbumin, immunoglobuliner,
Vassleprotein är ett högkvalitativt protein som finns naturligt i mjölkprodukter. Det är ett ”komplett” protein som innehåller alla essentiella aminosyror som människokroppen behöver och är lättsmält.
Wheyproteiner, även kallade serumproteiner, innehåller inte fosfor och koagulerar inte vid pH 4,6.
Whey kan användas för att göra ricottaost. Traditionellt kokas vassle från fårmjölk ner tills det blir mjuk fluffig ostmassa.
Effekt av pH
När pH sjunker och blir surare drar proteinmolekylerna (kasein) till sig varandra och blir till ”curdles” som flyter i en lösning av genomskinlig vassle. Denna klumpningsreaktion sker snabbare vid varmare temperaturer än vid kalla temperaturer.
Kurv är en mejeriprodukt som erhålls genom koagulering av mjölk i en process som kallas curdling. Koaguleringen kan orsakas genom att man tillsätter löpe eller något ätbart surt ämne, t.ex. citronsaft eller vinäger, och sedan låter det sitta.