Wat is stremmen?
In de keuken is stremmen het uiteenvallen van een emulsie of colloïde in grote delen van verschillende samenstelling door de fysisch-chemische processen van vlokvorming, schuimvorming en coalescentie. Stremming is opzettelijk en wenselijk bij het maken van kaas en tofu; onopzettelijk en ongewenst bij het maken van sauzen en vla. Stremming komt op natuurlijke wijze in melk voor als de melk niet voor de houdbaarheidsdatum wordt gebruikt, of als de melk buiten in warme temperatuur blijft.
Melk is samengesteld uit verschillende verbindingen, hoofdzakelijk vet, eiwit en suiker. Het eiwit in melk is normaal gesproken gesuspendeerd in een colloïdale oplossing, wat betekent dat de kleine eiwitmoleculen vrij en onafhankelijk rondzweven. Deze zwevende eiwitmoleculen breken licht en dragen (samen met het gesuspendeerde vet) bij tot het witte uitzicht van melk. Normaal stoten deze eiwitmoleculen elkaar af, zodat ze kunnen rondzweven zonder te klonteren, maar wanneer de pH van hun oplossing verandert, kunnen ze elkaar aantrekken en klonters vormen. Dit is wat er gebeurt wanneer melk stremt: wanneer de pH daalt en zuurder wordt, trekken de eiwitmoleculen (caseïne en andere) elkaar aan en worden het “klonters” die in een oplossing van doorzichtige wei drijven. Deze klonteringsreactie verloopt sneller bij warmere temperaturen dan bij koude.
Wat zijn de peulen in melk die het mogelijk maken te stremmen?
Melk is een emulsie of colloïde van botervetbolletjes in een mengsel dat water, koolhydraten, mineralen en eiwitten bevat.
De hoofdbestanddelen van melk zijn water, vet, eiwitten, lactose (melksuiker) en mineralen (zouten). Melk bevat ook sporen van andere stoffen zoals pigmenten, enzymen, vitaminen, fosfolipiden (stoffen met vetachtige eigenschappen), en gassen.
Wat is het vetgehalte van melk?
Volgens The Dairy Council heeft volle melk 3,9% vet (d.w.z. bevat 3,9g vet per 100g), halfvolle melk heeft 1,7% vet, 1% vette melk heeft 1% vet, en magere melk heeft 0,3% vet.
Welke eiwitten zitten er in melk?
De meeste melk die in de VS wordt gedronken, is afkomstig van de melkklieren van koeien. De belangrijkste eiwitten in melk zijn uniek en komen niet voor in andere weefsels dan de melkklieren. De melkeiwitten, met name de caseïne, hebben een aminozuursamenstelling die nuttig is voor de groei en ontwikkeling van de jongen. Andere eiwitten in melk omvatten een reeks enzymen, eiwitten die betrokken zijn bij het vervoer van voedingsstoffen, eiwitten die betrokken zijn bij de weerstand tegen ziekten (antilichamen en andere), groeifactoren, enz. (zie referentie 1). Caseïne maakt 79,5 procent uit van de eiwitten in koemelk.
Melk bevat 3,3 procent totaal eiwit. Melkeiwitten bevatten alle 9 essentiële aminozuren die de mens nodig heeft. Melkeiwitten worden gesynthetiseerd in de melkklier, maar 60% van de aminozuren die gebruikt worden om de eiwitten op te bouwen, worden verkregen uit de voeding van de koe. Het totale melkeiwitgehalte en de aminozuursamenstelling varieert naar gelang van het koeienras en de genetica van de individuele dieren.(2)
Whey-eiwit maakt 19,3% uit van het eiwitgehalte in melk. Er zijn 3 of 4 caseïnen in de melk van de meeste diersoorten; de verschillende caseïnen zijn verschillende moleculen, maar hebben een vergelijkbare structuur. Alle andere eiwitten die in melk worden aangetroffen, worden gegroepeerd onder de naam wei-eiwitten. De belangrijkste wei-eiwitten in koemelk zijn beta-lactoglobuline en alfa-lactalbumine.
β-Lactoglobuline is het belangrijkste wei-eiwit van koeien- en schapenmelk en is ook aanwezig in veel andere zoogdiersoorten; een opmerkelijke uitzondering is de mens.

The Casein Molecule
Een familie van verwante fosfoproteïnen (αS1, αS2, β, κ).
Caseïne bevat een groot aantal proline-residuen, die niet op elkaar inwerken. Er zijn ook geen disulfidebruggen. Als gevolg daarvan heeft het relatief weinig tertiaire structuur. Het is relatief hydrofoob, waardoor het slecht oplosbaar is in water. Het wordt in melk aangetroffen als een suspensie van deeltjes, caseïnemicellen genoemd,
Caseïne bevat een hoog aantal proline residuen, die niet op elkaar inwerken. Er zijn ook geen disulfidebruggen. Als gevolg daarvan heeft het relatief weinig tertiaire structuur. Het is relatief hydrofoob, waardoor het slecht oplosbaar is in water. Het wordt in melk aangetroffen als een suspensie van deeltjes, caseïnemicellen genoemd,
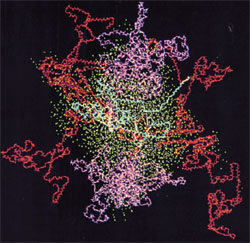
Afbeelding: Caseïne-micellen, kappa-caseïne in blauw, alfa-caseïne in rood, beta-caseïne in magenta, zuurstof uit water in cyaan. Bron: Kumosinski, T.F., King, G. and Farrell, H.M., Jr. (1994).Comparison of the three dimensional molecular models of bovine submicellar caseins with small-angle X-ray scattering.
De caseines in koemelk kunnen verschillende vormen hebben, waarbij koemelk typisch een van de twee soorten beta caseine bevat. afhankelijk van het genetisch profiel van een individuele koe zal de geproduceerde melk ofwel A1-beta caseines ofwel A2-beta caseines bevatten.
Alle caseïnemoleculen hebben ten minste één estergebonden fosfaat. Geen van de wei-eiwitten heeft dit.
Het iso-elektrisch punt van caseïne is 4,6. Aangezien de pH van melk 6,6 is, heeft caseïne in melk een negatieve lading.
De caseïnen hebben een zeer ongelijke verdeling van ladingen over het molecuul, terwijl in de belangrijkste wei-eiwitten de ladingen gelijkmatiger verdeeld zijn. Dit verklaart een van de belangrijkste eigenschappen van de caseïnen in melk, hun amfifiele aard. Geladen gebieden zijn over het algemeen waterminnend of hydrofiel en de niet-geladen gebieden langs het molecuul zijn meer hydrofoob of waterafstotend. Aangezien deze regio’s ongelijkmatig over het molecuul verdeeld zijn, zijn deze regio’s meer blootgesteld.
In eiwitten met een gelijkmatige verdeling heffen de hydrofiele en hydrofobe regio’s elkaar in principe op. Het is door de amfifiele aard van de caseïnemoleculen dat een van de belangrijkste eigenschappen van caseïne naar voren komt, de caseïnemicelle. De meeste caseïnen in melk worden aangetroffen in ingewikkelde losse aggregaties die micellen worden genoemd.
De caseïnemicelle wordt op twee manieren gestabiliseerd. Ten eerste wordt calciumfosfaat in hoge concentraties aangetroffen in melk en in de caseïnemicelle zelf. De concentratie is zodanig dat kleine aggregaties van het fosfaat worden gevormd. Een deel van het fosfaat is relatief vrij om in en uit de micel te gaan en een deel van het fosfaat is sterk gebonden aan het eiwit. Dit gebonden fosfaat bevindt zich in kleine aggregaties van onopgelost (colloïdaal) calciumfosfaat. Deze hebben de neiging om de micellen aan elkaar te lijmen, waardoor de structuur wordt gestabiliseerd.
k-Caseïne en het stremmen van melk
Het andere stabiliserende effect is te danken aan een eigenschap van K-caseïne. K-caseïne heeft in zijn structuur een koolhydraatgroep die veresterd is aan threonine in het eiwit. Deze koolhydraatgroep bevat enkele negatief geladen groepen. Het resultaat is dat K-caseïne hydrofieler wordt aan een deel van het molecuul. In de micel lokaliseert K-caseïne, en in zekere mate ook B-caseïne, zichzelf zo dicht mogelijk bij de water interface van de micel, of strekt zich daar uit. Dit stabiliseert de micel door het voorkomen van aggregatie van de micellen door sterische afstoting (door te voorkomen dat caseïne micellen elkaar dicht naderen). Voor K-caseïne is de peptide binding tussen het 105e en 106e aminozuur kwetsbaar voor hydrolyse door proteolytische enzymen (microbiële coagulator of stremsel). Dit is het mechanisme voor de vorming van wrongel (door het koolhydraatbevattende gedeelte van het eiwit te verwijderen en zo de sterische stabiliteit te verminderen). Door het verlies van de bescherming van de K-caseïne kunnen de caseïnemicellen zich aggregeren en een samenhangende wrongel vormen.
Om te begrijpen hoe chymosine melk stremt, moet men iets weten over melkeiwitten. Het merendeel van het melkeiwit is caseïne en er zijn vier hoofdtypen caseïnemoleculen: alfa-s1, alfa-s2, bèta en kappa. Alfa- en bètacaseïne zijn hydrofobe eiwitten die gemakkelijk door calcium worden neergeslagen – de normale calciumconcentratie in melk is veel hoger dan nodig is om deze eiwitten neer te slaan. Kappa-caseïne is echter een duidelijk andere molecule – deze kan niet met calcium worden geprecipiteerd. Wanneer de caseïnen worden afgescheiden, associëren zij zich tot aggregaten, micellen genaamd, waarin de alfa- en bètacaseïnen niet neerslaan door hun interacties met kappa-caseïne. In wezen houdt kappa caseïne normaal gesproken het merendeel van het melkeiwit oplosbaar en voorkomt het dat het spontaan stolt.
Enter chymosine
Chymosine snijdt proteolytisch en inactiveert kappa caseïne, waarbij het wordt omgezet in para-kappa-caseïne en een kleiner eiwit dat macropeptide wordt genoemd. Para-kappa-caseïne is niet in staat de micellaire structuur te stabiliseren en de calcium-onoplosbare caseïnen slaan neer en vormen een wrongel.
Caseïnemoleculen kunnen ook van de wei worden gescheiden door neerslag van de caseïne met zuur (vergelijkbaar met wat in de maag gebeurt wanneer melk wordt geconsumeerd) of door de micellaire structuur te verstoren door gedeeltelijke hydrolyse van de eiwitmoleculen met een proteolytisch enzym. In de maag van de jongen van vele diersoorten bevindt zich een enzym, rennine genaamd, dat specifiek een deel van de caseïnemicel hydrolyseert, wat leidt tot de vorming van wrongel. Een klassieke neerslagmethode voor caseïne in koemelk, die in het laboratorium wordt uitgevoerd, bestaat erin langzaam HCl (0,1 N) toe te voegen om de pH van de melk tot 4,6 te verlagen. De caseïne zal geleidelijk een neerslag vormen, terwijl relatief weinig van de andere melkeiwitten zullen neerslaan. Verschillende combinaties van gecontroleerde zuurneerslag en enzymatische hydrolyse van caseïne liggen aan de basis van de kaasindustrie. Vaak worden specifieke bacterieculturen gebruikt om de voorwaarden te scheppen voor verlaagde pH en afscheiding van proteolytische enzymen die de verschillende soorten kaas vormen.
Wat is wei?
Wié is de vloeistof die overblijft nadat melk gestremd en gezeefd is. Wei-eiwitten bestaan uit α-lactalbumine, β-lactoglobuline, serumalbumine, immunoglobulinen,
Whei-eiwit is een hoogwaardig eiwit dat van nature voorkomt in melkproducten. Het is een “compleet” eiwit dat alle essentiële aminozuren bevat die het menselijk lichaam nodig heeft en dat gemakkelijk verteerbaar is.
Whey-eiwitten, ook wel serumeiwitten genoemd, bevatten geen fosfor en coaguleren niet bij pH 4,6.
Whey kan worden gebruikt om ricotta kaas te maken. Traditioneel wordt de wei van schapenmelk gekookt tot het zachte fluffy wrongel is.
Effect van pH
Als de pH daalt en zuurder wordt, trekken de eiwitmoleculen (caseïne) elkaar aan en worden “wrongels” drijvend in een oplossing van doorschijnende wei. Deze klonteringsreactie verloopt sneller bij warmere temperaturen dan bij koude temperaturen.
Wrongel is een zuivelproduct dat wordt verkregen door melk te laten stremmen in een proces dat stremming wordt genoemd. De coagulatie kan worden veroorzaakt door toevoeging van stremsel of een eetbare zure stof zoals citroensap of azijn, en vervolgens te laten zitten.