Scienza > Chimica > Elementi di terza fila > Concetto di legame metallico e solidi metallici
In questo articolo, studieremo il concetto di legame metallico e i legami metallici nei cristalli di sodio, magnesio e alluminio.
Concetto di legame metallico:
Il legame metallico è definito come la forza di attrazione che lega i cationi metallici a un certo numero di elettroni mobili o delocalizzati nella sua sfera di influenza che tiene insieme i cationi metallici in un modello definito. Per spiegare la natura del legame metallico sono state proposte molte teorie. La teoria dell’elettrone libero o teoria del mare di elettroni è una delle più semplici proposte da Drude e Lorentz. Alcuni dei postulati importanti di questa teoria sono i seguenti:
Teoria dell’elettrone libero del legame metallico:
Gli atomi metallici hanno meno numero di elettroni di valenza, quindi hanno molti orbitali di valenza liberi. Na, Mg e Al hanno 3 orbitali liberi.
| Nome | Simbolo | Numero atomico. | Configurazione elettronica | Configurazione dettagliata |
| Sodio | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesio | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Alluminio | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
I valori del potenziale di ionizzazione dei metalli sono bassi, quindi gli elettroni di valenza sono tenuti sciolti e possono essere facilmente rimossi. La struttura strettamente impacchettata del cristallo metallico consiste negli atomi del metallo che sono identici in tutti gli aspetti.
Gli orbitali non occupati degli atomi strettamente impacchettati del metallo si sovrappongono agli orbitali simili degli atomi adiacenti attraverso il reticolo del cristallo. Gli elettroni di valenza rimossi dai loro orbitali e possono muoversi liberamente dagli orbitali di valenza vacanti di un atomo all’altro. Poiché questi elettroni di valenza non appartengono a nessun singolo atomo ma al cristallo nel suo insieme, sono chiamati elettroni delocalizzati o mobili. Gli ioni metallici (cationi) prodotti a causa della delocalizzazione sono chiamati kernel. Gli ioni metallici hanno posizioni fisse nel reticolo cristallino, mentre gli elettroni delocalizzati sono liberi di muoversi nel reticolo cristallino. Così il metallo può essere considerato come un’aggregazione di cationi metallici immersi in un mare di elettroni mobili.
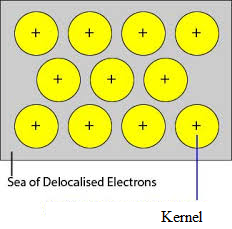
Siccome gli elettroni nei metalli sono delocalizzati, e si suppone che siano uniformemente distribuiti nel reticolo cristallino. Le forze di attrazione tra gli ioni metallici e gli elettroni delocalizzati sono uniformi in tutte le direzioni. Quindi il legame metallico è non direzionale.
Le unità che occupano i punti del reticolo in Sodio, Magnesio, Alluminio sono ioni positivi di essi rispettivamente e sono circondati da elettroni mobili. Così il sodio, il magnesio e l’alluminio sono solidi metallici.
Come ci spostiamo da sinistra a destra, cioè dal sodio all’alluminio, il numero di elettroni di valenza aumenta e quindi la forza del legame aumenta dal sodio all’alluminio.
Le proprietà come la conduttività elettrica e termica, la lucentezza metallica, la malleabilità e la duttilità possono essere spiegate sulla base della teoria degli elettroni liberi.
Caratteristiche dei legami metallici:
- Il legame metallico è definito come la forza di attrazione che lega i cationi metallici a un certo numero di elettroni mobili o delocalizzati nella sua sfera di influenza che tiene insieme i cationi metallici in un modello definito.
- Il legame metallico non è direzionale.
- Sono più deboli del legame covalente ma più forti delle forze di van der Waal.
- I legami non sono rigidi.
- La forza del legame metallico è direttamente legata alla carica positiva dello ione metallico. Così la forza del legame metallico aumenta come Na < Mg < Al.
Solidi metallici:
I solidi metallici sono solidi cristallini in cui le unità che occupano i punti del reticolo sono ioni positivi circondati da un pool di elettroni. (Concetto di legame metallico)
Strutture cristalline dei metalli:
L’analisi ai raggi X di diversi cristalli metallici ha dimostrato che i metalli adottano una delle seguenti strutture cristalline.
- Struttura cubica centrata sul corpo. (BCC)
- Struttura cubica centrata sulla faccia. (FCC)
- Struttura esagonale a pacchi ravvicinati. (HCP)
Sodio (Na):
Il sodio metallico ha una struttura cristallina a struttura cubica centrata sul corpo (BCC) a pacchi aperti. Il legame è un legame metallico non direzionale.
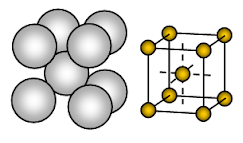
La disposizione degli ioni in un piano – matrice cubica – struttura aperta o quadrata imballata. In questa disposizione, ogni ione metallico tocca quattro ioni adiacenti in un piano. La sequenza degli strati è AB, AB, AB, ……….
Il sodio è un solido metallico. Nella cella unitaria del sodio, ogni ione di sodio è circondato da altri otto ioni di sodio equidistanti. Quindi il numero di coordinazione è 8. Questi ioni di sodio sono disposti agli angoli di un cubo immaginario e al centro del cubo è presente uno ione di sodio. Ci sono 2 ioni presenti in una cella unitaria di sodio.
Gli ioni di sodio occupano solo circa il 68% dello spazio disponibile in una cella unitaria. Quindi il 32% della cella unitaria rimane vuoto (void). Poiché questa struttura ha più spazio vuoto, i metalli che adottano questa struttura sono morbidi. Il sodio è quindi un metallo morbido a causa di più spazio vuoto (circa 32%) nella sua struttura cristallina e di un legame metallico piuttosto debole dovuto a un solo elettrone di valenza per atomo di Na nel suo cristallo.
Magnesio (Mg):
Il magnesio ha una struttura cristallina esagonale a pacchetti ravvicinati (HCP). Il legame è un legame metallico non direzionale.
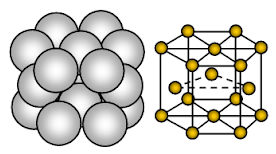
Il magnesio è un solido metallico. Le unità che occupano i siti del reticolo sono ioni Mg e questi ioni sono circondati da elettroni mobili o delocalizzati.
La disposizione degli ioni in un piano la disposizione degli ioni è una matrice esagonale o strato chiuso imballato. Così ogni ione metallico tocca sei ioni adiacenti in un piano. Ogni ione di magnesio tocca sei ioni di magnesio nel proprio strato, tre nello strato superiore e tre nello strato inferiore. Nella struttura esagonale imballata, gli strati chiusi di ioni sono impilati in una sequenza alternata chiamata solitamente AB ABA ….. Ogni terzo strato di ioni è esattamente uguale e si trova direttamente sopra il primo strato.
Ogni atomo di Mg è circondato da altri 12 ioni di Mg equidistanti. Quindi il numero di coordinazione è 12. Nella cella unitaria, circa il 26% dello spazio disponibile è vuoto (void). Questa struttura è più strettamente imballata. A causa di meno spazio vuoto nella struttura cristallina, più nuvola di elettroni dovuta a Mg+2 e forte legame metallico, il magnesio è più duro del metallo sodio. È più malleabile e duttile del sodio.
Alluminio (Al):
L’alluminio ha una struttura cristallina cubica a facce centrate (FCC). Il legame è un legame metallico non direzionale.

L’alluminio è un solido metallico. Le unità che occupano i siti del reticolo sono ioni Al e questi ioni sono circondati da elettroni mobili o delocalizzati.
La disposizione degli ioni in un piano è una matrice esagonale o uno strato chiuso imballato. Così ogni ione metallico tocca sei ioni adiacenti in un piano.
In una struttura cristallina cubica a strati ravvicinati o a facce centrate, la sequenza di strati ravvicinati di ioni si ripete ogni quarto strato. Cioè ogni quarto strato di ioni è esattamente uguale e si trova direttamente sopra il primo strato. Si chiama quindi ABC, ABC, ABC, ….. impacchettamento cubico ravvicinato. L’impacchettamento cubico ravvicinato è anche chiamato struttura ravvicinata centrata sulla faccia perché, se visto da un angolo particolare, gli ioni possono essere considerati come se fossero agli otto angoli del cubo e al centro di ciascuna delle sei facce del cubo, cioè la cella unitaria.
Ogni ione di alluminio (Al+3) è circondato da altri 12 atomi di alluminio equidistanti. Quindi il numero di coordinazione è 12. Nella cella unitaria dell’alluminio, circa il 26% dello spazio disponibile è vuoto (void). A causa del minor spazio vuoto nella struttura cristallina e del forte legame metallico, l’alluminio è più duro, malleabile e duttile del sodio e del magnesio.
Silicio (Si):
I solidi covalenti sono solidi cristallini in cui i punti del reticolo sono atomi. La forza di legame principale è il legame covalente tra gli atomi. Il silicio è un solido covalente in cui i punti del reticolo sono occupati dagli atomi dell’elemento. Il silicio è un solido a rete. C’è una rete di legami covalenti Si-Si.
Il numero atomico del silicio è 14. La configurazione elettronica del silicio nel suo stato fondamentale è 1s2, 2s22p6, 3s2 3p2. Ha quattro elettroni di valenza nei loro orbitali di valenza. Il silicio subisce l’ibridazione sp3 formando quattro orbitali ibridati sp3 di uguale energia. Ogni atomo di silicio forma quattro legami covalenti con altri quattro atomi di silicio vicini a causa di SP3- SP3 Così si forma un’unità tetraedrica Si4 che si estende per formare una molecola gigante tridimensionale.

I legami Si -Si corrono continuamente in tutto il cristallo. Così un cristallo di silicio è considerato come una molecola gigante tridimensionale che ha una rete tetraedrica di atomi di silicio legati insieme da forti legami covalenti. Il solido che contiene una tale struttura è chiamato solido di rete. L’angolo di legame Si-Si è 109 o 28 ‘ mentre la lunghezza del legame è 2,35 o
A causa della sovrapposizione degli orbitali ibridi, i legami covalenti Si-Si sono molto forti e sono direzionali. La presenza di una rete di forti legami covalenti spiega la durezza e il suo alto punto di fusione.
Gli elettroni nel legame covalente sono localizzati, quindi il silicio non è un buon conduttore di elettricità e calore. Ma è un semiconduttore. A causa della non disponibilità di elettroni liberi, il silicio è un isolante alla temperatura dello zero assoluto. Tuttavia, il silicio è un semiconduttore. Se la temperatura aumenta, i legami covalenti si rompono e si liberano elettroni che possono condurre elettricità. Così la conduttività aumenta con l’aumento della temperatura.