Tudomány > Kémia > Harmadik sor elemei > A fémes kötés fogalma és a fémes szilárd testek
A cikkben a fémes kötés fogalmát és a nátrium, magnézium és alumínium kristályok fémes kötéseit fogjuk tanulmányozni.
A fémes kötés fogalma:
A fémes kötést úgy határozzuk meg, mint a vonzóerőt, amely a fémkationokat a hatókörükben lévő számos mozgó vagy delokalizált elektronhoz köti, amely a fémkationokat meghatározott mintázatban tartja össze. A fémes kötés természetének magyarázatára számos elméletet javasoltak. A szabad elektronok elmélete vagy elektrontenger-elmélet az egyik legegyszerűbb elmélet, amelyet Drude és Lorentz javasolt. Ennek az elméletnek néhány fontos posztulátuma a következő:
A fémes kötés szabad elektronelmélete:
A fématomoknak kevesebb valenciaelektronjuk van, ezért sok üres valenciapályájuk van. Na, Mg és Al esetében 3p pálya üres.
| Név | Szimbólum | Atomszám. | Elektronikus konfiguráció | Fontos konfiguráció |
| Nátrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnézium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Alumínium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
A fémek ionizációs potenciálértéke alacsony, ezért a valenciaelektronokat lazán tartják és könnyen eltávolíthatók. A fémkristály szorosan pakolt szerkezete a fém minden tekintetben azonos atomjaiból áll.
A fém szorosan pakolt atomjainak nem elfoglalt pályái a kristályrácson keresztül átfedésben vannak a szomszédos atomok hasonló pályáival. A valenciaelektronok eltávolodtak pályáikról, és szabadon mozoghatnak az egyik atom üres valenciapályáiról a másikra. Mivel ezek a valenciaelektronok nem egyetlen atomhoz, hanem a kristály egészéhez tartoznak, delokalizált vagy mozgó elektronoknak nevezzük őket. A delokalizáció következtében keletkező fémionokat (kationokat) magoknak nevezzük. A fémionoknak rögzített helyük van a kristályrácsban, míg a delokalizált elektronok szabadon mozoghatnak a kristályrácsban. Így a fémeket a mozgó elektronok tengerébe merülő fémkationok halmazának tekinthetjük.
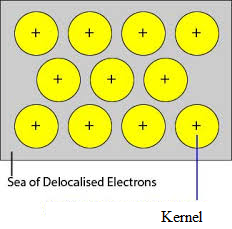
Mivel a fémekben az elektronok delokalizáltak, és feltételezzük, hogy egyenletesen oszlanak el a kristályrácsban. A fémionok és a delokalizált elektronok közötti vonzóerők minden irányban egyenletesek. Ezért a fémes kötés nem irányított.
A nátrium, magnézium, alumínium rácspontokat elfoglaló egységei ezek pozitív ionjai, amelyeket mozgó elektronok vesznek körül. Így a nátrium, a magnézium és az alumínium fémes szilárd testek.
A balról jobbra haladva, azaz a nátriumtól az alumínium felé haladva a valenciaelektronok száma nő, és így a kötés szilárdsága is nő a nátriumtól az alumínium felé.
A szabad elektronok elmélete alapján magyarázhatók az olyan tulajdonságok, mint az elektromos és hővezetés, a fémes csillogás, az alakíthatóság és a képlékenység.
A fémes kötések jellemzői:
- A fémes kötést úgy határozzuk meg, mint a vonzóerőt, amely a fémkationokat a hatásterületükön belül számos mozgó vagy delokalizált elektronhoz köti, amely a fémkationokat meghatározott mintázatban tartja össze.
- A fémes kötés nem irányított.
- A kovalens kötésnél gyengébb, de a van der Waal-erőknél erősebb.
- A kötések nem merevek.
- A fémes kötés erőssége közvetlen kapcsolatban áll a fémion pozitív töltésével. Tehát a fémes kötés erőssége nő, ahogy Na < Mg < Al.
Metál szilárd testek:
A fémes szilárd testek olyan kristályos szilárd testek, amelyekben a rácspontokat elfoglaló egységek pozitív ionok, amelyeket elektronok halmaza vesz körül. (A fémes kötés fogalma)
Fémek kristályszerkezete:
A különböző fémkristályok röntgenvizsgálata kimutatta, hogy a fémek az alábbi kristályszerkezetek valamelyikét veszik fel.
- Testközpontú köbös szerkezet. (BCC)
- Oldalközpontú köbös szerkezet. (FCC)
- Hexagonális, szorosan pakolt szerkezet. (HCP)
Nátrium (Na):
A nátrium fém testközpontú köbös (BCC), nyílt csomagolású kristályszerkezetű. A kötés nem irányított fémes kötés.
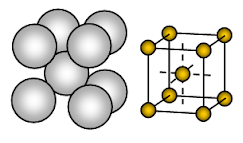
Az ionok elrendeződése egy síkban- Kubikus tömb – nyílt vagy négyzet alakú szerkezet. Ebben az elrendezésben minden egyes fémion négy szomszédos iont érint egy síkban. A rétegek sorrendje: AB, AB, AB, AB, ……….
A nátrium fémes szilárd anyag. A nátrium egységcellájában minden egyes nátriumiont nyolc másik, egyenlő távolságra lévő nátriumion vesz körül. Ezért a koordinációs szám 8. Ezek a nátriumionok egy képzeletbeli kocka sarkaiban helyezkednek el, a kocka közepén pedig egy nátriumion található. Egy nátrium egységcellában 2 ion van jelen.
A nátriumionok az egységcellában rendelkezésre álló helynek csak mintegy 68%-át foglalják el. Az egységcella 32%-a tehát üresen (void) marad. Mivel ebben a szerkezetben több az üres tér, az ezt a szerkezetet alkalmazó fémek lágyak. A nátrium tehát lágy fém, mivel kristályszerkezetében több az üres tér (kb. 32% ) és meglehetősen gyenge a fémes kötés, mivel kristályában Na atomonként csak egy valenciaelektron található.
Magnézium (Mg):
A magnézium hexagonális, szorosan pakolt (HCP) kristályszerkezetű. A kötés nem irányított fémes kötés.
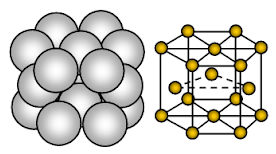
A magnézium fémes szilárd anyag. A rácshelyeket elfoglaló egységek Mg-ionok, és ezeket az ionokat mozgó vagy delokalizált elektronok veszik körül.
Az ionok elrendeződése egy síkban az ionok elrendeződése hexagonális tömb vagy zárt tömött réteg. Így minden egyes fémion hat szomszédos iont érint egy síkban. Minden magnéziumion hat magnéziumiont érint a saját rétegében, hármat a felette lévő rétegben és hármat az alatta lévő rétegben. A hexagonális csomagolt szerkezetben az ionok zárt csomagolt rétegei váltakozó sorrendben, általában AB ABA ….. ….. Minden harmadik ionréteg pontosan ugyanolyan és közvetlenül az első réteg felett helyezkedik el.
Minden Mg-atomot 12 másik, egyenlő távolságra lévő Mg-ion vesz körül. Ezért a koordinációs szám 12. Az egységcellában a rendelkezésre álló tér mintegy 26%-a üres (void). Ez a szerkezet sűrűbben pakolt. Mivel a kristályszerkezetben kevesebb az üres tér, az Mg+2 miatt több az elektronfelhő és erős a fémes kötés, a magnézium keményebb, mint a nátrium fém. Forgékonyabb és képlékenyebb, mint a nátrium.
Alumínium (Al):
Az alumínium arccal centrált köbös (FCC) kristályszerkezetű. Kötése nem irányított fémes kötés.

Az alumínium fémes szilárd anyag. A rácshelyeket elfoglaló egységek Al-ionok, és ezeket az ionokat mozgó vagy delokalizált elektronok veszik körül.
Az ionok elrendeződése egy síkban az ionok elrendeződése hexagonális tömb vagy zárt tömött réteg. Így minden egyes fémion hat szomszédos ionnal érintkezik egy síkban.
A köbös, zárt csomagolású vagy arcközpontú köbös kristályszerkezetben az ionok zárt csomagolású rétegeinek sorozata minden negyedik rétegben megismétlődik. Vagyis minden negyedik ionréteg pontosan ugyanolyan és közvetlenül az első réteg fölött helyezkedik el. Ezt tehát ABC, ABC, ABC, ABC, ….. köbös szoros pakolásúnak nevezik. A köbös szoros pakolást arcközpontú szoros pakolású szerkezetnek is nevezik, mert ha egy bizonyos szögből nézzük, az ionok a kocka nyolc sarkában és a kocka mind a hat oldalának, azaz az egységcellának a közepén helyezkednek el.
Minden alumíniumiont (Al+3) 12 másik, egyenlő távolságra lévő alumíniumatom vesz körül. Ezért a koordinációs szám 12. Az alumínium egységcellájában a rendelkezésre álló tér mintegy 26%-a üres (void). A kristályszerkezetben lévő kevesebb üres tér, az erős fémes kötés miatt az alumínium keményebb, képlékenyebb és képlékenyebb, mint a nátrium és a magnézium.
Sícium (Si):
A kovalens szilárd testek olyan kristályos szilárd testek, amelyekben az egységrácspontok atomok. A fő kötőerő az atomok közötti kovalens kötések. A szilícium olyan kovalens szilárd test, amelyben a rácspontokat az elem atomjai foglalják el. A szilícium hálózati szilárd test. Si-Si kovalens kötések hálózata van.
A szilícium atomszáma 14. A szilícium elektronkonfigurációja alapállapotában 1s2, 2s22p6, 3s2 3p2. Négy valenciaelektronja van a valenciapályáin. A szilícium sp3 hibridizáción megy keresztül, négy azonos energiájú sp3 hibridizált pályát képezve. Minden szilíciumatom négy kovalens kötést képez négy másik szomszédos szilíciumatommal az SP3- SP3 miatt Így tetraéderes Si4 egység jön létre, amely háromdimenziós óriásmolekulává bővül.

A Si -Si kötések folyamatosan futnak végig a kristályban. Így a szilíciumkristály egy olyan háromdimenziós óriásmolekulának tekinthető, amely erős kovalens kötésekkel összekapcsolt szilíciumatomok tetraéderes hálózatával rendelkezik. Az ilyen szerkezetet tartalmazó szilárd anyagot hálózati szilárd anyagnak nevezzük. A Si-Si kötésszög 109 o 28 ‘, míg a kötéshossz 2,35 o
A hibrid orbitálisok átfedése miatt a Si-Si kovalens kötések nagyon erősek és irányítottak. Az erős kovalens kötések hálózatának jelenléte magyarázza a keménységet és a magas olvadáspontot.
A kovalens kötés elektronjai lokalizáltak, ezért a szilícium nem jó áram- és hővezető. Viszont félvezető. A szabad elektronok elérhetetlensége miatt a szilícium abszolút nulla hőmérsékleten szigetelő. A szilícium azonban félvezető. Ha a hőmérsékletet növeljük, a kovalens kötések felbontják az elektronokat, amelyek felszabadulnak, és így vezetni tudják az elektromosságot. Így a hőmérséklet növekedésével nő a vezetőképesség.