Vetenskap > Kemi > Tredje raden element > Begreppet metallbindning och metalliska solider
I den här artikeln kommer vi att studera begreppet metallbindning och metallbindningar i natrium-, magnesium- och aluminiumkristaller.
Begreppet metallisk bindning:
Den metalliska bindningen definieras som den attraktionskraft som binder metallkatjoner till ett antal rörliga eller delokaliserade elektroner inom sin influenssfär som håller ihop metallkatjonerna i ett bestämt mönster. För att förklara metallbindningens natur har många teorier föreslagits. Teorin om fria elektroner eller elektronhavsteorin är en av de enklaste teorierna som föreslogs av Drude och Lorentz. Några av de viktiga postulaten i denna teori är följande:
Frielektronteori om metalliska bindningar:
Metallatomer har färre antal valenceelektroner så de har många lediga valenceorbitaler. Na, Mg och Al har 3p-orbitaler lediga.
| Namn | Symbol | Atomnummer. | Elektronisk konfiguration | Detaljerad konfiguration |
| Natrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Ioniseringspotentialen hos metaller är låg, vilket innebär att valenceelektronerna sitter löst och kan lätt avlägsnas. Metallkristallens tätt packade struktur består av metallens atomer som är identiska i alla avseenden.
De oockuperade orbitalerna hos metallens tätt packade atomer överlappar med liknande orbitaler hos angränsande atomer genom kristallgitteret. Valenceelektroner avlägsnas från sina banor och kan röra sig fritt från lediga valencebanor från en atom till en annan. Eftersom dessa valenselektroner inte tillhör någon enskild atom utan kristallen som helhet kallas de för delokaliserade eller rörliga elektroner. De metalljoner (katjoner) som bildas på grund av delokalisering kallas kärnor. Metalljonerna har fasta positioner i kristallgitteret medan de delokaliserade elektronerna är fria att röra sig i kristallgitteret. Metall kan således betraktas som en aggregering av metallkatjoner nedsänkt i ett hav av rörliga elektroner.
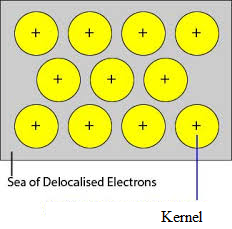
Då elektronerna i metallerna är delokaliserade och de antas vara jämnt fördelade i kristallgitteret. Attraktionskrafterna mellan metalljonerna och de delokaliserade elektronerna är enhetliga i alla riktningar. Därför är metallbindningen icke-riktad.
Enheterna som upptar gitterpunkterna i natrium, magnesium och aluminium är positiva joner av dem respektive och är omgivna av rörliga elektroner. Natrium, magnesium och aluminium är således metalliska fasta ämnen.
När vi rör oss från vänster till höger, dvs. från natrium till aluminium, ökar antalet valenselektroner och därmed ökar bindningsstyrkan från natrium till aluminium.
Egenskaperna som elektrisk och termisk ledningsförmåga, metallisk lyster, formbarhet och duktilitet kan förklaras med hjälp av teorin om fria elektroner.
Metallbindningarnas egenskaper:
- Metallbindningen definieras som den attraktionskraft som binder metallkatjoner till ett antal rörliga eller delokaliserade elektroner inom dess inflytelsesfär som håller ihop metallkatjonerna i ett bestämt mönster.
- Metallbindningen är icke-riktad.
- De är svagare än den kovalenta bindningen men starkare än van der Waals krafter.
- Bindningarna är inte stela.
- Metallbindningens styrka är direkt relaterad till den positiva laddningen på metalljonen. Så metallbindningens styrka ökar när Na < Mg < Al.
Metalliska solider:
Metalliska solider är kristallina solider där enheterna som upptar gitterpunkterna är positiva joner omgivna av en pool av elektroner. (Begreppet metallbindning)
Metallers kristallstrukturer:
Röntgenanalyser av olika metalliska kristaller har visat att metaller antar någon av följande kristallstrukturer:
- Kroppscentrerad kubisk struktur. (BCC)
- Kubisk struktur med frontcentrerad struktur. (FCC)
- Hexagonal nära packad struktur. (HCP)
Natrium (Na):
Natriummetall har kroppscentrerad kubisk (BCC) öppen packad kristallstruktur. Bindningen är icke-riktad metallisk bindning.
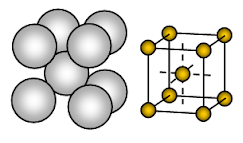
Arrangemanget av joner i ett plan- Kubisk gruppering – öppen eller fyrkantig packad struktur. I detta arrangemang berör varje metalljon fyra intilliggande joner i ett plan. Lagerföljden är AB, AB, AB, AB, ……….
Natrium är ett metalliskt fast ämne. I natriums enhetscell är varje natriumjon omgiven av åtta andra natriumjoner på samma avstånd. Dessa natriumjoner är placerade i hörnen av en tänkt kub och i kubens mitt finns en natriumjon. Det finns två joner i en enhetscell av natrium.
Natriumjonerna upptar endast cirka 68 % av det tillgängliga utrymmet i en enhetscell. Så 32 % av enhetscellen förblir tom (void). Eftersom denna struktur har mer tomt utrymme är metaller som antar denna struktur mjuka. Natrium är således en mjuk metall på grund av mer tomt utrymme (ca 32 % ) i sin kristallstruktur och ganska svag metallbindning på grund av endast en valenselektron per Na-atom i sin kristall.
Magnesium (Mg):
Magnesium har en hexagonal nära packad (HCP) kristallstruktur. Bindningen är icke-riktad metallisk bindning.
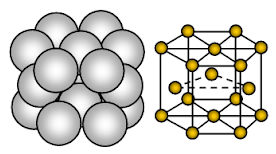
Magnesium är metalliskt fast ämne. De enheter som upptar gitterplatser är Mg-joner och dessa joner är omgivna av rörliga eller delokaliserade elektroner.
Det arrangemang av joner i ett plan arrangemanget av joner är en hexagonal matris eller ett slutet packat skikt. Varje metalljon berör således sex angränsande joner i ett plan. Varje magnesiumjon berör sex magnesiumjoner i sitt eget lager, tre i lagret ovanför och tre i lagret under. I den hexagonala packade strukturen är de slutna packade lagren av joner staplade i en omväxlande ordning som vanligtvis kallas AB ABA ABA …… Varje tredje lager av joner är exakt likadant som och ligger direkt ovanför det första lagret.
Varje Mg-atom är omgiven av 12 andra jämnstora Mg-joner. Därför är koordinationstalet 12. I enhetscellen är cirka 26 % av det tillgängliga utrymmet tomt (void). Denna struktur är mer tätt packad. På grund av mindre tomt utrymme i kristallstrukturen, mer elektronmoln på grund av Mg+2 och starka metallbindningar är magnesium hårdare än natriummetall. Det är mer formbart och duktilt än natrium.
Aluminium (Al):
Aluminium har en ytcentrerad kubisk (FCC) kristallstruktur. Bindningen är icke-riktad metallisk bindning.

Aluminium är metalliskt fast ämne. De enheter som upptar gitterplatser är Al-joner och dessa joner är omgivna av rörliga eller delokaliserade elektroner.
Ionernas arrangemang i ett plan jonernas arrangemang är en hexagonal matris eller ett slutet packat skikt. Varje metalljon berör således sex angränsande joner i ett plan.
I en kubisk nära packad eller ytcentrerad kubisk kristallstruktur upprepas sekvensen av nära packade lager av joner vart fjärde lager. D.v.s. vart fjärde lager av joner är exakt likadant som och ligger direkt ovanför det första lagret. Den kallas därför ABC, ABC, ABC, ABC, ….. cubic close packing. Kubisk tät packning kallas också för ytcentrerad tätpackad struktur eftersom jonerna, om de betraktas från en viss vinkel, kan anses befinna sig i kubens åtta hörn och i mitten av var och en av kubens sex ytor, dvs. enhetscellen.
Varje aluminiumjon (Al+3) är omgiven av 12 andra aluminiumatomer som befinner sig på lika avstånd från varandra. Därför är koordinationstalet 12. I aluminiumets enhetscell är cirka 26 % av det tillgängliga utrymmet tomt (void). På grund av mindre tomt utrymme i kristallstrukturen och starka metalliska bindningar är aluminium hårdare, mer formbart och duktilt än natrium och magnesium.
Silikon (Si):
Kovalenta fasta ämnen är kristallina fasta ämnen där enhetsgitterpunkterna är atomer. Den viktigaste bindningskraften är kovalenta bindningar mellan atomer. Kisel är en kovalent fast substans där gitterpunkterna är upptagna av grundämnets atomer. Kisel är ett nätverksfast ämne. Det finns ett nätverk av kovalenta Si-Si-bindningar.
Atomnumret för kisel är 14. Elektronkonfigurationen för kisel i dess grundtillstånd är 1s2, 2s22p6, 3s2 3p2. Den har fyra valenselektroner i sina valensorbitaler. Kisel genomgår sp3-hybridisering och bildar fyra sp3-hybridiserade orbitaler med samma energi. Varje kiselatom bildar fyra kovalenta bindningar med fyra andra angränsande kiselatomer på grund av SP3- SP3 Således bildas en tetraedrisk Si4-enhet som utvidgas till att bilda en tredimensionell jättemolekyl.

Si -Si-bindningarna löper kontinuerligt genom hela kristallen. En kiselkristall betraktas således som en gigantisk tredimensionell molekyl med ett tetraedriskt nätverk av kiselatomer som är bundna till varandra genom starka kovalenta bindningar. En fast substans med en sådan struktur kallas nätverksfast substans. Si-Si-bindningsvinkeln är 109 o 28 ’ medan bindningslängden är 2,35 o
På grund av att hybridorbitalerna överlappar varandra är de kovalenta Si-Si-bindningarna mycket starka och riktade. Förekomsten av ett nätverk av starka kovalenta bindningar förklarar hårdheten och den höga smältpunkten.
Elektronerna i den kovalenta bindningen är lokaliserade, vilket gör att kisel inte är en bra ledare för elektricitet och värme. Men det är en halvledare. På grund av att fria elektroner inte finns tillgängliga är kisel en isolator vid absolut nolltemperatur. Kisel är dock en halvledare. Om temperaturen höjs bryts kovalenta bindningar och elektroner frigörs, vilket gör att de kan leda elektricitet. Ledningsförmågan ökar alltså med ökad temperatur.