Nauka > Chemia > Pierwiastki trzeciego rzędu >Pojęcie wiązania metalicznego i metalicznych ciał stałych
W tym artykule będziemy badać pojęcie wiązania metalicznego i wiązania metaliczne w kryształach sodu, magnezu i aluminium.
Pojęcie wiązania metalicznego:
Wiązanie metaliczne jest definiowane jako siła przyciągania, która wiąże kationy metalu z pewną liczbą ruchomych lub zdelokalizowanych elektronów w swojej sferze wpływu, która utrzymuje kationy metalu razem w określonym wzorze. Aby wyjaśnić naturę wiązania metalicznego zaproponowano wiele teorii. Teoria elektronów swobodnych lub teoria morza elektronowego jest jedną z najprostszych teorii zaproponowanych przez Drude’a i Lorentza. Niektóre z ważnych postulatów tej teorii są następujące:
Teoria elektronów swobodnych wiązania metalicznego:
Atomy metali mają mniejszą liczbę elektronów walencyjnych, więc mają wiele wolnych orbitali walencyjnych. Na, Mg i Al mają wolne orbitale 3p.
| Nazwa | Symbol | Nr atomu. | Konfiguracja elektroniczna | Konfiguracja szczegółowa |
| Sód | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnez | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Wartości potencjału jonizacji metali są niskie, stąd elektrony walencyjne są luźno trzymane i mogą być łatwo usunięte. Ściśle upakowana struktura kryształu metalicznego składa się z atomów metalu, które są identyczne pod każdym względem.
Niezajęte orbitale ściśle upakowanych atomów metalu pokrywają się z podobnymi orbitalami sąsiednich atomów przez sieć krystaliczną. Elektrony walencyjne usunięte z ich orbitali i może swobodnie poruszać się z wolnych orbitali walencyjnych jednego atomu do innych. Ponieważ te elektrony walencyjne nie należą do żadnego pojedynczego atomu, ale do kryształu jako całości, są one nazywane elektronami delokalizowanymi lub ruchomymi. Jony metali (kationy) powstałe w wyniku delokalizacji nazywane są jądrami. Jony metalu mają ustalone pozycje w sieci krystalicznej, podczas gdy zdelokalizowane elektrony mogą swobodnie poruszać się w sieci krystalicznej. Metal można więc traktować jako agregację kationów metalu zanurzonych w morzu ruchomych elektronów.
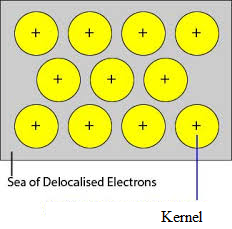
Ponieważ elektrony w metalach są delokalizowane i przyjmuje się, że są one równomiernie rozmieszczone w sieci krystalicznej. Siły przyciągania pomiędzy jonami metalu a zdelokalizowanymi elektronami są jednakowe we wszystkich kierunkach. Stąd wiązanie metaliczne jest niekierunkowe.
Jednostki zajmujące punkty kraty w Sodzie, Magnesie, Aluminium są odpowiednio ich dodatnimi jonami i są otoczone przez ruchliwe elektrony. Tak więc Sód, Magnez i Aluminium są metalicznymi ciałami stałymi.
Jak poruszamy się od lewej do prawej tj. od Sodu do Aluminium liczba elektronów walencyjnych wzrasta i stąd siła wiązania wzrasta od Sodu do Aluminium.
Właściwości takie jak przewodnictwo elektryczne i cieplne, metaliczny połysk, ciągliwość i plastyczność mogą być wyjaśnione na podstawie teorii elektronów swobodnych.
Charakterystyka wiązań metalicznych:
- Wiązanie metaliczne jest definiowane jako siła przyciągania, która wiąże kationy metalu z pewną liczbą ruchomych lub zdelokalizowanych elektronów w swojej sferze wpływów, która utrzymuje kationy metalu razem w określonym wzorze.
- Wiązanie metaliczne jest niekierunkowe.
- Są one słabsze niż wiązanie kowalencyjne, ale silniejsze niż siły van der Waala.
- Wiązania nie są sztywne.
- Siła wiązania metalicznego jest bezpośrednio związana z ładunkiem dodatnim na jonie metalu. Tak więc siła wiązania metalicznego rośnie wraz ze wzrostem Na < Mg < Al.
Ciała stałe metaliczne:
Ciała stałe metaliczne są to krystaliczne ciała stałe, w których jednostkami zajmującymi punkty sieci są jony dodatnie otoczone pulą elektronów. (Koncepcja wiązania metalicznego)
Struktury krystaliczne metali:
Analiza rentgenowska różnych kryształów metalicznych wykazała, że metale przyjmują jedną z następujących struktur krystalicznych.
- Struktura sześcienna centrowana ciałem. (BCC)
- Struktura sześcienna z centrowaniem powierzchni. (FCC)
- Hexagonal close-packed structure. (HCP)
Sód (Na):
Sód metaliczny ma ciało centrowane sześcienne (BCC) otwartą upakowaną strukturę krystaliczną. Wiązanie jest niekierunkowe wiązanie metaliczne.
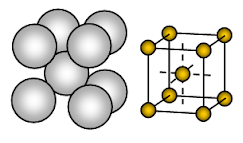
Układ jonów w jednej płaszczyźnie – układ sześcienny – struktura otwarta lub kwadratowa. W tym układzie każdy jon metalu styka się z czterema sąsiednimi jonami w jednej płaszczyźnie. Kolejność warstw to AB, AB, AB, ……….
Sód jest ciałem stałym metalicznym. W komórce jednostkowej sodu, każdy jon sodu jest otoczony przez osiem innych równomiernie oddalonych jonów sodu. Stąd liczba koordynacyjna wynosi 8. Te jony sodu są rozmieszczone w rogach wyimaginowanego sześcianu i w środku sześcianu, jeden jon sodu jest obecny. Istnieją 2 jony obecne w jednej komórce jednostkowej sodu.
Jony sodu zajmują tylko około 68% dostępnej przestrzeni w komórce jednostkowej. Tak więc 32% komórki jednostkowej pozostaje pusta (void). Ponieważ struktura ta ma więcej pustej przestrzeni metale, które przyjmują tę strukturę są miękkie. Sód jest więc miękki metal z powodu więcej pustej przestrzeni (około 32%) w swojej strukturze krystalicznej i raczej słabe wiązanie metaliczne z powodu tylko jednego elektronu walencyjnego na atom Na w swoim krysztale.
Magnez (Mg):
Magnez ma heksagonalny close-packed (HCP) struktura kryształu. Wiązanie jest niekierunkowe wiązanie metaliczne.
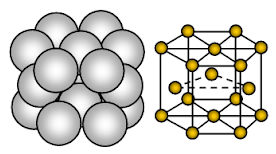
Magnez jest metalicznym ciałem stałym. Jednostkami zajmującymi miejsca w sieci są jony Mg, a jony te są otoczone przez ruchome lub zdelokalizowane elektrony.
Układ jonów w jednej płaszczyźnie układ jonów jest sześciokątny lub zamknięta upakowana warstwa. Tak więc każdy jon metalu dotyka sześciu sąsiednich jonów w jednej płaszczyźnie. Każdy jon magnezu dotyka sześciu jonów magnezu w swojej warstwie, trzech w warstwie powyżej i trzech w warstwie poniżej. W strukturze upakowanej heksagonalnie, zamknięte upakowane warstwy jonów są ułożone w naprzemiennej kolejności, zwykle nazywanej AB ABA ….. Każda trzecia warstwa jonów jest dokładnie taka sama jak warstwa pierwsza i leży bezpośrednio nad nią.
Każdy atom Mg jest otoczony przez 12 innych, równomiernie oddalonych od siebie jonów Mg. Stąd liczba koordynacyjna wynosi 12. W komórce jednostkowej około 26% dostępnej przestrzeni jest pusta (void). Struktura ta jest bardziej upakowana. Ze względu na mniejszą ilość pustej przestrzeni w strukturze krystalicznej, większą chmurę elektronową Mg+2 i silne wiązanie metaliczne, magnez jest twardszy od sodu. Jest bardziej plastyczny i ciągliwy niż sód.
Aluminium (Al):
Aluminium ma twarz centrowaną sześcienną (FCC) strukturę krystaliczną. Wiązanie jest niekierunkowe wiązanie metaliczne.

Aluminium jest ciałem stałym metalicznym. Jednostki zajmujące miejsca w sieci są jony Al i te jony są otoczone przez ruchome lub zdelokalizowane elektrony.
Układ jonów w jednej płaszczyźnie układ jonów jest sześciokątny lub zamknięta warstwa upakowana. Tak więc każdy jon metalu dotyka sześciu sąsiednich jonów w jednej płaszczyźnie.
W sześciennej strukturze kryształu close-packed lub face centred cubic, sekwencja close-packed warstw jonów powtarza się co czwartą warstwę. Tzn. każda czwarta warstwa jonów jest dokładnie taka sama jak pierwsza i leży bezpośrednio nad nią. Jest to zatem nazywane ABC, ABC, ABC, ABC, ….. cubic close packing. Cubic close packing jest również nazywany jako face centred close-packed struktury, ponieważ jeśli spojrzeć pod pewnym kątem, jony można uznać za bycie w ośmiu rogach sześcianu i w centrum każdego z sześciu twarzy sześcianu, tj. komórka jednostkowa.
Każdy jon aluminium (Al+3) jest otoczony przez 12 innych równej odległości atomy aluminium. Stąd liczba koordynacyjna wynosi 12. W komórce jednostkowej glinu około 26% dostępnej przestrzeni jest pusta (void). Ze względu na mniejszą ilość pustej przestrzeni w strukturze krystalicznej, silne wiązanie metaliczne, aluminium jest twardsze, bardziej plastyczne i ciągliwe niż sód i magnez.
Krzem (Si):
Ciała stałe kowalencyjne to krystaliczne ciała stałe, w których punktami sieci jednostkowej są atomy. Główną siłą wiążącą są wiązania kowalencyjne między atomami. Krzem jest ciałem stałym kowalencyjnym, w którym punkty kratowe są zajęte przez atomy pierwiastka. Krzem jest ciałem stałym sieciowym. Istnieje sieć wiązań kowalencyjnych Si-Si.
Liczba atomowa krzemu wynosi 14. Konfiguracja elektronowa krzemu w jego stanie podstawowym jest 1s2, 2s22p6, 3s2 3p2. Posiada cztery elektrony walencyjne na swoich orbitalach walencyjnych. Krzem ulega hybrydyzacji sp3 tworząc cztery orbitale zhybrydyzowane sp3 o jednakowej energii. Każdy atom krzemu tworzy cztery wiązania kowalencyjne z czterema innymi sąsiednimi atomami krzemu z powodu SP3- SP3 W ten sposób powstaje tetraedryczna jednostka Si4, która jest rozszerzona, tworząc trójwymiarową gigantyczną molekułę.

Wiązania Si -Si biegną nieprzerwanie przez cały kryształ. Tak więc kryształ krzemu jest uważany za gigantyczną trójwymiarową molekułę posiadającą tetraedryczną sieć atomów krzemu połączonych ze sobą silnymi wiązaniami kowalencyjnymi. Ciało stałe zawierające taką strukturę nazywane jest ciałem sieciowym. Kąt wiązania Si-Si wynosi 109 o 28 ’, a długość wiązania 2,35 o
Dzięki nakładaniu się orbitali hybrydowych, wiązania kowalencyjne Si-Si są bardzo silne i kierunkowe. Obecność sieci silnych wiązań kowalencyjnych odpowiada za twardość i jego wysoką temperaturę topnienia.
Elektrony w wiązaniu kowalencyjnym są zlokalizowane stąd krzem nie jest dobrym przewodnikiem elektryczności i ciepła. Ale jest to półprzewodnik. Ze względu na brak dostępności wolnych elektronów, krzem jest izolatorem w temperaturze zera bezwzględnego. Jednakże, krzem jest półprzewodnikiem. Jeśli temperatura jest zwiększona, wiązania kowalencyjne pękają elektrony uwolnione, które mogą przewodzić prąd. Tak więc przewodnictwo wzrasta wraz ze wzrostem temperatury.
Nauka > Chemia > Elementy trzeciego rzędu > Pojęcie wiązania metalicznego i metalicznych ciał stałych
.