Naturvidenskab > Kemi > Tredje række grundstoffer > Begrebet metalbinding og metalliske faste stoffer
I denne artikel vil vi studere begrebet metalbinding og metalbindinger i natrium-, magnesium- og aluminiumkrystaller.
Begrebet metallisk binding:
Den metalliske binding defineres som den tiltrækningskraft, der binder metalkationer til et antal mobile eller delokaliserede elektroner inden for dens indflydelsessfære, som holder metalkationerne sammen i et bestemt mønster. For at forklare metalbindingens natur blev der foreslået mange teorier. Teorien om frie elektroner eller elektronhavsteorien er en af de enkleste teorier, der blev foreslået af Drude og Lorentz. Nogle af de vigtige postulater i denne teori er som følger:
Fri elektronteori om metalbindinger:
Metalatomer har færre valenselektroner, så de har mange ledige valensorbitaler. Na, Mg og Al har 3p-orbitaler ledige.
| Navn | Symbol | Atomnr. | Elektronisk konfiguration | Detaljeret konfiguration | |
| Natrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 | |
| Magnesium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 | |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Ioniseringspotentialet for metaller er lavt, og derfor er valenselektronerne løst fastholdt og kan let fjernes. Den tæt pakkede struktur i metalkrystallen består af metallets atomer, som er identiske i alle henseender.
De ubesatte orbitaler af tæt pakkede atomer i metallet overlapper med de tilsvarende orbitaler hos de tilstødende atomer gennem krystalgitteret. Valenselektroner fjernes fra deres orbitaler og kan bevæge sig frit fra ledige valensorbitaler i det ene atom til det andet. Da disse valenselektroner ikke tilhører et enkelt atom, men krystallen som helhed, kaldes de delokaliserede eller mobile elektroner. De metalioner (kationer), der dannes på grund af delokalisering, kaldes kerner. Metalionerne har faste positioner i krystalgitteret, mens de delokaliserede elektroner er frie til at bevæge sig i krystalgitteret. Således kan metal betragtes som en aggregering af metalkationer nedsænket i et hav af mobile elektroner.
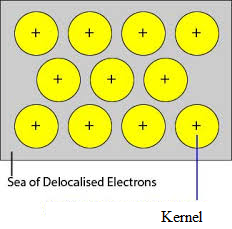
Da elektronerne i metallerne er delokaliserede, og de antages at være jævnt fordelt i hele krystalgitteret. Tiltrækningskræfterne mellem metalionerne og de delokaliserede elektroner er ensartede i alle retninger. Derfor er metalbindingen ikke retningsbestemt.
Enhederne, der besætter gitterpunkterne i natrium, magnesium og aluminium, er henholdsvis positive ioner af dem og er omgivet af mobile elektroner. Natrium, magnesium og aluminium er således metalliske faste stoffer.
Da vi bevæger os fra venstre mod højre, dvs. fra natrium til aluminium, stiger antallet af valenselektroner, og dermed stiger bindingsstyrken fra natrium til aluminium.
Egenskaberne som elektrisk og termisk ledningsevne, metallisk glans, smidighed og duktilitet kan forklares på grundlag af teorien om frie elektroner.
Karakteristika ved metalliske bindinger:
- Den metalliske binding er defineret som den tiltrækningskraft, der binder metalkationer til et antal mobile eller delokaliserede elektroner inden for dens indflydelsessfære, som holder metalkationerne sammen i et bestemt mønster.
- Den metalliske binding er ikke retningsbestemt.
- De er svagere end den kovalente binding, men stærkere end van der Waals kræfter.
- Bindingerne er ikke stive.
- Styrken af den metalliske binding er direkte relateret til den positive ladning på metalionen. Så styrken af metalbindingen stiger, når Na < Mg < Al.
Metalholdige faste stoffer:
Metalholdige faste stoffer er krystallinske faste stoffer, hvor de enheder, der besætter gitterpunkterne, er positive ioner omgivet af en pulje af elektroner. (Begrebet metalbinding)
Metalers krystalstrukturer:
Røntgenanalyser af forskellige metalliske krystaller har vist, at metaller antager en af følgende krystalstrukturer:
- Kropscentreret kubisk struktur. (BCC)
- Face centreret kubisk struktur. (FCC)
- Hexagonal tætpakket struktur. (HCP)
Natrium (Na):
Natriummetal har kropscentreret kubisk (BCC) åben pakkede krystalstruktur. Bindingen er ikke retningsbestemt metallisk binding.
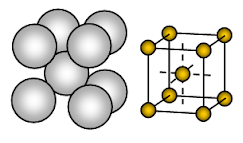
Anordningen af ioner i et plan- Cubic array – åben eller firkantet pakket struktur. I dette arrangement berører hver metalion fire tilstødende ioner i ét plan. Rækkefølgen af lagene er AB, AB, AB, AB, ……….
Natrium er et metallisk fast stof. I natriums enhedscelle er hver natriumion omgivet af otte andre natriumioner i lige stor afstand. Koordineringstallet er derfor 8. Disse natriumioner er anbragt i hjørnerne af en tænkt terning, og i midten af terningen er der én natriumion. Der er 2 ioner til stede i en enhedscelle af natrium.
Natriumionerne optager kun ca. 68 % af den tilgængelige plads i en enhedscelle. Så 32 % af enhedscellen forbliver tom (void). Da denne struktur har mere tomt rum, er metaller, der anvender denne struktur, bløde. Natrium er således et blødt metal på grund af mere tomrum (ca. 32 % ) i dets krystalstruktur og en ret svag metalbinding på grund af kun én valenselektron pr. Na-atom i dets krystal.
Magnesium (Mg):
Magnesium har en hexagonal tætpakket (HCP) krystalstruktur. Bindingen er ikke retningsbestemt metallisk binding.
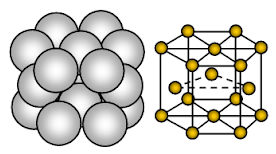
Magnesium er metallisk fast stof. De enheder, der besætter gitterpladser, er Mg-ioner, og disse ioner er omgivet af mobile eller delokaliserede elektroner.
Anordningen af ioner i et plan ionernes anbringelse er en hexagonal række eller et lukket pakket lag. Hver metalion berører således seks tilstødende ioner i ét plan. Hver magnesiumion berører seks magnesiumioner i sit eget lag, tre i det overliggende lag og tre i det underliggende lag. I den hexagonale pakkede struktur er de lukkede pakkede lag af ioner stablet i en vekslende rækkefølge, der normalt kaldes AB ABA ABA ….. Hvert tredje lag af ioner er nøjagtigt det samme som og ligger direkte over det første lag.
Hvert Mg-atom er omgivet af 12 andre Mg-ioner med lige stor afstand til hinanden. Koordineringstallet er derfor 12. I enhedscellen er ca. 26 % af det tilgængelige rum tomt (void). Denne struktur er mere tætpakket. På grund af mindre tomrum i krystalstrukturen, mere elektronsky på grund af Mg+2 og stærk metalbinding er magnesium hårdere end natriummetal. Det er mere formbart og duktilt end natrium.
Aluminium (Al):
Aluminium har en krystalstruktur af face centred cubic (FCC). Bindingen er ikke retningsbestemt metallisk binding.

Aluminium er metallisk faststof. De enheder, der besætter gitterpladser, er Al-ioner, og disse ioner er omgivet af mobile eller delokaliserede elektroner.
Anordningen af ioner i et plan ionernes anbringelse er en hexagonal række eller et lukket pakket lag. Hver metalion berører således seks tilstødende ioner i ét plan.
I en kubisk tætpakket eller fladcentreret kubisk krystalstruktur gentager sekvensen af tætpakkede lag af ioner sig hvert fjerde lag. Dvs. at hvert fjerde lag af ioner er nøjagtig det samme som og ligger direkte over det første lag. Den kaldes således ABC, ABC, ABC, ABC, ….. cubic close packing. Cubic close packing kaldes også for face centred close-packed structure, fordi ionerne, hvis de ses fra en bestemt vinkel, kan betragtes som værende i terningens otte hjørner og i midten af hver af terningens seks flader, dvs. enhedscellen.
Hver aluminiumion (Al+3) er omgivet af 12 andre aluminiumatomer i lige stor afstand. Koordineringstallet er derfor 12. I aluminiumets enhedscelle er ca. 26 % af det tilgængelige rum tomt (void). På grund af mindre tomrum i krystalstrukturen og stærke metalliske bindinger er aluminium hårdere, mere formbart og duktilt end natrium og magnesium.
Silicium (Si):
Kovalente faste stoffer er krystallinske faste stoffer, hvor enhedsgitterpunkterne er atomer. Den vigtigste bindingskraft er kovalente bindinger mellem atomer. Silicium er et kovalent fast stof, hvor gitterpunkterne er besat af atomerne i grundstoffet. Silicium er et netværksfast stof. Der er et netværk af Si-Si kovalente bindinger.
Atomtallet for silicium er 14. Elektronisk konfiguration af silicium i grundtilstanden er 1s2, 2s22p6, 3s2 3p2. Det har fire valenselektroner i deres valensorbitaler. Silicium gennemgår sp3-hybridisering og danner fire sp3-hybridiserede orbitaler med samme energi. Hvert siliciumatom danner fire kovalente bindinger med fire andre nabosiliciumatomer på grund af SP3- SP3 Der dannes således en tetraedrisk Si4-enhed, som udvides til at danne et tredimensionelt kæmpemolekyle.

Si -Si-bindingerne løber kontinuerligt gennem hele krystallen. Således betragtes en krystal af silicium som et kæmpemæssigt tredimensionelt molekyle med et tetraedrisk netværk af siliciumatomer, der er bundet sammen af stærke kovalente bindinger. Et fast stof, der indeholder en sådan struktur, kaldes et netværksfast stof. Si-Si bindingsvinklen er 109 o 28 ‘, mens bindingslængden er 2,35 o
På grund af overlapning af hybridorbitaler er Si-Si kovalente bindinger meget stærke og retningsbestemte. Tilstedeværelsen af et netværk af stærke kovalente bindinger forklarer hårdheden og det høje smeltepunkt.
Elektronerne i den kovalente binding er lokaliserede, og derfor er silicium ikke en god leder af elektricitet og varme. Men det er en halvleder. På grund af den manglende tilgængelighed af frie elektroner er silicium en isolator ved absolut nulpunktstemperatur. Men silicium er en halvleder. Hvis temperaturen øges, brydes kovalente bindinger, og der frigøres elektroner, som kan lede elektricitet. Ledningsevnen stiger således med stigende temperatur.