Šéfredaktor: Michael Gibson, M.S., M.D. ; Associate Editor(s)-in-Chief: C: Aparna Vuppala, M.B.B.S.
- Odmítnutí odpovědnosti
- Přehled
- Indikace a dávkování u dospělých
- Indikace a dávkování podle FDA (dospělí)
- Bolest hlavy
- Neužívané použití a dávkování (dospělí)
- Podporované použití
- Nepodporované použití
- Pediatrické indikace a dávkování
- Indikace a dávkování podle FDA (pediatrické)
- Neznačené použití a dávkování (pediatrické)
- Použití podporované doporučenými postupy
- Použití bez doporučeného postupu
- Kontraindikace
- Upozornění
- Léková závislost:
- Použití u ambulantních pacientů:
- Upozornění
- Nežádoucí účinky
- Zkušenosti z klinických studií
- Postmarketingové zkušenosti
- Lékové interakce
- Použití u specifických populací
- Těhotenství
- Porod a porod
- Kojící matky
- Pediatrické použití
- Geriatické použití
- Pohlaví
- Rasa
- Porucha funkce ledvin
- Porucha funkce jater
- Ženy s reprodukčním potenciálem a muži
- Pacienti s oslabenou imunitou
- Podávání a sledování
- Podávání
- Sledování
- IV kompatibilita
- Předávkování
- Farmakologie
- Mechanismus účinku
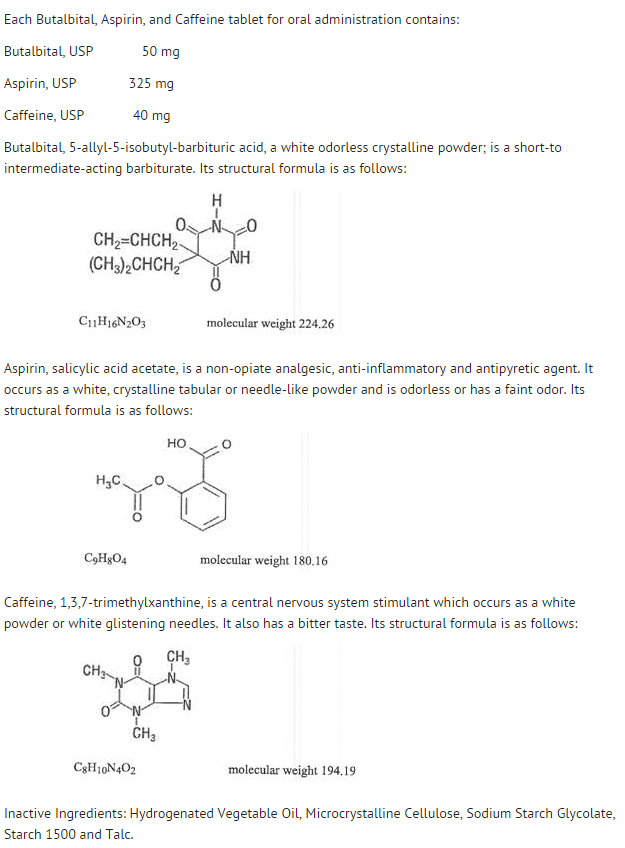
- Struktura
- Farmakodynamika
- Farmakokinetika
- Aspirin:
- Butalbital:
- Kofein:
- Neklinická toxikologie
- Klinické studie
- Jak se přípravek dodává
- Uchovávání
- Obrázky
- Obrázky léku
- Panel pro zobrazení obalu a etikety
- Informace pro pacienty
- Použití alkoholu
- Značkové názvy
- Značkové názvy podobných léků
- Stav nedostatku léčivých přípravků
Odmítnutí odpovědnosti
WikiDoc NEPOSKYTUJE ŽÁDNOU ZÁRUKU VALIDITY. WikiDoc není profesionálním poskytovatelem zdravotní péče ani vhodnou náhradou za licencovaného poskytovatele zdravotní péče. WikiDoc je určen jako vzdělávací nástroj, nikoliv jako nástroj pro jakoukoliv formu poskytování zdravotní péče. Vzdělávací obsah na stránkách WikiDoc o lécích vychází z příbalových informací FDA, obsahu Národní lékařské knihovny a praktických pokynů / konsenzuálních prohlášení. WikiDoc nepropaguje podávání žádného léku nebo přístroje, které není v souladu s jeho označením. Přečtěte si prosím naše úplné prohlášení o vyloučení odpovědnosti zde.
Přehled
Butalbital je kombinace, která je schválena FDA pro léčbu pro zmírnění komplexu příznaků tenzní (nebo svalové kontrakce) bolesti hlavy. Mezi časté nežádoucí účinky patří závratě a gastrointestinální poruchy včetně nevolnosti, zvracení a plynatosti, toxická epidermální nekrolýza a multiformní erytém.
Indikace a dávkování u dospělých
Indikace a dávkování podle FDA (dospělí)
Bolest hlavy
- Tablety butalbitalu, aspirinu a kofeinu jsou indikovány ke zmírnění komplexu příznaků tenzní (nebo svalové kontrakce) bolesti hlavy.
- Důkazy podporující účinnost a bezpečnost butalbitalu, aspirinu a kofeinu při léčbě vícečetných opakujících se bolestí hlavy nejsou k dispozici. V tomto ohledu je nutná opatrnost, protože butalbital vytváří návyk a je potenciálně zneužitelný.
Neužívané použití a dávkování (dospělí)
Podporované použití
Ohledně doporučeného použití butalbitalu u dospělých pacientů není dostatek informací.
Nepodporované použití
K dispozici jsou omezené informace týkající se nestandardního použití butalbitalu u dospělých pacientů.
Pediatrické indikace a dávkování
Indikace a dávkování podle FDA (pediatrické)
K dispozici jsou omezené informace týkající se použití butalbitalu podle FDA u pediatrických pacientů.
Neznačené použití a dávkování (pediatrické)
Použití podporované doporučenými postupy
K dispozici jsou omezené informace týkající se neznačeného použití butalbitalu u pediatrických pacientů.
Použití bez doporučeného postupu
Ohledně použití butalbitalu u pediatrických pacientů bez doporučeného postupu jsou k dispozici omezené informace.
Kontraindikace
- Přecitlivělost na aspirin, kofein nebo barbituráty. Pacienti s porfyrií.
Upozornění
Léková závislost:
- Dlouhodobé užívání barbiturátů může vyvolat lékovou závislost, charakterizovanou psychickou závislostí a méně často fyzickou závislostí a tolerancí. Zneužitelnost butalbitalu, aspirinu a kofeinu je podobná jako u jiných kombinací léčiv obsahujících barbituráty. Opatrnosti je třeba při předepisování léků pacientům se známým sklonem k užívání nadměrného množství léků, což není u pacientů s chronickou tenzní bolestí hlavy neobvyklé.
Použití u ambulantních pacientů:
- Butalbital, aspirin a kofein mohou zhoršit duševní a/nebo fyzické schopnosti potřebné pro vykonávání potenciálně nebezpečných úkolů, jako je řízení automobilu nebo obsluha strojů. Pacient by měl být odpovídajícím způsobem varován. Tlumivé účinky butalbitalu na centrální nervový systém mohou být aditivní s účinky jiných látek tlumících CNS. Je třeba se vyhnout současnému užívání s jinými sedativy-hypnotiky nebo alkoholem. Pokud je taková kombinovaná léčba nezbytná, může být nutné snížit dávku jedné nebo více látek.
Upozornění
- Salicyláty by měly být používány se zvláštní opatrností v případě peptického vředu nebo koagulačních abnormalit.
Nežádoucí účinky
Zkušenosti z klinických studií
- Nejčastějšími nežádoucími účinky jsou ospalost a závratě. Méně časté nežádoucí reakce jsou závratě a gastrointestinální poruchy včetně nevolnosti, zvracení a plynatosti. Při užívání butalbitalu, aspirinu a kofeinu byl hlášen ojedinělý výskyt suprese kostní dřeně. Bylo hlášeno několik případů dermatologických reakcí včetně toxické epidermální nekrolýzy a multiformního erytému.
Postmarketingové zkušenosti
Veškeré informace týkající se postmarketingových zkušeností s butalbitalem jsou v příbalové informaci omezené.
Lékové interakce
V příbalovém letáku jsou omezené informace týkající se lékových interakcí butalbitalu.
Použití u specifických populací
Těhotenství
Těhotenská kategorie (FDA): C
- Nebyly provedeny odpovídající studie na zvířatech, které by určily, zda tento léčivý přípravek ovlivňuje plodnost u mužů nebo žen, zda má teratogenní potenciál nebo jiné nežádoucí účinky na plod. I když neexistují dobře kontrolované studie u těhotných žen, více než dvacetileté marketingové a klinické zkušenosti neobsahují žádné pozitivní důkazy o nežádoucích účincích na plod. Přestože neexistuje jasně definované riziko, nelze na základě těchto zkušeností vyloučit možnost ojedinělého nebo nepatrného poškození lidského plodu. Butalbital, aspirin a kofein by měly být u těhotných žen používány pouze v případě jasné potřeby.
Těhotenská kategorie (AUS): Neexistují žádné pokyny Australského výboru pro hodnocení léčiv (ADEC) pro použití butalbitalu u těhotných žen.
Porod a porod
Neexistují žádné pokyny FDA pro použití butalbitalu během porodu.
Kojící matky
- Vliv butalbitalu, aspirinu a kofeinu na kojence kojících matek není znám. Salicyláty a barbituráty se vylučují do mateřského mléka kojících matek. Předpokládá se, že sérové hladiny u kojenců jsou při terapeutických dávkách nevýznamné.
Pediatrické použití
- Bezpečnost a účinnost u pediatrických pacientů mladších 12 let nebyla stanovena.
Geriatické použití
Neexistují žádné pokyny FDA týkající se použití butalbitalu s ohledem na geriatrické pacienty.
Pohlaví
Neexistují žádné pokyny FDA týkající se použití butalbitalu s ohledem na specifické populace pohlaví.
Rasa
Neexistují žádné pokyny FDA týkající se použití Butalbitalu s ohledem na specifické rasové populace.
Porucha funkce ledvin
Neexistují žádné pokyny FDA týkající se použití Butalbitalu u pacientů s poruchou funkce ledvin.
Porucha funkce jater
Neexistují žádné pokyny FDA týkající se použití Butalbitalu u pacientů s poruchou funkce jater.
Ženy s reprodukčním potenciálem a muži
Neexistují žádné pokyny FDA týkající se použití Butalbitalu u žen s reprodukčním potenciálem a mužů.
Pacienti s oslabenou imunitou
Neexistují žádné pokyny FDA týkající se použití Butalbitalu u pacientů s oslabenou imunitou.
Podávání a sledování
Podávání
- Orální
Sledování
V příbalové informaci k léčivému přípravku Butalbital jsou uvedeny jen omezené informace týkající se sledování.
IV kompatibilita
V příbalové informaci jsou omezené informace týkající se intravenózní kompatibility butalbitalu.
Předávkování
- Toxické účinky akutního předávkování butalbitalem, aspirinem a kofeinem lze přičíst především jeho barbiturátové složce a v menší míře aspirinu. Protože toxické účinky kofeinu se projevují pouze při velmi vysokých dávkách, je možnost významné toxicity kofeinu při předávkování butalbitalem, aspirinem a kofeinem nepravděpodobná. Mezi příznaky, které lze připsat akutní otravě barbituráty, patří ospalost, zmatenost a kóma; respirační deprese; hypotenze; šok. Mezi příznaky akutní otravy aspirinem patří hyperpnoe; poruchy acidobazické rovnováhy s rozvojem metabolické acidózy; zvracení a bolesti břicha; tinnitus; hypertermie; hypoprotrombinemie; neklid; delirium; křeče. Akutní otrava kofeinem může způsobit nespavost, neklid, třes a delirium; tachykardii a extrasystoly. Léčba spočívá především ve zvládnutí intoxikace barbituráty a v úpravě acidobazické nerovnováhy způsobené salicylismem. Zvracení by mělo být u pacienta při vědomí vyvoláno mechanicky nebo pomocí emetik. Výplach žaludku lze použít, pokud jsou přítomny faryngeální a laryngeální reflexy a pokud od požití uplynuly méně než 4 hodiny. Před výplachem žaludku pacienta v bezvědomí a v případě potřeby asistovaného dýchání by měla být zavedena endotracheální rourka s manžetou. Diuréza, alkalizace moči a korekce elektrolytových poruch by měla být provedena podáním intravenózních tekutin, jako je 1% bikarbonát sodný v 5% dextróze ve vodě. Pečlivou pozornost je třeba věnovat udržování adekvátní plicní ventilace. Korekce hypotenze může vyžadovat podání levartherenol bitartrátu nebo fenylefrin hydrochloridu intravenózní infuzí . V závažných případech intoxikace může být život zachraňující peritoneální dialýza, hemodialýza nebo výměnná transfuze. Hypoprotrombinemie by měla být léčena vitamínem K, intravenózně.
V příbalové informaci jsou omezené informace týkající se chronického předávkování butalbitalem.
Farmakologie
V příbalové informaci jsou omezené informace týkající se farmakologie butalbitalu.
Mechanismus účinku
- Farmakologicky butalbital, aspirin a kofein kombinuje analgetické vlastnosti aspirinu s anxiolytickými a svaly uvolňujícími vlastnostmi butalbitalu.
Klinická účinnost butalbitalu, aspirinu a kofeinu při tenzní bolesti hlavy byla stanovena ve dvojitě zaslepených, placebem kontrolovaných, multiklinických studiích. Studie s faktorovým designem porovnávala butalbital, aspirin a kofein s každou z jeho hlavních složek. Tato studie prokázala, že každá složka přispívá k účinnosti butalbitalu, aspirinu a kofeinu při léčbě cílových příznaků tenzní bolesti hlavy (bolest hlavy, psychické napětí a svalová kontrakce v oblasti hlavy, krku a ramen). U každého příznaku a komplexu příznaků jako celku se ukázalo, že butalbital, aspirin a kofein mají významně lepší klinické účinky než kterákoli ze složek samostatně.
Struktura
- Chování jednotlivých složek je popsáno níže.
- Systémová dostupnost aspirinu po perorální dávce je vysoce závislá na lékové formě, přítomnosti potravy, době vyprazdňování žaludku, žaludečním pH, antacidech, pufrovacích látkách a velikosti částic. Tyto faktory nemusí nutně ovlivňovat rozsah absorpce celkových salicylátů, ale spíše stabilitu aspirinu před absorpcí.
- Během absorpčního procesu a po absorpci se aspirin hydrolyzuje především na kyselinu salicylovou a distribuuje se do všech tělesných tkání a tekutin, včetně tkání plodu, mateřského mléka a centrálního nervového systému (CNS). Nejvyšší koncentrace se nacházejí v plazmě, játrech, kůře ledvin, srdci a plicích. V plazmě je přibližně 50-80 % kyseliny salicylové a jejích metabolitů volně vázáno na plazmatické bílkoviny.
- Klirens celkových salicylátů podléhá saturované kinetice, nicméně eliminační kinetika prvního řádu je stále dobrou aproximací pro dávky do 650 mg. Plazmatický poločas aspirinu je asi 12 minut a kyseliny salicylové a/nebo celkových salicylátů je asi 3,0 hodiny.
- Eliminace terapeutických dávek probíhá ledvinami buď ve formě kyseliny salicylové, nebo jiných produktů biotransformace. Renální clearance je výrazně zvýšena alkalickou močí, jaká vzniká při současném podávání hydrogenuhličitanu sodného nebo citrátu draselného.
- Biotransformace aspirinu probíhá především v hepatocytech. Hlavními metabolity jsou kyselina salicylová (75 %), fenolové a acylglukuronidy salicylátu (15 %) a kyselina gentisová a gentisurová (1 %). Biologická dostupnost aspirinové složky butalbitalu, aspirinu a kofeinu odpovídá biologické dostupnosti roztoku s výjimkou pomalejší rychlosti absorpce. Vrcholová koncentrace 8,80 mcg/ml byla dosažena za 40 minut po podání dávky 650 mg.
- Butalbital se dobře vstřebává z gastrointestinálního traktu a předpokládá se, že se distribuuje do většiny tkání v těle. Barbituráty se obecně mohou objevit v mateřském mléce a snadno procházejí placentární bariérou. V různé míře se vážou na plazmatické a tkáňové bílkoviny a vazba se zvyšuje přímo úměrně rozpustnosti v lipidech.
- Eliminace butalbitalu probíhá především ledvinami (59-88 % dávky) jako nezměněné léčivo nebo metabolity. Plazmatický poločas je přibližně 35 hodin. Produkty vylučování močí zahrnují mateřské léčivo (asi 3,6 % dávky), 5-isobutyl-5-(2,3-dihydroxypropyl) kyselinu barbiturovou (asi 24 % dávky), 5-allyl-5(3-hydroxy-2-methyl-1-propyl) kyselinu barbiturovou (asi 4,8 % dávky), produkty s hydrolyzovaným kruhem kyseliny barbiturové s vylučováním močoviny (asi 14 % dávky) a také neidentifikované materiály. Z materiálu vyloučeného močí bylo 32 % konjugováno.
- Biologická dostupnost butalbitalové složky butalbitalu, aspirinu a kofeinu odpovídá biologické dostupnosti roztoku s výjimkou snížení rychlosti absorpce. Vrcholové koncentrace 2020 ng/ml je dosaženo přibližně za 1,5 hodiny po podání 100 mg dávky.
- Vazba butalbitalu na plazmatické bílkoviny in vitro je 45 % v rozmezí koncentrací 0,5 až 20 mcg/ml. To spadá do rozmezí vazby na plazmatické bílkoviny (20 % až 45 %) uváděného u jiných barbiturátů, jako je fenobarbital, pentobarbital a sodná sůl sekobarbitalu. Poměr plazmatické a krevní koncentrace byl téměř jednotný, což naznačuje, že nedochází k přednostní distribuci butalbitalu ani do plazmy, ani do krevních buněk. (Informace o toxicitě viz OVERDOSAGE).
- Stejně jako většina xantinů se kofein rychle vstřebává a distribuuje do všech tělesných tkání a tekutin, včetně CNS, tkání plodu a mateřského mléka.
- Kofein se rychle odstraňuje metabolismem a vylučováním močí. Plazmatický poločas je přibližně 3,0 hodiny. Jaterní biotransformací před vylučováním vzniká přibližně stejné množství 1-methyl-xantinu a kyseliny 1-methylurové. Ze 70 % dávky, která byla získána zpět močí, byla pouze 3 % nezměněného léčiva.
- Biologická dostupnost kofeinové složky pro butalbital, aspirin a kofein je ekvivalentní biologické dostupnosti roztoku s výjimkou mírně delší doby do dosažení vrcholu. Vrcholové koncentrace 1660 ng/ml bylo dosaženo za méně než hodinu pro dávku 80 mg
- Butalbital, Aspirin, and Caffeine Tablets, USP 50 mg/325 mg/40 mg jsou bílé, kulaté, neděrované lisované tablety s potiskem „West-ward 785“.
- Uchovávejte při teplotě 20-25oC (68-77oF) . Chraňte před světlem a vlhkostí.
- Dávkujte v těsném obalu odolném proti světlu podle definice USP za použití uzávěru odolného proti otevření dětmi.
- Interakce alkoholu a butalbitalu nebyla stanovena. O účincích užívání alkoholu s tímto lékem se poraďte se svým lékařem.
Farmakodynamika
V příbalové informaci k léčivému přípravku Butalbital jsou uvedeny jen omezené informace týkající se farmakodynamiky.
Farmakokinetika
Aspirin:
Butalbital:
Kofein:
Neklinická toxikologie
V příbalové informaci jsou omezené informace týkající se neklinické toxikologie butalbitalu.
Klinické studie
V příbalové informaci jsou omezené informace týkající se klinických studií butalbitalu.
Jak se přípravek dodává
Lahve po 30 tabletáchLahve po 50 tabletáchLahve po 100 tabletáchLahve po 500 tabletáchLahve po 1000 tabletáchDávkovací krabičky po 100 tabletách
Uchovávání
V příbalové informaci k léčivému přípravku jsou uvedeny pouze omezené informace týkající se uchovávání butalbitalu.
Obrázky
Obrázky léku
Název léku: Butalbital, paracetamol a kofein
Složka(y): Butalbital, paracetamol a kofein: BUTALBITAL, ACETAMINOFEN, KAFEIN
Výtisk: Dávkování: Západní;oddělení;787
Dávkování: Barevné složení: 50 mg
Barva(y): Tvar: modrý
Tvar: Velikost (mm): 11
Složení: 1
NDC:01431787
Označení léku Autor: MUDr:

Název léku: West-Ward Pharmaceutical Corp: Butalbital, Aspirin a Kofein
Složka(y): Butalbital, Aspirin a Kofein: BUTALBITAL, ASPIRIN, KAFEIN
Výtisk: Dávkování: Západní;785
Dávkování: Barevné složení: 50 mg
Barva(y): Velikost (mm): 11
Složení: 1
NDC:01431785
Označení léku Autor: MUDr:

Název léku: West-ward Pharmaceutical Corp: Butalbital, Aspirin a Kofein
Složka(y): Butalbital, Aspirin a Kofein: BUTALBITAL, ASPIRIN, KAFEIN
Výtisk: WATSON;3219
Dosage: Barevné složení: 50 mg
Barva(y): Velikost (mm): 22
Složení: 1
NDC:05913219
Označení léku Autor: MUDr: Watson Laboratories, Inc.
Obrázek této tablety poskytla Národní lékařská knihovna PillBox.
Název léku: Butalbital, Aspirin a Kofein v tabletách
Složka(y): Butalbital, Aspirin a Kofein v tabletách: Obsahuje: ASPIRIN, BUTALBITAL, KAFEIN
Výtisk: Dávkování: Západní;oddělení;785
Dávkování: Barevné složení: 50 mg
Barva(y): Tvar: bílý
Tvar: bílý Velikost (mm): 7
Složení: 1
NDC:06032548
Označení léku Autor: MUDr:
Panel pro zobrazení obalu a etikety
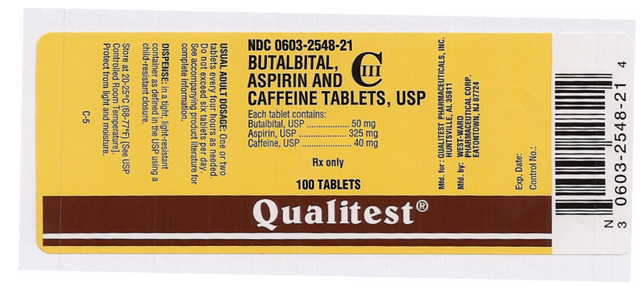
Tento obrázek etikety FDA poskytla Národní lékařská knihovna.

Tento obrázek štítku FDA poskytla Národní lékařská knihovna.
Informace pro pacienty
V příbalové informaci k léčivému přípravku Butalbital jsou uvedeny pouze omezené informace týkající se informací pro pacienty.
Použití alkoholu
Značkové názvy
V příbalové informaci jsou omezené informace týkající se značkových názvů butalbitalu.
Značkové názvy podobných léků
V příbalové informaci jsou omezené informace týkající se názvů podobných léků butalbitalu.
Stav nedostatku léčivých přípravků
.