Chefredakteur: C. Michael Gibson, M.S., M.D. ; Mitherausgeber(innen): Aparna Vuppala, M.B.B.S.
- Haftungsausschluss
- Übersicht
- Anwendungsgebiete und Dosierung bei Erwachsenen
- FDA-gekennzeichnete Anwendungsgebiete und Dosierung (Erwachsene)
- Kopfschmerzen
- Off-Label-Anwendung und Dosierung (Erwachsene)
- Leitliniengestützte Anwendung
- Nicht leitliniengestützte Anwendung
- Pädiatrische Indikationen und Dosierung
- FDA-gekennzeichnete Indikationen und Dosierung (Pädiatrie)
- Off-Label-Anwendung und Dosierung (Pädiatrie)
- Leitliniengestützte Anwendung
- Nicht leitliniengestützte Anwendung
- Kontraindikationen
- Warnungen
- Drogenabhängigkeit:
- Verwendung bei ambulanten Patienten:
- Vorsichtsmaßnahmen
- Nebenwirkungen
- Erfahrungen aus klinischen Studien
- Erfahrungen nach der Markteinführung
- Arzneimittelwechselwirkungen
- Verwendung in bestimmten Bevölkerungsgruppen
- Schwangerschaft
- Labor und Entbindung
- Stillende Mütter
- Pädiatrische Anwendung
- Geriatrische Anwendung
- Geschlecht
- Rasse
- Nierenschwäche
- Leberschwäche
- Frauen im fortpflanzungsfähigen Alter und Männer
- Immunsupprimierte Patienten
- Verabreichung und Überwachung
- Verabreichung
- Überwachung
- IV-Verträglichkeit
- Überdosierung
- Pharmakologie
- Wirkungsmechanismus
- Struktur
- Pharmakodynamik
- Pharmakokinetik
- Aspirin:
- Butalbital:
- Koffein:
- Nichtklinische Toxikologie
- Klinische Studien
- Lieferform
- Lagerung
- Bilder
- Abbildungen
- Packung und Etikettenanzeige
- Patient Counseling Information
- Vorsichtsmaßnahmen bei Alkohol
- Markennamen
- Look-Alike Drug Names
- Drug Shortage Status
Haftungsausschluss
WikiDoc gibt keine Garantie für die Gültigkeit. WikiDoc ist weder ein professioneller Gesundheitsdienstleister, noch ist es ein geeigneter Ersatz für einen zugelassenen Gesundheitsdienstleister. WikiDoc ist als pädagogisches Werkzeug gedacht, nicht als Werkzeug für irgendeine Form der Gesundheitsversorgung. Der lehrreiche Inhalt der WikiDoc-Arzneimittelseiten basiert auf der FDA-Packungsbeilage, dem Inhalt der National Library of Medicine und Praxisrichtlinien / Konsenserklärungen. WikiDoc fördert nicht die Verabreichung von Medikamenten oder Geräten, die nicht mit ihrer Kennzeichnung übereinstimmen. Bitte lesen Sie unseren vollständigen Haftungsausschluss hier.
Übersicht
Butalbital ist eine Kombination, die von der FDA zur Behandlung des Symptomenkomplexes Spannungskopfschmerz (oder Muskelkontraktion) zugelassen ist. Zu den häufigen unerwünschten Wirkungen gehören Benommenheit und gastrointestinale Störungen wie Übelkeit, Erbrechen und Blähungen, toxische epidermale Nekrolyse und Erythema multiforme.
Anwendungsgebiete und Dosierung bei Erwachsenen
FDA-gekennzeichnete Anwendungsgebiete und Dosierung (Erwachsene)
Kopfschmerzen
- Butalbital, Aspirin und Koffeintabletten sind indiziert zur Linderung des Symptomenkomplexes von Spannungs- (oder Muskelkontraktions-) Kopfschmerzen.
- Es liegen keine Belege für die Wirksamkeit und Sicherheit von Butalbital, Aspirin und Koffein bei der Behandlung von mehrfach wiederkehrenden Kopfschmerzen vor. Diesbezüglich ist Vorsicht geboten, da Butalbital gewohnheitsbildend und potenziell missbräuchlich ist.
Off-Label-Anwendung und Dosierung (Erwachsene)
Leitliniengestützte Anwendung
Es liegen nur begrenzte Informationen über die leitliniengestützte Off-Label-Anwendung von Butalbital bei erwachsenen Patienten vor.
Nicht leitliniengestützte Anwendung
Es liegen nur begrenzte Informationen über die nicht leitliniengestützte Off-Label-Anwendung von Butalbital bei erwachsenen Patienten vor.
Pädiatrische Indikationen und Dosierung
FDA-gekennzeichnete Indikationen und Dosierung (Pädiatrie)
Es liegen nur begrenzte Informationen über die FDA-gekennzeichnete Anwendung von Butalbital bei pädiatrischen Patienten vor.
Off-Label-Anwendung und Dosierung (Pädiatrie)
Leitliniengestützte Anwendung
Es liegen nur begrenzte Informationen zur leitliniengestützten Off-Label-Anwendung von Butalbital bei pädiatrischen Patienten vor.
Nicht leitliniengestützte Anwendung
Es liegen nur begrenzte Informationen über die nicht leitliniengestützte Off-Label-Anwendung von Butalbital bei pädiatrischen Patienten vor.
Kontraindikationen
- Überempfindlichkeit gegen Aspirin, Koffein oder Barbiturate. Patienten mit Porphyrie.
Warnungen
Drogenabhängigkeit:
- Längerer Gebrauch von Barbituraten kann zu einer Drogenabhängigkeit führen, die durch psychische Abhängigkeit und seltener durch körperliche Abhängigkeit und Toleranz gekennzeichnet ist. Die Missbrauchsanfälligkeit von Butalbital, Aspirin und Koffein ist ähnlich wie bei anderen Barbiturat-haltigen Arzneimittelkombinationen. Vorsicht ist geboten bei der Verschreibung von Medikamenten für Patienten mit einer bekannten Neigung zur übermäßigen Einnahme von Arzneimitteln, was bei Patienten mit chronischen Spannungskopfschmerzen nicht ungewöhnlich ist.
Verwendung bei ambulanten Patienten:
- Butalbital, Aspirin und Koffein können die geistigen und/oder körperlichen Fähigkeiten beeinträchtigen, die für die Durchführung potenziell gefährlicher Aufgaben, wie z.B. das Führen eines Autos oder das Bedienen von Maschinen, erforderlich sind. Der Patient sollte entsprechend gewarnt werden. Die dämpfenden Wirkungen von Butalbital auf das zentrale Nervensystem können sich mit denen anderer ZNS-Dämpfungsmittel addieren. Die gleichzeitige Anwendung mit anderen Sedativa/Hypnotika oder Alkohol sollte vermieden werden. Wenn eine solche Kombinationstherapie notwendig ist, muss möglicherweise die Dosis eines oder mehrerer Wirkstoffe reduziert werden.
Vorsichtsmaßnahmen
- Salicylate sollten bei Vorliegen von Magengeschwüren oder Gerinnungsstörungen mit äußerster Vorsicht angewendet werden.
Nebenwirkungen
Erfahrungen aus klinischen Studien
- Die häufigsten unerwünschten Wirkungen sind Schläfrigkeit und Schwindelgefühl. Weniger häufige Nebenwirkungen sind Benommenheit und gastrointestinale Störungen einschließlich Übelkeit, Erbrechen und Blähungen. Im Zusammenhang mit der Einnahme von Butalbital, Aspirin und Koffein wurde ein einziges Mal über eine Knochenmarksuppression berichtet. Mehrere Fälle von dermatologischen Reaktionen, einschließlich toxischer epidermaler Nekrolyse und Erythema multiforme, wurden berichtet.
Erfahrungen nach der Markteinführung
Es gibt nur begrenzte Informationen über Erfahrungen nach der Markteinführung von Butalbital in der Arzneimittelzulassung.
Arzneimittelwechselwirkungen
Es gibt begrenzte Informationen zu den Wechselwirkungen von Butalbital in der Fachinformation.
Verwendung in bestimmten Bevölkerungsgruppen
Schwangerschaft
Schwangerschaftskategorie (FDA): C
- Es wurden keine ausreichenden Studien an Tieren durchgeführt, um festzustellen, ob dieses Arzneimittel die Fruchtbarkeit bei männlichen oder weiblichen Tieren beeinträchtigt, ein teratogenes Potential hat oder andere nachteilige Auswirkungen auf den Fötus hat. Es gibt zwar keine gut kontrollierten Studien an schwangeren Frauen, aber mehr als zwanzig Jahre Marketing und klinische Erfahrung enthalten keine positiven Hinweise auf schädliche Auswirkungen auf den Fötus. Obwohl es kein klar definiertes Risiko gibt, können diese Erfahrungen die Möglichkeit einer seltenen oder subtilen Schädigung des menschlichen Fötus nicht ausschließen. Butalbital, Aspirin und Koffein sollten bei schwangeren Frauen nur angewendet werden, wenn dies eindeutig erforderlich ist.
Schwangerschaftskategorie (AUS): Es gibt keinen Leitfaden des Australian Drug Evaluation Committee (ADEC) zur Anwendung von Butalbital bei schwangeren Frauen.
Labor und Entbindung
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital während der Wehen und der Entbindung.
Stillende Mütter
- Die Auswirkungen von Butalbital, Aspirin und Koffein auf Säuglinge stillender Mütter sind nicht bekannt. Salicylate und Barbiturate werden in die Muttermilch stillender Mütter ausgeschieden. Es wird angenommen, dass die Serumspiegel bei Säuglingen bei therapeutischen Dosen unbedeutend sind.
Pädiatrische Anwendung
- Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 12 Jahren wurde nicht nachgewiesen.
Geriatrische Anwendung
Es gibt keine FDA-Leitlinien für die Anwendung von Butalbital bei geriatrischen Patienten.
Geschlecht
Es gibt keine FDA-Leitlinien für die Anwendung von Butalbital in Bezug auf bestimmte Geschlechtergruppen.
Rasse
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital in Bezug auf bestimmte rassische Bevölkerungsgruppen.
Nierenschwäche
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital bei Patienten mit Nierenschwäche.
Leberschwäche
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital bei Patienten mit Leberschwäche.
Frauen im fortpflanzungsfähigen Alter und Männer
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital bei Frauen im fortpflanzungsfähigen Alter und bei Männern.
Immunsupprimierte Patienten
Es gibt keinen FDA-Leitfaden zur Anwendung von Butalbital bei Patienten, die immunsupprimiert sind.
Verabreichung und Überwachung
Verabreichung
- Oral
Überwachung
Es gibt nur begrenzte Informationen über die Überwachung von Butalbital in der Arzneimittelbezeichnung.
IV-Verträglichkeit
Es liegen nur begrenzte Informationen zur IV-Verträglichkeit von Butalbital in der Fachinformation vor.
Überdosierung
- Die toxischen Wirkungen einer akuten Überdosierung von Butalbital, Aspirin und Koffein sind hauptsächlich auf die Barbiturat-Komponente und in geringerem Maße auf Aspirin zurückzuführen. Da toxische Wirkungen von Koffein nur bei sehr hohen Dosierungen auftreten, ist die Möglichkeit einer signifikanten Koffeintoxizität bei einer Überdosierung von Butalbital, Aspirin und Koffein unwahrscheinlich. Zu den Symptomen einer akuten Barbituratvergiftung gehören Schläfrigkeit, Verwirrung und Koma, Atemdepression, Hypotonie und Schock. Zu den Symptomen einer akuten Aspirinvergiftung gehören Hyperpnoe, Säure-Basen-Störungen mit Entwicklung einer metabolischen Azidose, Erbrechen und Bauchschmerzen, Tinnitus, Hyperthermie, Hypoprothrombinämie, Unruhe, Delirium, Krämpfe. Eine akute Koffeinvergiftung kann Schlaflosigkeit, Unruhe, Zittern und Delirium, Tachykardie und Extrasystolen verursachen. Die Behandlung besteht in erster Linie in der Behandlung der Barbiturat-Intoxikation und der Korrektur des Säure-Basen-Ungleichgewichts aufgrund des Salicylismus. Bei bewussten Patienten sollte das Erbrechen mechanisch oder mit Brechmitteln herbeigeführt werden. Eine Magenspülung kann durchgeführt werden, wenn die Rachen- und Kehlkopfreflexe vorhanden sind und weniger als 4 Stunden seit der Einnahme vergangen sind. Bei bewusstlosen Patienten sollte vor der Magenspülung ein Endotrachealtubus mit Manschette eingelegt werden, wenn dies zur Unterstützung der Beatmung erforderlich ist. Diurese, Alkalisierung des Urins und Korrektur von Elektrolytstörungen sollten durch die Verabreichung intravenöser Flüssigkeiten wie 1% Natriumbicarbonat in 5% Dextrose in Wasser erreicht werden. Auf die Aufrechterhaltung einer angemessenen Lungenventilation sollte sorgfältig geachtet werden. Die Korrektur der Hypotonie kann die Verabreichung von Levartherenolbitartrat oder Phenylephrinhydrochlorid durch intravenöse Infusion erfordern. In schweren Vergiftungsfällen kann eine Peritonealdialyse, Hämodialyse oder Austauschtransfusion lebensrettend sein. Hypoprothrombinämie sollte mit Vitamin K, intravenös behandelt werden.
Es gibt begrenzte Informationen bezüglich der chronischen Überdosierung von Butalbital in der Arzneimittelbezeichnung.
Pharmakologie
Es gibt begrenzte Informationen bezüglich der Pharmakologie von Butalbital in der Arzneimittelbezeichnung.
Wirkungsmechanismus
- Pharmakologisch kombiniert Butalbital, Aspirin und Koffein die analgetischen Eigenschaften von Aspirin mit den anxiolytischen und muskelentspannenden Eigenschaften von Butalbital.
Die klinische Wirksamkeit von Butalbital, Aspirin und Koffein bei Spannungskopfschmerz wurde in doppelblinden, placebokontrollierten, multiklinischen Studien nachgewiesen. In einer Studie mit faktoriellem Design wurden Butalbital, Aspirin und Koffein mit jedem ihrer Hauptbestandteile verglichen. Diese Studie zeigte, dass jede Komponente zur Wirksamkeit von Butalbital, Aspirin und Koffein bei der Behandlung der Zielsymptome von Spannungskopfschmerzen (Kopfschmerz, psychische Anspannung und Muskelkontraktion im Kopf-, Nacken- und Schulterbereich) beiträgt. Für jedes Symptom und den Symptomkomplex als Ganzes zeigte sich, dass Butalbital, Aspirin und Koffein eine signifikant bessere klinische Wirkung hatten als jede Komponente allein.
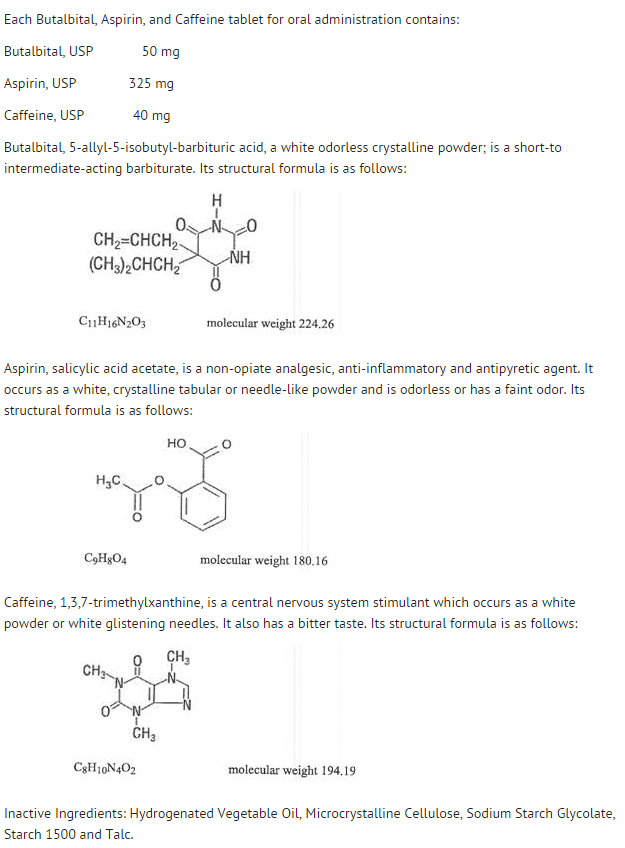
Struktur
- Das Verhalten der einzelnen Bestandteile wird im Folgenden beschrieben.
- Die systemische Verfügbarkeit von Aspirin nach einer oralen Dosis ist in hohem Maße abhängig von der Darreichungsform, dem Vorhandensein von Nahrung, der Magenentleerungszeit, dem pH-Wert des Magens, Antazida, Puffermitteln und der Partikelgröße. Diese Faktoren beeinflussen nicht unbedingt das Ausmaß der Absorption der gesamten Salicylate, sondern vielmehr die Stabilität von Aspirin vor der Absorption.
- Während des Absorptionsprozesses und nach der Absorption wird Aspirin hauptsächlich zu Salicylsäure hydrolysiert und in allen Körpergeweben und -flüssigkeiten verteilt, einschließlich fötalen Geweben, Muttermilch und dem zentralen Nervensystem (ZNS). Die höchsten Konzentrationen finden sich in Plasma, Leber, Nierenrinde, Herz und Lunge. Im Plasma sind etwa 50-80 % der Salicylsäure und ihrer Metaboliten lose an Plasmaproteine gebunden.
- Die Clearance der gesamten Salicylate unterliegt einer sättigbaren Kinetik; die Eliminationskinetik erster Ordnung ist jedoch für Dosen bis zu 650 mg eine gute Annäherung. Die Plasmahalbwertszeit für Aspirin beträgt etwa 12 Minuten und für Salicylsäure und/oder Gesamtsalicylate etwa 3,0 Stunden.
- Die Ausscheidung therapeutischer Dosen erfolgt über die Nieren entweder als Salicylsäure oder als andere Biotransformationsprodukte. Die renale Clearance wird durch einen alkalischen Urin, wie er durch die gleichzeitige Verabreichung von Natriumbicarbonat oder Kaliumcitrat erzeugt wird, stark erhöht.
- Die Biotransformation von Aspirin erfolgt hauptsächlich in den Hepatozyten. Die wichtigsten Metaboliten sind Salicylursäure (75 %), die Phenol- und Acylglucuronide von Salicylat (15 %) sowie Gentisinsäure und Gentisursäure (1 %). Die Bioverfügbarkeit der Aspirin-Komponente Butalbital, Aspirin und Koffein entspricht der einer Lösung, mit Ausnahme einer langsameren Absorptionsrate. Eine Spitzenkonzentration von 8,80 mcg/ml wurde 40 Minuten nach einer Dosis von 650 mg erreicht.
- Butalbital wird gut aus dem Magen-Darm-Trakt resorbiert und verteilt sich voraussichtlich in den meisten Geweben des Körpers. Barbiturate können im Allgemeinen in die Muttermilch übergehen und die Plazentaschranke leicht überwinden. Sie werden in unterschiedlichem Maße an Plasma- und Gewebeproteine gebunden, wobei die Bindung in Abhängigkeit von der Lipidlöslichkeit direkt zunimmt.
- Die Ausscheidung von Butalbital erfolgt hauptsächlich über die Niere (59%-88% der Dosis) als unveränderte Droge oder Metaboliten. Die Plasmahalbwertszeit beträgt etwa 35 Stunden. Zu den mit dem Urin ausgeschiedenen Produkten gehören die Stammdroge (ca. 3,6 % der Dosis), 5-Isobutyl-5-(2,3-dihydroxypropyl)-Barbitursäure (ca. 24 % der Dosis), 5-Allyl-5-(3-hydroxy-2-methyl-1-propyl)-Barbitursäure (ca. 4,8 % der Dosis), Produkte, bei denen der Barbitursäurering mit der Ausscheidung von Harnstoff hydrolysiert wurde (ca. 14 % der Dosis), sowie nicht identifiziertes Material. Von den im Urin ausgeschiedenen Stoffen waren 32 % konjugiert.
- Die Bioverfügbarkeit der Butalbital-Komponente von Butalbital, Aspirin und Koffein entspricht der einer Lösung, abgesehen von einer Verringerung der Absorptionsrate. Eine Spitzenkonzentration von 2020 ng/ml wird etwa 1,5 Stunden nach einer Dosis von 100 mg erreicht.
- Die In-vitro-Plasmaproteinbindung von Butalbital beträgt 45 % über den Konzentrationsbereich von 0,5 bis 20 mcg/ml. Dies fällt in den Bereich der Plasmaproteinbindung (20 % bis 45 %), der für andere Barbiturate wie Phenobarbital, Pentobarbital und Secobarbital-Natrium berichtet wurde. Das Verhältnis von Plasma- zu Blutkonzentration war fast gleich, was darauf hindeutet, dass es keine bevorzugte Verteilung von Butalbital in Plasma oder Blutzellen gibt. (siehe OVERDOSAGE für Informationen zur Toxizität).
- Wie die meisten Xanthine wird Koffein schnell absorbiert und in allen Körpergeweben und -flüssigkeiten verteilt, einschließlich des ZNS, fötalen Gewebes und der Muttermilch.
- Koffein wird schnell durch Metabolismus und Ausscheidung im Urin abgebaut. Die Plasmahalbwertszeit beträgt etwa 3,0 Stunden. Die hepatische Biotransformation vor der Ausscheidung führt zu etwa gleichen Mengen an 1-Methyl-Xanthin und 1-Methyluronsäure. Von den 70 % der Dosis, die im Urin wiedergefunden wurden, waren nur 3 % unverändertes Arzneimittel.
- Die Bioverfügbarkeit der Koffeinkomponente von Butalbital, Aspirin und Koffein entspricht der einer Lösung, mit Ausnahme einer etwas längeren Zeit bis zum Erreichen des Spitzenwertes. Eine Spitzenkonzentration von 1660 ng/ml wurde in weniger als einer Stunde für eine Dosis von 80 mg erreicht
- Butalbital, Aspirin und Koffein Tabletten, USP 50 mg/325 mg/40 mg sind weiße, runde, ungekerbte gepresste Tabletten mit dem Aufdruck „West-ward 785“.
- Bei 20-25oC (68-77oF) lagern. Vor Licht und Feuchtigkeit schützen.
- In dichten, lichtbeständigen Behältern gemäß der USP mit kindersicherem Verschluss aufbewahren.
- Wechselwirkungen zwischen Alkohol und Butalbital sind nicht bekannt. Sprechen Sie mit Ihrem Arzt über die Auswirkungen der Einnahme von Alkohol mit diesem Medikament.
Pharmakodynamik
Es gibt nur begrenzte Informationen über die Pharmakodynamik von Butalbital in der Arzneimittelbezeichnung.
Pharmakokinetik
Aspirin:
Butalbital:
Koffein:
Nichtklinische Toxikologie
Es gibt begrenzte Informationen zur nichtklinischen Toxikologie von Butalbital in der Fachinformation.
Klinische Studien
Es gibt begrenzte Informationen zu klinischen Studien von Butalbital in der Fachinformation.
Lieferform
Flaschen mit 30 TablettenFlaschen mit 50 TablettenFlaschen mit 100 TablettenFlaschen mit 500 TablettenFlaschen mit 1000 TablettenEinheitsdosis-Boxen mit 100 Tabletten
Lagerung
Es gibt begrenzte Informationen bezüglich der Lagerung von Butalbital in der Arzneimittelbeschreibung.
Bilder
Abbildungen
Arzneimittelbezeichnung: Butalbital, Acetaminophen und Koffein
Bestandteil(e): BUTALBITAL, ACETAMINOPHEN, KASFFEIN
Impressum: West;ward;787
Dosierung: 50 mg
Farbe(n): Blau
Form: Rund
Größe (mm): 11
Punktzahl: 1
NDC:01431787
Medikamentenetikett Autor: West-Ward Pharmaceutical Corp
Dieses Pillenbild wird von der PillBox der National Library of Medicine zur Verfügung gestellt.

Medikamentenname: Butalbital, Aspirin und Koffein
Inhaltsstoff(e): BUTALBITAL, ASPIRIN, KASFFEIN
Impressum: Westward;785
Dosierung: 50 mg
Farbe(n): Weiß
Form: Rund
Größe (mm): 11
Punktzahl: 1
NDC:01431785
Medikamentenetikett Autor: West-ward Pharmaceutical Corp
Dieses Pillenbild wird von der PillBox der National Library of Medicine zur Verfügung gestellt.

Medikamentenname: Butalbital, Aspirin und Koffein
Bestandteil(e): BUTALBITAL, ASPIRIN, CAFFEIN
Impressum: WATSON;3219
Dosage: 50 mg
Farbe(n): Grün, Gelb
Form: Kapsel
Größe (mm): 22
Punktzahl: 1
NDC:05913219
Medikamentenetikett Autor: Watson Laboratories, Inc.
Dieses Pillenbild wird von der PillBox der National Library of Medicine zur Verfügung gestellt.
Medikamentenname: Butalbital, Aspirin und Koffeintabletten
Bestandteil(e): ASPIRIN, BUTALBITAL, CAFFEINE
Impressum: West;ward;785
Dosierung: 50 mg
Farbe(n): Weiß
Form: Rund
Größe (mm): 7
Punktzahl: 1
NDC:06032548
Medikamentenetikett Autor: Qualitest
Dieses Pillenbild wird von der PillBox der National Library of Medicine zur Verfügung gestellt.
Packung und Etikettenanzeige
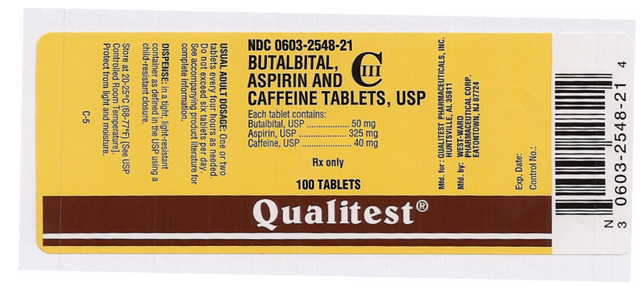
Dieses Bild des FDA-Etiketts wird von der National Library of Medicine zur Verfügung gestellt.

Dieses Bild des FDA-Etiketts wird von der National Library of Medicine zur Verfügung gestellt.
Patient Counseling Information
Es gibt begrenzte Informationen über Patient Counseling Information von Butalbital in der Arzneimittelbezeichnung.
Vorsichtsmaßnahmen bei Alkohol
Markennamen
Es gibt begrenzte Informationen über Butalbital Markennamen in der Droge label.
Look-Alike Drug Names
Es gibt begrenzte Informationen über Butalbital Look-Alike Drug Names in der Droge label.