Editor-em-Chefe: C. Michael Gibson, M.S., M.D. ; Editor(es)-em-Chefe Associado(s)-em-Chefe: Aparna Vuppala, M.B.B.S.
- Disclaimer
- Overview
- Indicações Adultas e Dosagem
- Indicações e Dosagem rotuladas pela FDA (Adulto)
- Cefaléia
- Uso e dosagem fora do rótulo (adulto)
- Uso suportado pela linha lateral
- Uso Não-Obotalbital Não-Obotalbital em pacientes adultos Indicações e Dosagem Pediátrica Indicações e Dosagem (Pediátrica) rotuladas pelo FDA
- Uso e dosagem fora do rótulo (Pediátrico)
- Uso suportado pelo FDA
- Uso Não-Comportado por Guias
- Contraindicações
- Avencimentos
- Dependência de drogas:
- Uso em pacientes ambulatoriais:
- Precauções
- Reacções adversas
- Experiência de ensaios clínicos clínicos
- Postmarketing Experience
- Interações com Drogas
- Uso em populações específicas
- Pregnância
- Labor e parto
- Mães amamentadoras
- Uso Pediátrico
- Uso Geriátrico
- Gênero
- Raça
- Imparidade renal
- Imparidade hepática
- Fêmeas de Potencial Reprodutor e Machos
- Pacientes imunocomprometidos
- Administração e Monitoramento
- Administração
- Monitoramento
- Compatibilidade IV
- Overdose
- Farmacologia
- Mecanismo de Ação
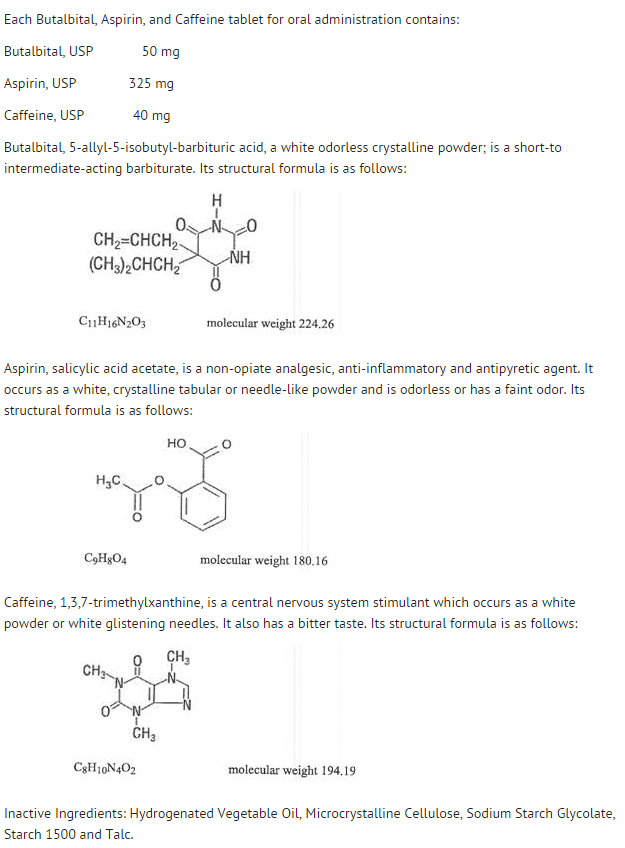
- Estrutura
- Farmacodinâmica
- Farmacocinética
- Aspirina:
- Butalbital:
- Cafeína:
- Nonclinical Toxicology
- Estudos Clínicos
- Como Fornecido
- Armazenamento
- Imagens
- Fotos de Drogas
- Pacote e Rótulo do Painel
- Informação de Aconselhamento Paciente
- Precauções com Álcool
- Nomes de marcas
- Nomes de drogas semelhantes a Butalbital
- Situação de falta de álcool
Disclaimer
WikiDoc NÃO FAZ QUALQUER GARANTIA DE VALIDADE. A WikiDoc não é um profissional de saúde, nem é um substituto adequado para um profissional de saúde licenciado. O WikiDoc pretende ser uma ferramenta educacional, não uma ferramenta para qualquer forma de prestação de cuidados de saúde. O conteúdo educacional nas páginas de medicamentos do WikiDoc é baseado no folheto do FDA, no conteúdo da Biblioteca Nacional de Medicina e nas diretrizes de prática / declarações de consenso. O WikiDoc não promove a administração de qualquer medicamento ou dispositivo que não seja consistente com a sua rotulagem. Por favor, leia nosso termo de responsabilidade aqui.
Overview
Butalbital é uma combinação que é aprovada pelo FDA para o tratamento do complexo de sintomas de tensão (ou contração muscular) dor de cabeça. Reações adversas comuns incluem vertigem e distúrbios gastrointestinais, incluindo náuseas, vômitos e flatulência, necrólise epidérmica tóxica e eritema multiforme.
Indicações Adultas e Dosagem
Indicações e Dosagem rotuladas pela FDA (Adulto)
Cefaléia
- Comprimidos butalbital, aspirina, e cafeína são indicados para o alívio do complexo de sintomas de tensão (ou contração muscular) dor de cabeça.
- Eficácia e segurança de butalbital, aspirina, e cafeína no tratamento de múltiplas dores de cabeça recorrentes não está disponível. Cuidado a este respeito é necessário porque o butalbital é formador de hábitos e potencialmente abusivo.
Uso e dosagem fora do rótulo (adulto)
Uso suportado pela linha lateral
Existe informação limitada sobre o uso de butalbital fora do rótulo em pacientes adultos.
Uso Não-Obotalbital Não-Obotalbital em pacientes adultos
Indicações e Dosagem Pediátrica
Indicações e Dosagem (Pediátrica) rotuladas pelo FDA
Existem informações limitadas sobre o Uso de Butalbital em pacientes pediátricos rotulados pelo FDA.
Uso e dosagem fora do rótulo (Pediátrico)
Uso suportado pelo FDA
Há informação limitada sobre o uso de Butalbital fora do rótulo em pacientes pediátricos.
Uso Não-Comportado por Guias
Há informação limitada sobre o Uso Não-Comportado por Guias Não-Comportado por Guias Butalbital em pacientes pediátricos.
Contraindicações
- Hipersensibilidade à aspirina, cafeína ou barbitúricos. Pacientes com porfíria.
Avencimentos
Dependência de drogas:
- O uso prolongado de barbitúricos pode produzir dependência de drogas, caracterizada pela dependência psíquica, e menos frequentemente, dependência física e tolerância. A responsabilidade do abuso de butalbital, aspirina e cafeína é semelhante à de outras combinações de drogas contendo barbitúricos. Cuidado deve ser tomado ao prescrever medicamentos para pacientes com uma propensão conhecida para tomar quantidades excessivas de drogas, o que não é incomum em pacientes com dor de cabeça de tensão crônica.
Uso em pacientes ambulatoriais:
- Butalbital, aspirina e cafeína podem prejudicar as habilidades mentais e/ou físicas necessárias para o desempenho de tarefas potencialmente perigosas, como dirigir um carro ou operar máquinas. O paciente deve ser alertado em conformidade. Os efeitos depressores do sistema nervoso central do butalbital podem ser aditivos com os de outros depressores do SNC. O uso simultâneo com outros sedativos-hipnóticos ou álcool deve ser evitado. Quando tal terapia combinada é necessária, a dose de um ou mais agentes pode precisar ser reduzida.
Precauções
- Salicilatos devem ser usados com extremo cuidado na presença de úlcera péptica ou anormalidades de coagulação.
Reacções adversas
Experiência de ensaios clínicos clínicos
- As reacções adversas mais frequentes são sonolência e tonturas. As reacções adversas menos frequentes são tonturas e distúrbios gastrointestinais incluindo náuseas, vómitos e flatulência. Uma única incidência de supressão da medula óssea tem sido relatada com o uso de butalbital, aspirina e cafeína. Vários casos de reações dermatológicas, incluindo necrólise epidérmica tóxica e eritema multiforme foram relatados.
Postmarketing Experience
Existem poucas informações sobre Postmarketing Experience of Butalbital no rótulo do medicamento.
Interações com Drogas
Existem poucas informações sobre as interações butalbitais no rótulo do medicamento.
Uso em populações específicas
Pregnância
Categoria de Gravidez (FDA): C
- Não foram realizados estudos detalhados em animais para determinar se esta droga afeta a fertilidade em machos ou fêmeas, se tem potencial teratogênico, ou se tem outros efeitos adversos sobre o feto. Embora não existam estudos bem controlados em gestantes, mais de vinte anos de comercialização e experiência clínica não incluem nenhuma evidência positiva de efeitos adversos sobre o feto. Embora não haja risco claramente definido, tal experiência não pode excluir a possibilidade de danos pouco freqüentes ou sutis ao feto humano. Butalbital, aspirina e cafeína devem ser usadas em gestantes somente quando claramente necessárias.
Categoria de Gravidez (AUS): Não há orientação do Comitê Australiano de Avaliação de Drogas (ADEC) sobre o uso de Butalbital em mulheres grávidas.
Labor e parto
Não há orientação do FDA sobre o uso de Butalbital durante o parto.
Mães amamentadoras
- Os efeitos do butalbital, aspirina e cafeína em bebês de mães lactantes não são conhecidos. Salicilatos e barbitúricos são excretados no leite materno das mães que amamentam. Acredita-se que os níveis séricos em lactentes sejam insignificantes com doses terapêuticas.
Uso Pediátrico
- Segurança e eficácia em pacientes pediátricos abaixo dos 12 anos de idade não foram estabelecidos.
Uso Geriátrico
Não há orientação do FDA sobre o uso de Butalbital em relação a pacientes geriátricos.
Gênero
Não há orientação do FDA sobre o uso de Butalbital em relação a populações de sexo específico.
Raça
Não há orientação do FDA sobre o uso de Butalbital em relação a populações raciais específicas.
Imparidade renal
Não há orientação do FDA sobre o uso de Butalbital em pacientes com insuficiência renal.
Imparidade hepática
Não há orientação do FDA sobre o uso de Butalbital em pacientes com insuficiência hepática.
Fêmeas de Potencial Reprodutor e Machos
Não há orientações do FDA sobre o uso de Butalbital em mulheres de potencial reprodutivo e machos.
Pacientes imunocomprometidos
Não há orientações do FDA sobre o uso de Butalbital em pacientes imunocomprometidos.
Administração e Monitoramento
Administração
- Oral
Monitoramento
Existem poucas informações sobre o Monitoramento do Butalbital no rótulo do medicamento.
Compatibilidade IV
Existem poucas informações sobre compatibilidade IV de Butalbital no rótulo do medicamento.
Overdose
- Os efeitos tóxicos da superdosagem aguda de butalbital, aspirina e cafeína são atribuíveis principalmente ao seu componente barbitúrico, e, em menor grau, aspirina. Como os efeitos tóxicos da cafeína ocorrem apenas em doses muito altas, a possibilidade de toxicidade significativa da cafeína por butalbital, aspirina, e superdosagem de cafeína é improvável. Os sintomas atribuíveis ao envenenamento agudo por barbitúricos incluem sonolência, confusão e coma; depressão respiratória; hipotensão; choque. Sintomas atribuíveis a envenenamento agudo por aspirina incluem hiperpneia; distúrbios ácido-base com desenvolvimento de acidose metabólica; vômitos e dor abdominal; zumbido; hipertermia; hipoprotrombinemia; agitação; delírio; convulsões. O envenenamento agudo por cafeína pode causar insônia, agitação, tremor e delírio; taquicardia e extra-sístoles. O tratamento consiste principalmente na gestão da intoxicação por barbitúricos e na correcção do desequilíbrio ácido-base devido ao salicilismo. O vômito deve ser induzido mecanicamente ou com eméticos no paciente consciente. A lavagem gástrica pode ser usada se os reflexos faríngeo e laríngeo estiverem presentes e se tiverem decorrido menos de 4 horas desde a ingestão. Um tubo endotraqueal algemado deve ser inserido antes da lavagem gástrica do paciente inconsciente e quando necessário para proporcionar respiração assistida. Diurese, alcalinização da urina e correção de distúrbios eletrolíticos devem ser realizados através da administração de líquidos intravenosos como 1% de bicarbonato de sódio em 5% de dextrose na água. Deve-se dar atenção meticulosa à manutenção de ventilação pulmonar adequada. A correção da hipotensão pode requerer a administração de bitartrato de levartherenol ou cloridrato de fenilefrina por infusão intravenosa. Em casos graves de intoxicação, diálise peritoneal, hemodiálise ou transfusão de troca podem salvar vidas. Hipoprotrombinemia deve ser tratada com Vitamina K, por via intravenosa.
Existem poucas informações sobre Overdose Crônica de Butalbital no rótulo do medicamento.
Farmacologia
Existem poucas informações sobre Farmacologia Butalbital no rótulo do medicamento.
Mecanismo de Ação
- Farmacologicamente, butalbital, aspirina e cafeína combina as propriedades analgésicas da aspirina com as propriedades ansiolíticas e relaxantes musculares do butalbital.
A eficácia clínica do butalbital, aspirina e cafeína na dor de cabeça de tensão foi estabelecida em ensaios duplo-cego, controlados por placebo, multi-clínicos. Um estudo fatorial comparou butalbital, aspirina e cafeína com cada um dos seus principais componentes. Este estudo demonstrou que cada componente contribui para a eficácia do butalbital, aspirina e cafeína no tratamento dos sintomas alvo da dor de cabeça de tensão (dor de cabeça, tensão psíquica e contração muscular na região da cabeça, pescoço e ombro). Para cada sintoma e o complexo de sintomas como um todo, butalbital, aspirina e cafeína demonstraram ter efeitos clínicos significativamente superiores aos de qualquer dos componentes isoladamente.
Estrutura
- A disponibilidade sistêmica da aspirina após uma dose oral é altamente dependente da forma de dosagem, da presença de alimentos, do tempo de esvaziamento gástrico, pH gástrico, antiácidos, agentes tamponantes e tamanho das partículas. Estes fatores afetam não necessariamente a extensão da absorção de salicilatos totais, mas mais a estabilidade da aspirina antes da absorção.
- Durante o processo de absorção e após a absorção, a aspirina é principalmente hidrolisada ao ácido salicílico e distribuída a todos os tecidos e fluidos do corpo, incluindo tecidos fetais, leite materno e o sistema nervoso central (SNC). As concentrações mais altas são encontradas no plasma, fígado, córtex renal, coração e pulmão. No plasma, cerca de 50%-80% do ácido salicílico e seus metabólitos estão livremente ligados às proteínas plasmáticas.
- A eliminação dos salicilatos totais está sujeita a cinética saturável; entretanto, a cinética de eliminação de primeira ordem ainda é uma boa aproximação para doses de até 650 mg. A semi-vida plasmática para aspirina é de cerca de 12 minutos e para ácido salicílico e/ou salicilatos totais é de cerca de 3,0 horas.
- A eliminação de doses terapêuticas é através dos rins, quer como ácido salicílico, quer como outros produtos de biotransformação. A depuração renal é grandemente aumentada por uma urina alcalina como é produzida pela administração simultânea de bicarbonato de sódio ou citrato de potássio.
- A biotransformação da aspirina ocorre principalmente nos hepatócitos. Os principais metabolitos são o ácido salicilúrico (75%), os glucuronídeos fenólicos e acilo do salicilato (15%), e o ácido gentisico e gentisúrico (1%). A biodisponibilidade do componente butalbital, aspirina e cafeína da aspirina é equivalente à de uma solução, exceto por uma taxa de absorção mais lenta. Um pico de concentração de 8,80 mcg/mL foi obtido aos 40 minutos após uma dose de 650 mg.
- Butalbital é bem absorvido do trato gastrointestinal e espera-se que seja distribuído para a maioria dos tecidos do corpo. Os barbitúricos, em geral, podem aparecer no leite materno e atravessar facilmente a barreira placentária. Eles estão ligados ao plasma e proteínas teciduais em grau variável e a ligação aumenta diretamente em função da solubilidade lipídica.
- Alimination of butalbital is primarily via the kidney (59%-88% da dose) as unchanged drug or metabolites. A meia-vida plasmática é de cerca de 35 horas. Os produtos de excreção urinária incluíram o fármaco parental (cerca de 3,6% da dose), 5-isobutil-5-(2,3-dihidroxipropil) ácido barbitúrico (cerca de 24% da dose), 5-allyl-5(3-hydroxy-2-methyl-1-propyl) ácido barbitúrico (cerca de 4,8% da dose), produtos com o anel de ácido barbitúrico hidrolisado com excreção de ureia (cerca de 14% da dose), bem como materiais não identificados. Do material excretado na urina, 32% foi conjugado.
- A biodisponibilidade do componente butalbital do butalbital, aspirina e cafeína é equivalente à de uma solução, exceto por uma diminuição na taxa de absorção. Um pico de concentração de 2020 ng/mL é obtido a cerca de 1,5 horas após uma dose de 100 mg.
- A ligação in vitro da proteína plasmática do butalbital é de 45% acima da faixa de concentração de 0,5 a 20 mcg/mL. Isto está dentro da faixa de ligação da proteína plasmática (20% a 45%) relatada com outros barbitúricos como fenobarbital, pentobarbital, e secobarbital sódico. A razão concentração plasma/sangue foi quase unidade, indicando que não há distribuição preferencial de butalbital no plasma ou nas células sanguíneas. (veja OVERDOSAGEM para informações sobre toxicidade).
- Como a maioria das xantinas, a cafeína é rapidamente absorvida e distribuída em todos os tecidos e fluidos do corpo, incluindo o SNC, tecidos fetais, e leite materno.
- A cafeína é eliminada rapidamente através do metabolismo e excreção na urina. A meia-vida do plasma é de cerca de 3 horas. A biotransformação hepática antes da excreção resulta em quantidades aproximadamente iguais de 1-metil-xantina e 1-metilúrico. Dos 70% da dose que foi recuperada na urina, apenas 3% foi a mesma droga.
- A biodisponibilidade do componente cafeína para butalbital, aspirina e cafeína é equivalente à de uma solução, exceto por um tempo ligeiramente maior até o pico. Um pico de concentração de 1660 ng/mL foi obtido em menos de uma hora para uma dose de 80 mg
- Butalbital, Aspirina e Comprimidos de Cafeína, USP 50 mg/325 mg/40 mg são Comprimidos Comprimidos Brancos, Redondos, Sem Comprimidos Impressos “West-ward 785”.
- Store at 20-25oC (68-77oF) . Proteger da luz e humidade.
- Dispense em recipiente hermético e resistente à luz, conforme definido na USP, utilizando um fecho resistente a crianças.
- Não foi estabelecida a interacção Álcool-Butalbital. Fale com seu médico sobre os efeitos da ingestão de álcool com este medicamento.
Farmacodinâmica
Existem poucas informações sobre Farmacodinâmica do Butalbital no rótulo do medicamento.
Farmacocinética
- O comportamento dos componentes individuais é descrito abaixo.
Aspirina:
Butalbital:
Cafeína:
Nonclinical Toxicology
Existem poucas informações sobre Toxicologia Não-Clínica do Butalbital no rótulo do medicamento.
Estudos Clínicos
Existem poucas informações sobre Estudos Clínicos do Butalbital no rótulo do medicamento.
Como Fornecido
Bottles of 30 tabletsBottles of 50 tabletsBottles of 100 tabletsBottles of 500 tabletsBottles of 1000 tabletsCaixas de dosagem de 100 comprimidos
Armazenamento
Existe informação limitada sobre o Armazenamento Butalbital na etiqueta do medicamento.
Imagens
Fotos de Drogas
Nome da Droga: Butalbital, Acetaminofen e Cafeína
Ingrediente(s): BUTALBITAL, ACETAMINOPHEN, CAFFEINE
Impressão: Oeste;ala;787
Dosagem: 50 mg
Cor(es): Azul
Forma: Redondo
Tamanho (mm): 11
Partitura: 1
NDC:01431787
Rótulo do Autor: West-Ward Pharmaceutical Corp
Esta imagem da pílula é fornecida pela National Library of Medicine’s PillBox.
>

Drug Name: Butalbital, Aspirina e Cafeína
Ingrediente(s): BUTALBITAL, ASPIRINA, CAFFEINE
Impressão: Para Oeste;785
Dosagem: 50 mg
Cor(es): Branco
Forma: Redondo
Tamanho (mm): 11
Partitura: 1
NDC:01431785
Rótulo do Autor: West-ward Pharmaceutical Corp
Esta imagem da pílula é fornecida pela National Library of Medicine’s PillBox.

Drug Name: Butalbital, Aspirina, e Cafeína
Ingrediente(s): BUTALBITAL, ASPIRINA, CAFFEINE
Impressão: WATSON;3219
Dosage: 50 mg
Cor(es): Verde, Amarelo
Forma: Cápsula
Tamanho (mm): 22
Partitura: 1
NDC:05913219
Rótulo do Autor: Laboratórios Watson, Inc.
Esta imagem da pílula é fornecida pela PillBox da Biblioteca Nacional de Medicina.
Drug Name: Comprimidos Butalbital, Aspirina e Cafeína
Ingrediente(s): ASPIRINA, BUTALBITAL, CAFFEINE
Impressas: Oeste;ala;785
Dosagem: 50 mg
Cor(es): Branco
Forma: Redondo
Tamanho (mm): 7
Partitura: 1
NDC:06032548
Rótulo do Autor: Qualitest
Esta imagem da pílula é fornecida pela PillBox da National Library of Medicine.
Pacote e Rótulo do Painel
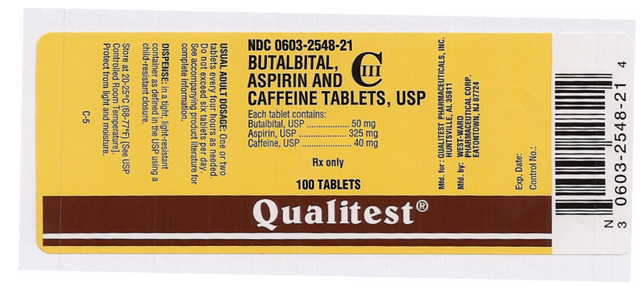
Esta imagem do rótulo do FDA é fornecida pela National Library of Medicine.

Esta imagem do rótulo do FDA é fornecida pela Biblioteca Nacional de Medicina.
Informação de Aconselhamento Paciente
Existe informação limitada sobre a informação de Aconselhamento Paciente de Butalbital no rótulo do medicamento.
Precauções com Álcool
Nomes de marcas
Existem informações limitadas sobre os nomes de marcas de Butalbital no rótulo do medicamento.
Nomes de drogas semelhantes a Butalbital
Existem informações limitadas sobre os nomes de drogas semelhantes a Butalbital no rótulo do medicamento.