Editor Jefe: C. Michael Gibson, M.S., M.D. ; Editor(es) Asociado(s) en Jefe: Aparna Vuppala, M.B.B.S.
- Aviso legal
- Resumen
- Indicaciones y dosis para adultos
- Indicaciones y dosis indicadas por la FDA (adultos)
- Dolor de cabeza
- Uso y dosis fuera de lo indicado (adultos)
- Uso apoyado por la guía
- Uso no respaldado por directrices
- Indicaciones y dosis pediátricas
- Indicaciones y dosis marcadas por la FDA (pediátricas)
- Uso y dosis fuera de etiqueta (pediátrico)
- Uso apoyado por la guía
- Uso no respaldado por las directrices
- Contraindicaciones
- Advertencias
- Drogodependencia:
- Uso en pacientes ambulatorios:
- Precauciones
- Reacciones adversas
- Experiencia en ensayos clínicos
- Experiencia postcomercialización
- Interacciones medicamentosas
- Uso en poblaciones específicas
- Embarazo
- Parto de cuentas
- Madres lactantes
- Uso pediátrico
- Uso geriátrico
- Género
- Raza
- Deterioro renal
- Deterioro hepático
- Mujeres con potencial reproductivo y varones
- Pacientes inmunocomprometidos
- Administración y monitorización
- Administración
- Monitorización
- Compatibilidad intravenosa
- Sobredosis
- Farmacología
- Mecanismo de acción
- Estructura
- Farmacodinámica
- Farmacocinética
- Aspirina:
- Butalbital:
- Cafeína:
- Toxicología no clínica
- Estudios clínicos
- Cómo se suministra
- Almacenamiento
- Imágenes
- Imágenes del medicamento
- Panel de visualización de envases y etiquetas
- Información de asesoramiento al paciente
- Precauciones con el alcohol
- Nombres de marca
- Nombres de medicamentos similares
- Estado de escasez de medicamentos
Aviso legal
WikiDoc NO GARANTIZA LA VALIDEZ. WikiDoc no es un proveedor de atención médica profesional, ni es un sustituto adecuado de un proveedor de atención médica autorizado. WikiDoc pretende ser una herramienta educativa, no una herramienta para ninguna forma de prestación de asistencia sanitaria. El contenido educativo de las páginas de medicamentos de WikiDoc se basa en el prospecto de la FDA, en el contenido de la Biblioteca Nacional de Medicina y en las directrices prácticas / declaraciones de consenso. WikiDoc no promueve la administración de ningún medicamento o dispositivo que no sea coherente con su etiquetado. Por favor, lea nuestra exención de responsabilidad completa aquí.
Resumen
El butalbital es una combinación aprobada por la FDA para el tratamiento del complejo sintomático de la cefalea tensional (o de contracción muscular). Las reacciones adversas comunes incluyen mareos y alteraciones gastrointestinales, incluyendo náuseas, vómitos y flatulencia, necrólisis epidérmica tóxica y eritema multiforme.
Indicaciones y dosis para adultos
Indicaciones y dosis indicadas por la FDA (adultos)
Dolor de cabeza
- Los comprimidos de butalbital, aspirina y cafeína están indicados para el alivio del complejo sintomático de la cefalea tensional (o de contracción muscular).
- No se dispone de evidencia que apoye la eficacia y seguridad de butalbital, aspirina y cafeína en el tratamiento de múltiples cefaleas recurrentes. Se requiere precaución a este respecto porque el butalbital crea hábito y es potencialmente abusivo.
Uso y dosis fuera de lo indicado (adultos)
Uso apoyado por la guía
Existe información limitada respecto al uso fuera de lo indicado del butalbital en pacientes adultos.
Uso no respaldado por directrices
Hay información limitada con respecto al uso no contemplado por directrices de Butalbital en pacientes adultos.
Indicaciones y dosis pediátricas
Indicaciones y dosis marcadas por la FDA (pediátricas)
Hay información limitada con respecto al uso marcado por la FDA de Butalbital en pacientes pediátricos.
Uso y dosis fuera de etiqueta (pediátrico)
Uso apoyado por la guía
Hay información limitada con respecto al uso fuera de etiqueta apoyado por la guía de Butalbital en pacientes pediátricos.
Uso no respaldado por las directrices
Existe información limitada con respecto al uso no contemplado en las directrices de Butalbital en pacientes pediátricos.
Contraindicaciones
- Hipersensibilidad a la aspirina, cafeína o barbitúricos. Pacientes con porfiria.
Advertencias
Drogodependencia:
- El uso prolongado de barbitúricos puede producir drogodependencia, caracterizada por dependencia psíquica y, con menor frecuencia, dependencia física y tolerancia. La responsabilidad del abuso de butalbital, aspirina y cafeína es similar a la de otras combinaciones de fármacos que contienen barbitúricos. Se debe tener precaución cuando se prescriba la medicación a pacientes con una propensión conocida a tomar cantidades excesivas de fármacos, lo que no es infrecuente en pacientes con cefalea tensional crónica.
Uso en pacientes ambulatorios:
- El butalbital, el ácido acetilsalicílico y la cafeína pueden deteriorar las capacidades mentales y/o físicas necesarias para la realización de tareas potencialmente peligrosas, como conducir un coche o manejar maquinaria. El paciente debe ser advertido en consecuencia. Los efectos depresores del Sistema Nervioso Central del butalbital pueden ser aditivos con los de otros depresores del SNC. Debe evitarse el uso simultáneo con otros sedantes-hipnóticos o con alcohol. Cuando sea necesario dicho tratamiento combinado, puede ser necesario reducir la dosis de uno o más agentes.
Precauciones
- Los salicilatos deben utilizarse con extrema precaución en presencia de úlcera péptica o anomalías de la coagulación.
Reacciones adversas
Experiencia en ensayos clínicos
- Las reacciones adversas más frecuentes son somnolencia y mareos. Las reacciones adversas menos frecuentes son el mareo y los trastornos gastrointestinales, incluyendo náuseas, vómitos y flatulencia. Se ha notificado una única incidencia de supresión de la médula ósea con el uso de butalbital, aspirina y cafeína. Se han notificado varios casos de reacciones dermatológicas, incluyendo necrólisis epidérmica tóxica y eritema multiforme.
Experiencia postcomercialización
Hay información limitada con respecto a la experiencia postcomercialización de Butalbital en la etiqueta del medicamento.
Interacciones medicamentosas
Hay información limitada con respecto a las Interacciones medicamentosas de Butalbital en la etiqueta del medicamento.
Uso en poblaciones específicas
Embarazo
Categoría de embarazo (FDA): C
- No se han realizado estudios adecuados en animales para determinar si este medicamento afecta a la fertilidad en machos o hembras, si tiene potencial teratogénico o si tiene otros efectos adversos sobre el feto. Aunque no hay estudios bien controlados en mujeres embarazadas, más de veinte años de comercialización y experiencia clínica no incluyen ninguna evidencia positiva de efectos adversos en el feto. Aunque no existe un riesgo claramente definido, dicha experiencia no puede excluir la posibilidad de daños infrecuentes o sutiles para el feto humano. El butalbital, la aspirina y la cafeína deben utilizarse en mujeres embarazadas sólo cuando sea claramente necesario.
Categoría de embarazo (AUS): No existen orientaciones del Comité Australiano de Evaluación de Medicamentos (ADEC) sobre el uso de Butalbital en mujeres embarazadas.
Parto de cuentas
No existen orientaciones de la FDA sobre el uso de Butalbital durante el parto.
Madres lactantes
- Se desconocen los efectos del butalbital, la aspirina y la cafeína en los niños de madres lactantes. Los salicilatos y los barbitúricos se excretan en la leche materna de las madres lactantes. Se cree que los niveles séricos en los lactantes son insignificantes con dosis terapéuticas.
Uso pediátrico
- No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 12 años.
Uso geriátrico
No existen orientaciones de la FDA sobre el uso de Butalbital con respecto a los pacientes geriátricos.
Género
No existen orientaciones de la FDA sobre el uso de Butalbital con respecto a poblaciones específicas de género.
Raza
No existen directrices de la FDA sobre el uso de Butalbital con respecto a poblaciones raciales específicas.
Deterioro renal
No existen directrices de la FDA sobre el uso de Butalbital en pacientes con deterioro renal.
Deterioro hepático
No existen directrices de la FDA sobre el uso de Butalbital en pacientes con deterioro hepático.
Mujeres con potencial reproductivo y varones
No existen directrices de la FDA sobre el uso de Butalbital en mujeres con potencial reproductivo y varones.
Pacientes inmunocomprometidos
No existen directrices de la FDA sobre el uso de Butalbital en pacientes inmunocomprometidos.
Administración y monitorización
Administración
- Oral
Monitorización
Hay información limitada respecto a la monitorización de Butalbital en la etiqueta del medicamento.
Compatibilidad intravenosa
Hay información limitada respecto a la Compatibilidad intravenosa de Butalbital en la etiqueta del medicamento.
Sobredosis
- Los efectos tóxicos de la sobredosis aguda de butalbital, aspirina y cafeína son atribuibles principalmente a su componente barbitúrico y, en menor medida, a la aspirina. Dado que los efectos tóxicos de la cafeína sólo se producen en dosis muy elevadas, la posibilidad de una toxicidad significativa de la cafeína por sobredosis de butalbital, aspirina y cafeína es poco probable. Los síntomas atribuibles a la intoxicación aguda por barbitúricos incluyen somnolencia, confusión y coma; depresión respiratoria; hipotensión; shock. Los síntomas atribuibles a la intoxicación aguda por aspirina incluyen hiperpnea; alteraciones ácido-base con desarrollo de acidosis metabólica; vómitos y dolor abdominal; tinnitus; hipertermia; hipoprotrombinemia; inquietud; delirio; convulsiones. La intoxicación aguda por cafeína puede causar insomnio, inquietud, temblores y delirio; taquicardia y extrasístoles. El tratamiento consiste principalmente en el manejo de la intoxicación por barbitúricos y la corrección del desequilibrio ácido-base debido al salicilismo. El vómito debe ser inducido mecánicamente o con eméticos en el paciente consciente. El lavado gástrico puede utilizarse si los reflejos faríngeos y laríngeos están presentes y si han transcurrido menos de 4 horas desde la ingestión. Se debe insertar un tubo endotraqueal con manguito antes del lavado gástrico del paciente inconsciente y cuando sea necesario para proporcionar respiración asistida. La diuresis, la alcalinización de la orina y la corrección de las alteraciones electrolíticas deben llevarse a cabo mediante la administración de fluidos intravenosos como el bicarbonato de sodio al 1% en dextrosa al 5% en agua. Debe prestarse una atención meticulosa al mantenimiento de una ventilación pulmonar adecuada. La corrección de la hipotensión puede requerir la administración de bitartrato de levartherenol o clorhidrato de fenilefrina por infusión intravenosa . En casos graves de intoxicación, la diálisis peritoneal, la hemodiálisis o la exanguinotransfusión pueden salvar la vida. La hipoprotrombinemia debe tratarse con vitamina K, por vía intravenosa.
Hay información limitada con respecto a la Sobredosis crónica de Butalbital en la etiqueta del medicamento.
Farmacología
Hay información limitada con respecto a la Farmacología del Butalbital en la etiqueta del medicamento.
Mecanismo de acción
- Farmacológicamente, el butalbital, la aspirina y la cafeína combinan las propiedades analgésicas de la aspirina con las propiedades ansiolíticas y de relajación muscular del butalbital.
La eficacia clínica del butalbital, la aspirina y la cafeína en la cefalea tensional se ha establecido en ensayos multiclínicos a doble ciego y controlados con placebo. Un estudio con diseño factorial comparó el butalbital, la aspirina y la cafeína con cada uno de sus componentes principales. Este estudio demostró que cada componente contribuye a la eficacia del butalbital, la aspirina y la cafeína en el tratamiento de los síntomas objetivo de la cefalea tensional (dolor de cabeza, tensión psíquica y contracción muscular en la región de la cabeza, el cuello y los hombros). Para cada síntoma y el complejo de síntomas en su conjunto, el butalbital, la aspirina y la cafeína demostraron tener efectos clínicos significativamente superiores a los de cualquiera de los componentes por separado.
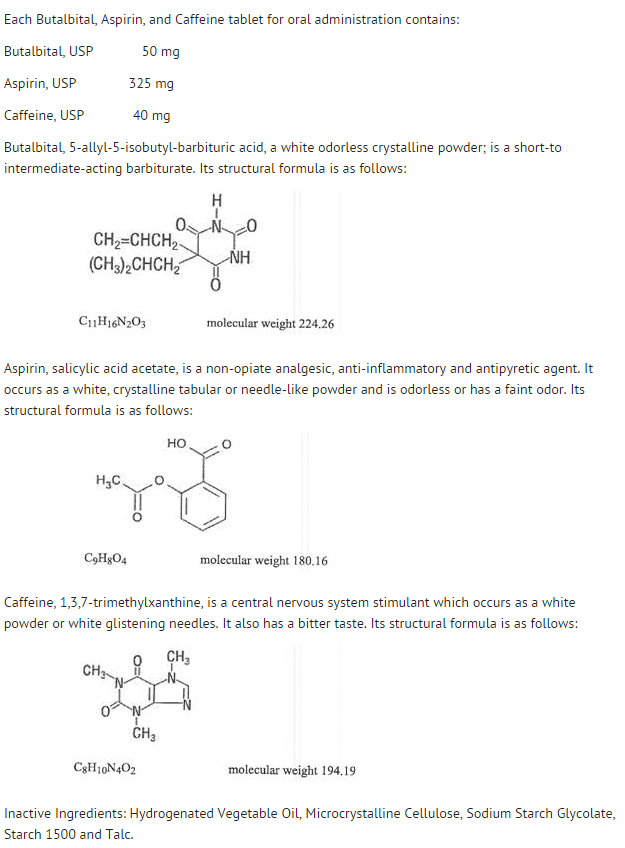
Estructura
- El comportamiento de los componentes individuales se describe a continuación.
- La disponibilidad sistémica de la aspirina después de una dosis oral depende en gran medida de la forma farmacéutica, la presencia de alimentos, el tiempo de vaciado gástrico, el pH gástrico, los antiácidos, los agentes amortiguadores y el tamaño de las partículas. Estos factores no afectan necesariamente al grado de absorción de los salicilatos totales, sino más bien a la estabilidad de la aspirina antes de la absorción.
- Durante el proceso de absorción y después de la misma, la aspirina se hidroliza principalmente a ácido salicílico y se distribuye a todos los tejidos y fluidos corporales, incluidos los tejidos fetales, la leche materna y el sistema nervioso central (SNC). Las concentraciones más altas se encuentran en el plasma, el hígado, la corteza renal, el corazón y el pulmón. En el plasma, entre el 50% y el 80% del ácido salicílico y sus metabolitos están débilmente unidos a las proteínas plasmáticas.
- El aclaramiento de los salicilatos totales está sujeto a una cinética de saturación; sin embargo, la cinética de eliminación de primer orden sigue siendo una buena aproximación para dosis de hasta 650 mg. La semivida plasmática de la aspirina es de unos 12 minutos y la del ácido salicílico y/o los salicilatos totales es de unas 3,0 horas.
- La eliminación de las dosis terapéuticas se produce a través de los riñones, bien como ácido salicílico o como otros productos de biotransformación. El aclaramiento renal aumenta en gran medida por una orina alcalina como la que se produce por la administración simultánea de bicarbonato de sodio o citrato de potasio.
- La biotransformación del ácido acetilsalicílico se produce principalmente en los hepatocitos. Los principales metabolitos son el ácido salicilúrico (75%), los glucurónidos fenólicos y acílicos del salicilato (15%), y el ácido gentísico y gentisúrico (1%). La biodisponibilidad del componente de aspirina butalbital, aspirina y cafeína es equivalente a la de una solución, excepto por una tasa de absorción más lenta. Se obtuvo una concentración máxima de 8,80 mcg/mL a los 40 minutos de una dosis de 650 mg.
- El butalbital se absorbe bien en el tracto gastrointestinal y se espera que se distribuya a la mayoría de los tejidos del organismo. Los barbitúricos, en general, pueden aparecer en la leche materna y atraviesan fácilmente la barrera placentaria. Se unen a las proteínas plasmáticas y tisulares en un grado variable y la unión aumenta directamente en función de la solubilidad de los lípidos.
- La eliminación del butalbital es principalmente por vía renal (59%-88% de la dosis) como fármaco inalterado o metabolitos. La vida media plasmática es de unas 35 horas. Los productos de excreción urinaria incluyen el fármaco principal (alrededor del 3,6% de la dosis), el ácido 5-isobutílico-5-(2,3-dihidroxipropílico) barbitúrico (alrededor del 24% de la dosis), el ácido 5-alil-5(3-hidroxi-2-metil-1-propílico) barbitúrico (alrededor del 4,8% de la dosis), productos con el anillo de ácido barbitúrico hidrolizado con excreción de urea (alrededor del 14% de la dosis), así como materiales no identificados. Del material excretado en la orina, el 32% era conjugado.
- La biodisponibilidad del componente butalbital de butalbital, aspirina y cafeína es equivalente a la de una solución, excepto por una disminución de la tasa de absorción. Se obtiene una concentración máxima de 2020 ng/mL aproximadamente 1,5 horas después de una dosis de 100 mg.
- La unión a proteínas plasmáticas in vitro del butalbital es del 45% en el intervalo de concentración de 0,5 a 20 mcg/mL. Esto se encuentra dentro del rango de unión a proteínas plasmáticas (20% a 45%) informado con otros barbitúricos como fenobarbital, pentobarbital y secobarbital sódico. La relación de concentración plasma-sangre fue casi unitaria, lo que indica que no hay una distribución preferencial del butalbital en el plasma o en las células sanguíneas. (ver sobredosificación para información sobre toxicidad).
- Al igual que la mayoría de las xantinas, la cafeína se absorbe y distribuye rápidamente en todos los tejidos y fluidos corporales, incluyendo el SNC, los tejidos fetales y la leche materna.
- La cafeína se elimina rápidamente a través del metabolismo y la excreción en la orina. La vida media plasmática es de unas 3,0 horas. La biotransformación hepática previa a la excreción da lugar a cantidades aproximadamente iguales de 1-metil-xantina y ácido 1-metilúrico. Del 70% de la dosis que se ha recuperado en la orina, sólo el 3% era fármaco inalterado.
- La biodisponibilidad del componente cafeína para el butalbital, la aspirina y la cafeína es equivalente a la de una solución, excepto por un tiempo ligeramente más largo hasta el pico. Se obtuvo una concentración máxima de 1660 ng/mL en menos de una hora para una dosis de 80 mg
- Los comprimidos de butalbital, aspirina y cafeína, USP 50 mg/325 mg/40 mg son comprimidos blancos, redondos, sin marcar, con la impresión «West-ward 785».
- Conservar a 20-25oC (68-77oF) . Proteger de la luz y la humedad.
- Dispensar en un envase hermético y resistente a la luz, tal como se define en la USP, utilizando un cierre a prueba de niños.
- No se ha establecido la interacción alcohol-Butalbital. Hable con su médico sobre los efectos de tomar alcohol con este medicamento.
Farmacodinámica
Hay información limitada respecto a la Farmacodinámica de Butalbital en la etiqueta del medicamento.
Farmacocinética
Aspirina:
Butalbital:
Cafeína:
Toxicología no clínica
Hay información limitada respecto a la Toxicología no clínica de Butalbital en la etiqueta del medicamento.
Estudios clínicos
Hay información limitada respecto a los Estudios clínicos de Butalbital en la etiqueta del medicamento.
Cómo se suministra
Frascos de 30 comprimidosFrascos de 50 comprimidosFrascos de 100 comprimidosFrascos de 500 comprimidosFrascos de 1000 comprimidosCajas de 100 comprimidos
Almacenamiento
Hay información limitada sobre el Almacenamiento de Butalbital en la etiqueta del medicamento.
Imágenes
Imágenes del medicamento
Nombre del medicamento: Butalbital, Acetaminofén y Cafeína
Ingrediente(s): BUTALBITAL, ACETAMINOFENO, CAFEÍNA
Impresión: West;ward;787
Dosificación: 50 mg
Color(es): Azul
Forma: Redonda
Tamaño (mm): 11
Puntuación: 1
NDC:01431787
Etiqueta del medicamento Autor: West-Ward Pharmaceutical Corp
Esta imagen de píldora es proporcionada por el PillBox de la Biblioteca Nacional de Medicina.

Nombre del medicamento: Butalbital, Aspirina y Cafeína
Ingredientes: BUTALBITAL, ASPIRINA, CAFEÍNA
Impresión: Westward;785
Dosificación: 50 mg
Color(es): Blanco
Forma: Redonda
Tamaño (mm): 11
Puntuación: 1
NDC:01431785
Etiqueta del medicamento Autor: West-ward Pharmaceutical Corp
Esta imagen de píldora es proporcionada por el PillBox de la Biblioteca Nacional de Medicina.

Nombre del medicamento: Butalbital, Aspirina y Cafeína
Ingredientes: BUTALBITAL, ASPIRINA, CAFEÍNA
Impresión: WATSON;3219
Dosage: 50 mg
Color(es): Verde, Amarillo
Forma: Cápsula
Tamaño (mm): 22
Puntuación: 1
NDC:05913219
Etiqueta del medicamento Autor: Watson Laboratories, Inc.
Esta imagen de píldora es proporcionada por el PillBox de la Biblioteca Nacional de Medicina.
Nombre del medicamento: Butalbital, Aspirina y Cafeína Comprimidos
Ingrediente(s): ASPIRINA, BUTALBITAL, CAFEÍNA
Impresión: West;ward;785
Dosificación: 50 mg
Color(es): Blanco
Forma: Redonda
Tamaño (mm): 7
Puntuación: 1
NDC:06032548
Etiqueta del medicamento Autor: Qualitest
Esta imagen de la píldora es proporcionada por el PillBox de la Biblioteca Nacional de Medicina.
Panel de visualización de envases y etiquetas
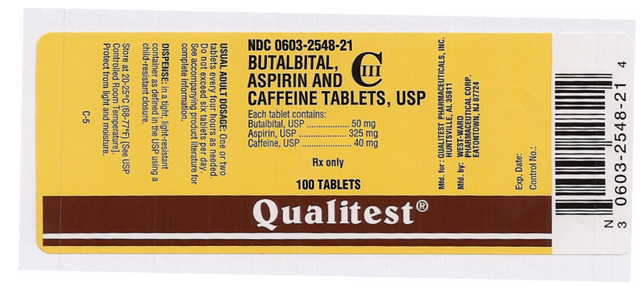
Esta imagen de la etiqueta de la FDA es proporcionada por la Biblioteca Nacional de Medicina.

Esta imagen de la etiqueta de la FDA es proporcionada por la Biblioteca Nacional de Medicina.
Información de asesoramiento al paciente
Hay información limitada sobre la información de asesoramiento al paciente de Butalbital en la etiqueta del medicamento.
Precauciones con el alcohol
Nombres de marca
Hay información limitada con respecto a los nombres de marca de Butalbital en la etiqueta del medicamento.
Nombres de medicamentos similares
Hay información limitada con respecto a los nombres de medicamentos similares a Butalbital en la etiqueta del medicamento.
Estado de escasez de medicamentos
.