Věda > Chemie > Prvky třetí řady > Pojem kovové vazby a kovových pevných látek
V tomto článku se budeme zabývat pojmem kovové vazby a kovovými vazbami v krystalech sodíku, hořčíku a hliníku.
Pojmem kovové vazby:
Kovová vazba je definována jako přitažlivá síla, která váže kovové kationty na určitý počet pohyblivých nebo delokalizovaných elektronů v její sféře vlivu, které drží kovové kationty pohromadě v určitém uspořádání. K vysvětlení podstaty kovové vazby bylo navrženo mnoho teorií. Teorie volných elektronů neboli teorie elektronového moře je jednou z nejjednodušších teorií, kterou navrhli Drude a Lorentz. Některé z důležitých postulátů této teorie jsou následující:
Teorie volných elektronů kovové vazby:
Kovové atomy mají menší počet valenčních elektronů, takže mají mnoho volných valenčních orbitalů. Na, Mg a Al mají volné 3p orbitaly.
| Název | Symbol | Atomové číslo. | Elektronická konfigurace | Podrobná konfigurace |
| Sodík | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Hořčík | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Hliník | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Hodnoty ionizačního potenciálu kovů jsou nízké, proto jsou valenční elektrony volně drženy a mohou být snadno odstraněny. Těsně zabalená struktura krystalu kovu se skládá z atomů kovu, které jsou ve všech ohledech identické.
Neobsazené orbitaly těsně zabalených atomů kovu se krystalovou mřížkou překrývají s podobnými orbitaly sousedních atomů. Valenční elektrony se vyjmou ze svých orbitalů a mohou se volně pohybovat z neobsazených valenčních orbitalů jednoho atomu na druhý. Protože tyto valenční elektrony nepatří žádnému jednotlivému atomu, ale krystalu jako celku, nazývají se delokalizované nebo mobilní elektrony. Ionty kovů (kationty) vzniklé v důsledku delokalizace se nazývají jádra. Ionty kovů mají v krystalové mřížce pevnou polohu, zatímco delokalizované elektrony se mohou v krystalové mřížce volně pohybovat. Kov lze tedy považovat za shluk kovových kationtů ponořených do moře pohyblivých elektronů.
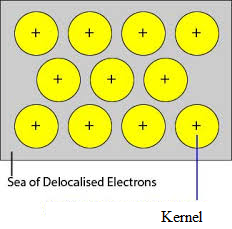
Protože elektrony v kovech jsou delokalizované a předpokládá se, že jsou rovnoměrně rozloženy v krystalové mřížce. Přitažlivé síly mezi ionty kovů a delokalizovanými elektrony jsou rovnoměrné ve všech směrech. Proto je kovová vazba nesměrová.
Jednotky zaujímající mřížkové body v sodíku, hořčíku a hliníku jsou jejich kladné ionty, respektive jsou obklopeny pohyblivými elektrony. Sodík, hořčík a hliník jsou tedy kovové pevné látky.
Při postupu zleva doprava, tj. od sodíku k hliníku, se počet valenčních elektronů zvyšuje, a proto se pevnost vazby od sodíku k hliníku zvyšuje.
Vlastnosti jako elektrická a tepelná vodivost, kovový lesk, kujnost a tažnost lze vysvětlit na základě teorie volných elektronů.
Charakteristika kovové vazby:
- Kovová vazba je definována jako přitažlivá síla, která váže kovové kationty na určitý počet pohyblivých nebo delokalizovaných elektronů v její sféře vlivu, které drží kovové kationty pohromadě v určitém uspořádání.
- Kovová vazba je nesměrová.
- Je slabší než kovalentní vazba, ale silnější než van der Waalovy síly.
- Vazby nejsou pevné.
- Síla kovové vazby přímo souvisí s kladným nábojem kovového iontu. Síla kovové vazby tedy roste s nárůstem Na < Mg < Al.
Kovové pevné látky:
Kovové pevné látky jsou krystalické pevné látky, v nichž jsou jednotkami zaujímajícími mřížkové body kladné ionty obklopené bazénem elektronů. (Pojem kovové vazby)
Krystalové struktury kovů:
Rentgenová analýza různých kovových krystalů ukázala, že kovy zaujímají některou z následujících krystalových struktur:
- Krystalová struktura s tělesovým středem. (BCC)
- Kubická struktura s centrovaným povrchem. (FCC)
- Hexagonální těsně zabalená struktura. (HCP)
Sodík (Na):
Kovový sodík má tělesově soustředěnou kubickou (BCC) otevřenou krystalovou strukturu. Vazba je nesměrová kovová.
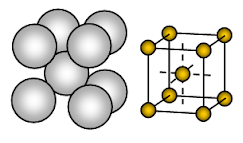
Uspořádání iontů v jedné rovině- Kubické uspořádání – otevřená nebo čtvercová balená struktura. V tomto uspořádání se každý kovový ion dotýká čtyř sousedních iontů v jedné rovině. Pořadí vrstev je AB, AB, AB, ……….
Sodík je kovová pevná látka. V jednotkové buňce sodíku je každý sodíkový ion obklopen osmi dalšími stejně vzdálenými sodíkovými ionty. Koordinační číslo je tedy 8. Tyto sodíkové ionty jsou uspořádány v rozích pomyslné krychle a ve středu krychle se nachází jeden sodíkový ion. V jedné jednotkové buňce sodíku jsou přítomny 2 ionty.
Sodíkové ionty zabírají jen asi 68 % dostupného prostoru v jednotkové buňce. Takže 32 % jednotkové buňky zůstává prázdné (void). Protože tato struktura má více prázdného prostoru, jsou kovy, které tuto strukturu přijímají, měkké. Sodík je tedy měkký kov, protože má ve své krystalové struktuře více prázdného prostoru (asi 32 % ) a poměrně slabou kovovou vazbu díky tomu, že na každý atom Na připadá v jeho krystalu pouze jeden valenční elektron.
Hořčík (Mg):
Hořčík má hexagonální těsně zabalenou (HCP) krystalovou strukturu. Vazba je nesměrová kovová.
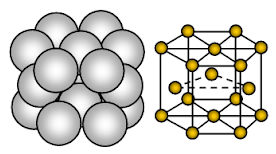
Hořčík je kovová pevná látka. Jednotkami zaujímajícími mřížková místa jsou ionty Mg a tyto ionty jsou obklopeny pohyblivými nebo delokalizovanými elektrony.
Uspořádání iontů v jedné rovině uspořádání iontů je hexagonální soustava nebo uzavřená balená vrstva. Každý kovový ion se tak dotýká šesti sousedních iontů v jedné rovině. Každý hořečnatý ion se dotýká šesti hořečnatých iontů ve své vlastní vrstvě, tří ve vrstvě nad ní a tří ve vrstvě pod ní. V hexagonální balené struktuře jsou uzavřené balené vrstvy iontů uspořádány ve střídavém pořadí, které se obvykle nazývá AB ABA …… Každá třetí vrstva iontů je přesně stejná a leží přímo nad první vrstvou.
Každý atom Mg je obklopen 12 dalšími stejně vzdálenými ionty Mg. Koordinační číslo je tedy 12. V jednotkové buňce je asi 26 % dostupného prostoru prázdného (void). Tato struktura je těsněji zabalená. Díky menšímu množství prázdného prostoru v krystalové struktuře, většímu elektronovému mraku díky Mg+2 a silné kovové vazbě je hořčík tvrdší než kovový sodík. Je kujnější a tažnější než sodík.
Hliník (Al):
Hliník má krystalovou strukturu FCC (face centred cubic). Vazba je nesměrová kovová.

Hliník je kovová pevná látka. Jednotkami zaujímajícími mřížková místa jsou ionty Al a tyto ionty jsou obklopeny pohyblivými nebo delokalizovanými elektrony.
Uspořádání iontů v jedné rovině uspořádání iontů je hexagonální soustava nebo uzavřená balená vrstva. Každý kovový iont se tak dotýká šesti sousedních iontů v jedné rovině.
V kubické krystalové struktuře s uzavřeným uspořádáním nebo kubické struktuře s centrovanou stěnou se posloupnost uzavřených vrstev iontů opakuje každou čtvrtou vrstvu. Tj. každá čtvrtá vrstva iontů je přesně stejná jako první vrstva a leží přímo nad ní. Nazývá se tedy ABC, ABC, ABC, ….. cubic close packing. Cubic close packing se také nazývá face centred close-packed structure, protože při pohledu z určitého úhlu lze ionty považovat za umístěné v osmi rozích krychle a ve středu každé ze šesti stěn krychle, tj. jednotkové buňky.
Každý hliníkový ion (Al+3) je obklopen 12 dalšími stejně vzdálenými atomy hliníku. Koordinační číslo je tedy 12. V jednotkové buňce hliníku je přibližně 26 % dostupného prostoru prázdného (void). Díky menšímu množství prázdného místa v krystalové struktuře a silné kovové vazbě je hliník tvrdší, kujnější a tažnější než sodík a hořčík.
Křemík (Si):
Kovalentní pevné látky jsou krystalické pevné látky, v jejichž jednotkových bodech mřížky jsou atomy. Hlavní vazebnou silou jsou kovalentní vazby mezi atomy. Křemík je kovalentní pevná látka, v níž jsou mřížkové body obsazeny atomy prvku. Křemík je síťová pevná látka. Existuje síť kovalentních vazeb Si-Si.
Atomové číslo křemíku je 14. Kovalentní vazby jsou tvořeny kovalentními vazbami. Elektronická konfigurace křemíku v základním stavu je 1s2, 2s22p6, 3s2 3p2. Ve svých valenčních orbitalech má čtyři valenční elektrony. Křemík podléhá sp3 hybridizaci za vzniku čtyř sp3 hybridizovaných orbitalů o stejné energii. Každý atom křemíku vytváří čtyři kovalentní vazby se čtyřmi dalšími sousedními atomy křemíku díky SP3- SP3 Vzniká tak tetraedrická jednotka Si4, která je prodloužena a tvoří trojrozměrnou obří molekulu.

Vazby Si -Si probíhají souvisle v celém krystalu. Krystal křemíku se tedy považuje za obří trojrozměrnou molekulu, která má tetraedrickou síť atomů křemíku spojených silnými kovalentními vazbami. Pevná látka obsahující takovou strukturu se nazývá síťová pevná látka. Vazbový úhel Si-Si je 109 o 28 ‚, zatímco délka vazby je 2,35 o
Vzhledem k překrývání hybridních orbitalů jsou kovalentní vazby Si-Si velmi silné a jsou směrové. Přítomnost sítě silných kovalentních vazeb je příčinou tvrdosti a jeho vysoké teploty tání.
Elektrony v kovalentní vazbě jsou lokalizovány, proto křemík není dobrým vodičem elektřiny a tepla. Je to však polovodič. Kvůli nedostupnosti volných elektronů je křemík při teplotě absolutní nuly izolantem. Křemík je však polovodič. Pokud se teplota zvýší, kovalentní vazby se přeruší a uvolní se elektrony, které mohou vést elektřinu. S rostoucí teplotou se tedy zvyšuje vodivost.