Chemický prvek uhlík se řadí mezi nekovy. Je znám již od starověku. Jeho objevitel ani datum objevu nejsou známy.

Datová zóna
| Klasifikace: | Uhlík je nekov |
| Barva: | černý (grafit), průhledný (diamant) |
| Atomová hmotnost: | 12.011 |
| Stav: | pevná látka |
| Teplota tání: | 3550 oC, 3823 K |
| Poznámka: Za normálního atmosférického tlaku uhlík při zahřívání netaví, sublimuje. Tj. prochází fázovou změnou přímo z pevné látky na plyn. Pokud se tlak zvýší na 10 atmosfér, pozoruje se tání uhlíku (grafitu) při teplotě 3550 °C. | |
| Teplota varu: | 3825 oC, 4098 K |
| Citovaný bod varu se zaznamená, když tlak par grafitu nad sublimujícím grafitem dosáhne 1 atmosféry. | |
| Elektrony: | 6 |
| Protony: | 6 |
| Neutrony v nejhojnějším izotopu: | 6 |
| Elektronové obaly: | 2,4 |
| Elektronová konfigurace: | 1s2 2s2 2p2 |
| Hustota při 20oC: | 2.267 g/cm3 (gr), 3,513 g/cm3 (di) |
Zobrazit více, včetně:
Sloučeniny, poloměry, vodivosti
| Objem atomu: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Struktura: | hexagonální vrstvy (grafit), tetraedrické (diamant) |
| Tvrdost: | 0,5 mohs (grafit), 10,0 mohs (diamant) |
| Měrná tepelná kapacita | 0,71 J g-1 K-1 (grafit), 0.5091 J g-1 K-1 (diamant) |
| Tavné teplo | 117 kJ mol-1 (grafit) |
| Atomizační teplo | 717 kJ mol-1 |
| Výparné teplo | 710.9 kJ mol-1 |
| 1. ionizační energie | 1086.5 kJ mol-1 |
| 2. ionizační energie | 2352,6 kJ mol-1 |
| 3. ionizační energie | 4620,5 kJ mol-1 |
| Elektronová afinita | 121.55 kJ mol-1 |
| Minimální oxidační číslo | -4 |
| Min. běžné oxidační č. | -4 |
| Maximální oxidační číslo | 4 |
| Maximální běžné oxidační č. | 4 |
| Elektronegativita (Paulingova stupnice) | 2,55 |
| Polarizační objem | 1.8 Å3 |
| Reakce se vzduchem | prudká, ⇒ CO2 |
| Reakce s 15 M HNO3 | mírná, w/ht ⇒ C6(CO2H)6 (kyselina mellitová/grafitová) |
| reakce s 6 M HCl | žádná |
| Reakce s 6 M NaOH | žádný |
| Oxid(y) | CO , CO2 |
| Hydrid(y) | CH4 a mnoho CxHy |
| Chlorid(y) | CCl4 |
| Atomický poloměr | 70 pm |
| Iontový poloměr (1+ ion) | – |
| Iontový poloměr (2+ ion) | – |
| Iontový poloměr (3+ ion) | – |
| Iontový poloměr (1- ion) | – |
| Iontový poloměr (2- ion) | – |
| Iontový poloměr (3- ion) | – |
| Tepelná vodivost | 25-470 W m-1 K-1 (grafit), 470 W m-1 K-1 (diamant) |
| Elektrická vodivost | 0.07 x 106 S m-1 |
| Teplota tuhnutí/topení: | 3550 oC, 3823 K |

Modely struktury uhlíkových nanotrubic.

Lavoisier používá obří čočku při experimentech s hořením
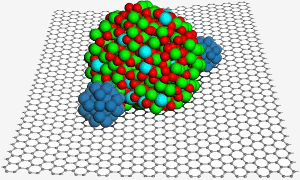
Povrch grafenu hostí nanočástici oxidu india a cínu, která pomáhá zajistit dvě nanočástice platiny (modře) pro lepší katalýzu v palivovém článku. Obr: PNL.
Objev uhlíku
Uhlík je znám již od starověku v podobě sazí, dřevěného uhlí, grafitu a diamantů. Starověké kultury si ovšem neuvědomovaly, že tyto látky jsou různými formami téhož prvku
Francouzský vědec Antoine Lavoisier pojmenoval uhlík a prováděl řadu pokusů, aby odhalil jeho podstatu.
V roce 1772 spojil prostředky s dalšími chemiky a koupil diamant, který umístili do uzavřené skleněné nádoby. Pozoruhodnou obří lupou zaměřili na diamant sluneční paprsky a viděli, jak diamant hoří a mizí.
Lavoisier si všiml, že celková hmotnost sklenice se nezměnila a že při hoření se diamant spojil s kyslíkem za vzniku oxidu uhličitého. (1), (2) Došel k závěru, že diamant a dřevěné uhlí jsou tvořeny stejným prvkem – uhlíkem.
V roce 1779 švédský vědec Carl Scheele prokázal, že grafit při hoření tvoří oxid uhličitý, a musí tedy jít o jinou formu uhlíku.3)
V roce 1796 anglický chemik Smithson Tennant zjistil, že diamant je čistý uhlík, a nikoli jeho sloučenina; při hoření tvoří pouze oxid uhličitý.4)
Tennant také prokázal, že při hoření stejných hmotností dřevěného uhlí a diamantu vzniká stejné množství oxidu uhličitého. (4)
V roce 1855 anglický chemik Benjamin Brodie vyrobil z uhlíku čistý grafit, čímž dokázal, že grafit je forma uhlíku.4)
Přestože se o to již dříve neúspěšně pokoušeli, v roce 1955 americký vědec Francis Bundy a jeho spolupracovníci z General Electric konečně prokázali, že grafit lze při vysoké teplotě a vysokém tlaku přeměnit na diamant.(5)
V roce 1985 objevili Robert Curl, Harry Kroto a Richard Smalley fullereny, novou formu uhlíku, v níž jsou atomy uspořádány do tvaru fotbalového míče. Nejznámějším fullerenem je buckminsterfulleren, známý také jako C60, který se skládá z 60 atomů uhlíku. Existuje velká rodina fullerenů, počínaje C20 a konče C540. (6), (7)
Nejnověji objeveným alotropem uhlíku je grafen, který se skládá z jedné vrstvy atomů uhlíku uspořádaných do šestiúhelníků. Kdyby se tyto vrstvy poskládaly na sebe, vznikl by grafit. Grafen má tloušťku pouhého jednoho atomu.
Objev grafenu oznámili v roce 2004 Kosťa Novoselov a Andre Geim, kteří pomocí lepicí pásky oddělili z grafitu jednu vrstvu atomů a vytvořili tak nový alotrop.
Zajímavá fakta o uhlíku
- Přibližně 20 % hmotnosti živých organismů tvoří uhlík.
- Je známo více sloučenin, které uhlík obsahují, než neobsahují.
- Uhlík je čtvrtým nejrozšířenějším prvkem ve vesmíru.
- Přes jeho vysoký výskyt vděčíme za jeho existenci nepravděpodobné souhře okolností
- Diamant je vynikající brusivo, protože je nejtvrdším běžným materiálem a má také nejvyšší tepelnou vodivost. Dokáže obrousit jakoukoli látku, zatímco teplo vzniklé třením je rychle odváděno pryč.
- Všechny atomy uhlíku ve vašem těle byly kdysi součástí frakce oxidu uhličitého v atmosféře.
- Grafén je nejtenčí a nejpevnější materiál, jaký byl kdy znám.
- Grafén je tvořen dvojrozměrnými atomovými krystaly, což je poprvé, co byly takové struktury pozorovány.
- Grafín v typické mechanické tužce má průměr 0,7 mm. To odpovídá 2 milionům vrstev grafenu.
- Automobilové pneumatiky jsou černé, protože obsahují asi 30 % sazí, které se přidávají do gumy, aby ji zpevnily. Saze také pomáhají chránit pneumatiky před poškozením UV zářením. 8)
- Uhlík vzniká ve hvězdách při spalování helia v reakcích jaderné fúze. Uhlík je součástí „popela“ vznikajícího při hoření helia.
- Uhlík prochází v těžkých hvězdách reakcemi jaderné fúze, při nichž vzniká neon, hořčík a kyslík.




Vlevo: Spalování uhlí (především amorfního uhlíku) na vzduchu. Vpravo: Diamanty (krystalický uhlík). Přemýšleli jsme, že vyfotíme hořící diamanty – hoří při teplotě asi 800oC – ale nemohli jsme si to dovolit!“

Naší planetě dominují formy života založené na uhlíku, jako jsou tyto.

DNA. Slavná dvoušroubovicová molekula je umožněna schopností uhlíku vytvářet dlouhé molekulární řetězce.
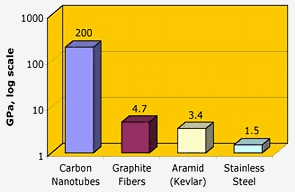
Nasa: Uhlíkové nanotrubičky mají mimořádnou pevnost v tahu – o dva řády vyšší než grafitová vlákna, kevlar nebo ocel.
Sousedství uhlíku v periodické tabulce
| skupina 13 |
skupina 14 |
Skupina 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
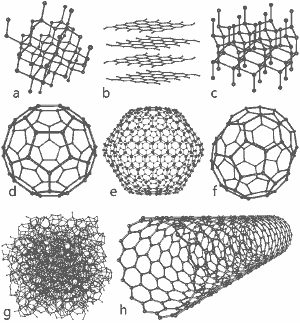
Nádherný obrázek vydaný Michaelem Ströckem pod GNU Free Documentation License: Struktura osmi alotropů uhlíku: a) Diamant b) Grafit c) Lonsdaleit d) C60 (Buckminsterfulleren) e) Fulleren C540 f) Fulleren C70 g) Amorfní uhlík h) Jednostěnná uhlíková nanotrubička. Pro větší obrázek klikněte zde.
Vzhled a vlastnosti
Škodlivé účinky:
Čistý uhlík má velmi nízkou toxicitu. Vdechování velkého množství uhelného prachu (sazí/uhelného prachu) může způsobit podráždění a poškození plic.
Vlastnosti:
Uhlík může existovat s několika různými trojrozměrnými strukturami, ve kterých jsou jeho atomy různě uspořádány (alotropy).
Tři běžné krystalické alotropy jsou grafit, diamant a (obvykle) fullereny. Grafen má 2D krystalovou strukturu (fullereny mohou někdy existovat v amorfní formě).9)
Uhlík může existovat také v amorfním stavu. Mnoho alotropů běžně označovaných jako amorfní, jako je skelný uhlík, saze nebo saze, má však obvykle dostatečnou strukturu na to, aby nebyly skutečně amorfní. Byly sice pozorovány krystalické nanotrubičky, ale ty jsou obecně amorfní.10)
Struktury osmi alotropů jsou uvedeny na konci této stránky.11)
Zajímavé je, že grafit je jednou z nejměkčích látek a diamant byl donedávna považován za nejtvrdší přírodně se vyskytující látku.
Mimořádně vzácný alotrop uhlíku, lonsdaleit, byl v čisté formě vypočten jako o 58 % pevnější než diamant. Lonsdaleit je síť uhlíku podobná diamantu, která má hexagonální strukturu grafitu. Vzniká při dopadu meteoritů obsahujících grafit na jiné těleso, například na Zemi. Vysoké teploty a tlaky při dopadu přemění grafit na lonsdaleit.
Uhlík má nejvyšší bod tání/sublimace ze všech prvků a ve formě diamantu má nejvyšší tepelnou vodivost ze všech prvků.
Vysoká tepelná vodivost diamantu je původem slangového výrazu „led“. Při běžných pokojových teplotách je teplota vašeho těla vyšší než teplota místnosti – včetně velkých diamantů, které se vám náhodou povalují kolem. Pokud se některého z těchto diamantů dotknete, jejich vysoká tepelná vodivost odvede teplo od vaší pokožky rychleji než jakýkoli jiný materiál. Váš mozek si tento rychlý přenos tepelné energie od pokožky vykládá tak, že se dotýkáte něčeho velmi studeného – takže diamanty při pokojové teplotě mohou působit jako led.
Využití uhlíku
Uhlík (ve formě uhlí, které je tvořeno hlavně uhlíkem) se používá jako palivo.
Grafit se používá na hroty tužek, vysokoteplotní kelímky, suché články, elektrody a jako mazivo.
Diamanty se používají ve šperkařství a – protože jsou velmi tvrdé – v průmyslu k řezání, vrtání, broušení a leštění.
Uhlíková čerň se používá jako černý pigment v tiskařské barvě.
Uhlík může tvořit slitiny se železem, z nichž nejběžnější je uhlíková ocel.
Radioaktivní izotop 14C se používá při archeologickém datování.
Sloučeniny uhlíku jsou důležité v mnoha oblastech chemického průmyslu – uhlík tvoří velké množství sloučenin s vodíkem, kyslíkem, dusíkem a dalšími prvky.
Obsah a izotopy
Obsah zemské kůry: 200 hmotnostních dílů na milion, 344 molů na milion
Obsah sluneční soustavy: Cena, čistá: 2,4 USD za 100 g
Cena, volně ložená: 1 USD za 100 g
Zdroj: Uhlík lze získat spalováním organických sloučenin s nedostatkem kyslíku. Čtyřmi hlavními alotropy uhlíku jsou grafit, diamant, amorfní uhlík a fullereny.
Přírodní diamanty se nacházejí v kimberlitu ze starých sopek.
Grafit lze rovněž nalézt v přírodních ložiscích.
Fullereny byly objeveny jako vedlejší produkty experimentů s molekulárními paprsky v 80. letech 20. století.
Amorfní uhlík je hlavní složkou dřevěného uhlí, sazí (sazí) a aktivního uhlí.
Izotopy: 13, jejichž poločasy rozpadu jsou známy, s hmotnostními čísly 8 až 20. Přirozeně se vyskytující uhlík je směsí dvou izotopů a vyskytují se v uvedených procentech: 12C (99 %) a 13C (1 %).
Izotop 14C s poločasem rozpadu 5730 let je široce používán k datování uhlíkatých materiálů, jako je dřevo, archeologické vzorky atd., pro stáří až cca 40 000 let.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide, (2006) s192. Greenwood Publishing Group
- Mary Elvira Weeks, Objevení prvků. I. Prvky známé již ve starověku, J. Chem. Educ. 1932, 9 (1), s. 4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses, (2006) s507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective, (2000) s3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) s145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) s423. Wiley.
- Nobelova cena za chemii, 1996
- Co potřebujeme k výrobě pneumatiky?
- Ming Gao a Hui Zhang, Preparation of an amorphous fullerene film, Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Citujte tuto stránku
Pro online odkazování zkopírujte a vložte jednu z následujících možností:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
nebo
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Chcete-li tuto stránku citovat v akademickém dokumentu, použijte následující citaci v souladu s MLA:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.
.