Det kemiska grundämnet kol klassas som en ickemetall. Det har varit känt sedan antiken. Dess upptäckare och upptäcktsdatum är okända.

Datazon
| Klassificering: | Kol är en ickemetall |
| Färg: | Svart (grafit), transparent (diamant) |
| Atomvikt: | 12.011 |
| Tillstånd: | fast |
| Smältpunkt: | 3550 oC, 3823 K |
| Anmärkningar: Vid normalt atmosfärstryck smälter kol inte när det värms upp, utan sublimeras. D.v.s. det genomgår en fasförändring direkt från fast ämne till gas. Om trycket ökas till 10 atmosfärer observeras kol (grafit) smälta vid 3550 °C. | |
| Skokpunkt: | 3825 oC, 4098 K |
| Den angivna kokpunkten registreras när grafitångtrycket över sublimerande grafit når 1 atmosfär. | |
| Elektroner: | 6 |
| Protoner: | 6 |
| Neutroner i den vanligaste isotopen: | 6 |
| Elektronskal: | 2,4 |
| Elektronkonfiguration: | 1s2 2s2 2p2 |
| Täthet @ 20oC: | 2.267 g/cm3 (gr), 3,513 g/cm3 (di) |
Visa mer, inklusive: Värme, energi, oxidation, reaktioner,
föreningar, radier, ledningsförmåga
| Atomvolym: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Struktur: | hexagonala skikt (grafit), tetraedriska (diamant) |
| Hårdhet: | 0,5 mohs (grafit), 10,0 mohs (diamant) |
| Specifik värmekapacitet | 0,71 J g-1 K-1 (grafit), 0.5091 J g-1 K-1 (diamant) |
| Fusionsvärme | 117 kJ mol-1 (grafit) |
| Förbränningsvärme | 717 kJ mol-1 |
| Förbränningsvärme | 710.9 kJ mol-1 |
| 1:a joniseringsenergi | 1086.5 kJ mol-1 |
| 2:a joniseringsenergi | 2352,6 kJ mol-1 |
| 3:a joniseringsenergi | 4620,5 kJ mol-1 |
| Elektronaffinitet | 121.55 kJ mol-1 |
| Minsta oxidationsnummer | -4 |
| Minsta vanliga oxidationsnr. | -4 |
| Maximalt oxidationsnummer | 4 |
| Max. gemensamt oxidationsnr. | 4 |
| Elektronegativitet (Paulingskala) | 2,55 |
| Volym för polariserbarhet | 1.8 Å3 |
| Reaktion med luft | kraftig, ⇒ CO2 |
| Reaktion med 15 M HNO3 | mild, w/ht ⇒ C6(CO2H)6 (mellitisk/grafittisk syra) |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | CO , CO2 |
| Hydrid(er) | CH4 och många CxHy |
| Klorid(er) | CCl4 |
| Atomradie | 70 pm |
| Ionisk radie (1+ jon) | – |
| Ionisk radie (2+ jon) | – |
| Ionisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2-jon) | – |
| Jonisk radie (3-jon) | – |
| Värmekonduktivitet | 25-470 W m-1 K-1 (grafit), 470 W m-1 K-1 (diamant) |
| Elektrisk ledningsförmåga | 0.07 x 106 S m-1 |
| Frys-/smältpunkt: | 3550 oC, 3823 K |

Modeller av kolnanorörstruktur.

Lavoisier använder en jättelins i förbränningsexperiment
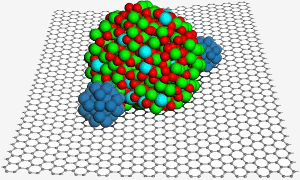
En grafenyta är värd för en nanopartikel av indiumtinoxid, som hjälper till att säkra två nanopartiklar av platina (blått) för förbättrad katalys i en bränslecell. Bild: PNL.
Kolets upptäckt
Kol har varit känt sedan urminnes tider i form av sot, träkol, grafit och diamanter. Forntida kulturer insåg naturligtvis inte att dessa ämnen var olika former av samma grundämne
Den franske vetenskapsmannen Antoine Lavoisier gav kolet ett namn och han utförde en rad olika experiment för att avslöja dess natur.
År 1772 slog han ihop sina resurser med andra kemister för att köpa en diamant, som de placerade i en stängd glasburk. De fokuserade solens strålar på diamanten med ett anmärkningsvärt jättelikt förstoringsglas och såg diamanten brinna och försvinna.
Lavoisier noterade att glasets totala vikt var oförändrad och att när den brann hade diamanten förenats med syre för att bilda koldioxid. (1), (2) Han drog slutsatsen att diamant och träkol var gjorda av samma grundämne – kol.
1779 visade den svenske vetenskapsmannen Carl Scheele att grafit vid förbränning bildade koldioxid och att det därför måste vara en annan form av kol. 3)
1796 fastställde den engelske kemisten Smithson Tennant att diamant var rent kol och inte en kolförening; den brann och bildade endast koldioxid. 3)
Tennant bevisade också att när lika tunga mängder träkol och diamanter förbrändes, producerade de samma mängd koldioxid. (4)
År 1855 framställde den engelske kemisten Benjamin Brodie ren grafit från kol, vilket bevisade att grafit var en form av kol.(4)
Även om det tidigare hade försökts utan framgång, visade 1955 den amerikanske forskaren Francis Bundy och medarbetare vid General Electric slutligen att grafit kunde omvandlas till diamant vid hög temperatur och högt tryck.(5)
1985 upptäckte Robert Curl, Harry Kroto och Richard Smalley fullerener, en ny form av kol där atomerna är arrangerade i form av fotbollsbollar. Den mest kända fullerenen är buckminsterfulleren, även känd som C60, som består av 60 kolatomer. Det finns en stor familj av fullerener, från C20 till C540. (6), (7)
Den senast upptäckta allotropen av kol är grafen, som består av ett enda lager av kolatomer arrangerade i hexagoner. Om dessa lager staplas på varandra skulle grafit bli resultatet. Grafen har en tjocklek på bara en atom.
Upptäckten av grafen tillkännagavs 2004 av Kostya Novoselov och Andre Geim, som använde tejp för att lossa ett enda lager atomer från grafit för att framställa den nya allotropen.
Interessanta fakta om kol
- Omkring 20 % av vikten hos levande organismer består av kol.
- Det finns fler kända föreningar som innehåller kol än som inte gör det.
- Kol är det fjärde vanligaste grundämnet i universum.
- Trots sin höga förekomst har vi kolets existens att tacka för en osannolik uppsättning omständigheter
- Diamant är ett utmärkt slipmedel eftersom det är det hårdaste vanliga materialet och det har också den högsta värmeledningsförmågan. Den kan slipa ner vilket ämne som helst, samtidigt som den värme som uppstår vid friktion snabbt leds bort.
- Kolatomerna i din kropp var alla en gång i tiden en del av koldioxidfraktionen i atmosfären.
- Grafen är det tunnaste och starkaste material som någonsin varit känt.
- Grafen består av tvådimensionella atomkristaller, vilket är första gången sådana strukturer någonsin har setts.
- Grafinen i en typisk mekanisk penna har en diameter på 0,7 mm. Detta motsvarar 2 miljoner lager grafen.
- Bildäck är svarta eftersom de består av cirka 30 % kimrök, som tillsätts till gummi för att stärka det. Kolsyran hjälper också till att skydda däcken mot UV-skador. 8.
- Kol tillverkas i stjärnor när de förbränner helium i kärnfusionsreaktioner. Kol ingår i den ”aska” som bildas vid heliumförbränning.
- Kol genomgår kärnfusionsreaktioner i tunga stjärnor för att göra neon, magnesium och syre.




Vänster: Förbränning av kol (huvudsakligen amorft kol) i luft. Till höger: Diamanter (kristallint kol). Vi funderade på att ta en bild av förbrända diamanter – de förbränns vid cirka 800oC – men vi hade inte råd med det!

Kolbaserade livsformer, som dessa, dominerar vår planet.

DNA. Den berömda dubbelhelixmolekylen möjliggörs av kolets förmåga att bilda långa molekylkedjor.
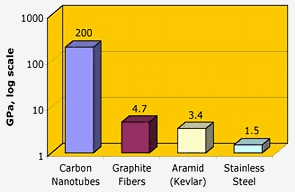
Nasa: Kolnanorör har en enastående draghållfasthet – två storleksordningar högre än grafitfibrer, kevlar eller stål.
Kolonnätet i det periodiska systemet
| Grupp 13 |
Grupp 14 |
Grupp 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
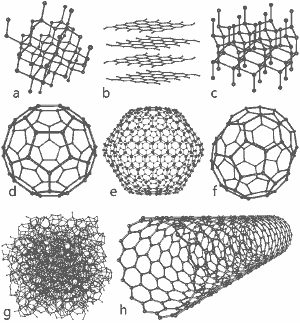
En underbar bild utgiven av Michael Ströck under GNU Free Documentation License: Strukturen hos åtta kolallotroper: a) Diamant b) Grafit c) Lonsdaleit d) C60 (Buckminsterfulleren) e) C540 Fulleren f) C70 Fulleren g) Amorft kol h) Enkelväggigt kolnanorör. Klicka här för större bild.
Uppträdande och egenskaper
Skadliga effekter:
Rent kol har mycket låg toxicitet. Inandning av stora mängder kimrökstoft (sot/kolstoft) kan orsaka irritation och skador på lungorna.
Egenskaper:
Kol kan existera med flera olika tredimensionella strukturer där dess atomer är arrangerade på olika sätt (allotroper).
Tre vanliga kristallina allotroper är grafit, diamant och (vanligtvis) fullerener. Grafen har en 2D-kristallstruktur (Fullerener kan ibland existera i amorf form). 9)
Kol kan också existera i amorft tillstånd. Många allotroper som vanligen beskrivs som amorfa, såsom glasartat kol, sot eller kimrök, har dock vanligtvis tillräckligt med struktur för att inte vara verkligt amorfa. Även om kristallina nanorör har observerats är de i allmänhet amorfa. 10
Strukturerna för åtta allotroper visas längst ner på denna sida.
Intressant nog är grafit ett av de mjukaste ämnena och diamant trodde man, tills nyligen, att det var det hårdaste naturligt förekommande ämnet.
En extremt sällsynt allotrope av kol, lonsdaleit, har i ren form beräknats vara 58 procent starkare än diamant. Lonsdaleit är ett diamantliknande kolnätverk som har grafitens hexagonala struktur. Den bildas när meteoriter som innehåller grafit träffar en annan kropp, till exempel jorden. De höga temperaturerna och trycken vid nedslaget omvandlar grafit till lonsdaleit.
Kol har den högsta smält-/sublimationspunkten av alla grundämnen och har i form av diamant den högsta värmeledningsförmågan av alla grundämnen.
Diamants höga värmeledningsförmåga är ursprunget till slanguttrycket ”is”. Vid typiska rumstemperaturer är din kroppstemperatur högre än rummets – inklusive eventuella stora diamanter som du råkar ha liggande. Om du rör vid någon av dessa diamanter transporterar deras höga värmeledningsförmåga värmen bort från din hud snabbare än något annat material. Din hjärna tolkar denna snabba överföring av värmeenergi bort från huden som att du rör vid något mycket kallt – så diamanter i rumstemperatur kan kännas som is.
Användningar av kol
Kol (i form av kol, som huvudsakligen består av kol) används som bränsle.
Grafit används till pennspetsar, deglar för höga temperaturer, torrceller, elektroder och som smörjmedel.
Diamanter används i smycken och – eftersom de är så hårda – inom industrin för skärning, borrning, slipning och polering.
Kolsvart används som svart pigment i tryckfärg.
Kol kan bilda legeringar med järn, varav det vanligaste är kolstål.
Den radioaktiva isotopen 14C används vid arkeologisk datering.
Kolföreningar är viktiga inom många områden av den kemiska industrin – kol bildar ett stort antal föreningar med väte, syre, kväve och andra grundämnen.
Förråd och isotoper
Förråd jordskorpan: 200 delar per miljon i vikt, 344 delar per miljon i mol
Förråd solsystemet: Kostnad, ren: 2,4 dollar per 100 g
Kostnad, bulk: $ per 100 g
Källa: Källa: Den naturliga källan till den nya metoden: Kol kan erhållas genom förbränning av organiska föreningar med otillräckligt syre. De fyra viktigaste allotroperna av kol är grafit, diamant, amorft kol och fullerener.
Naturliga diamanter finns i kimberlit från gamla vulkaner.
Grafit kan också hittas i naturliga fyndigheter.
Fullerener upptäcktes som biprodukter från molekylstråleexperiment på 1980-talet.
Amorft kol är huvudbeståndsdelarna i träkol, sot (kimberlit) och aktivt kol.
Isotoper: 13 vars halveringstider är kända, med masstal 8 till 20. Naturligt förekommande kol är en blandning av två isotoper och de förekommer i de angivna procenttalen: 12C (99 %) och 13C (1 %).
Isotopen 14C, med en halveringstid på 5730 år, används ofta för att datera kolhaltiga material som trä, arkeologiska föremål etc. för åldrar upp till cirka 40 000 år.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide., (2006) s192. Greenwood Publishing Group
- Mary Elvira Weeks, Upptäckten av grundämnena. I. Elements known to the ancient world, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) s507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) s3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers, (1999) s145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) s423. Wiley.
- Nobelpriset i kemi, 1996
- Vad behöver vi för att göra ett däck?
- Ming Gao och Hui Zhang, Preparation of an amorphous fullerene film, Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite this Page
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
eller
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
För att citera denna sida i ett akademiskt dokument, vänligen använd följande MLA-kompatibla citat:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.