Det kemiske grundstof carbon er klassificeret som et ikke-metal. Det har været kendt siden oldtiden. Dets opdager og opdagelsesdato er ukendt.

Datazone
| Klassifikation: | Kulstof er et ikke-metal | |
| Farve: | Sort (grafit), transparent (diamant) | |
| Atomvægt: | 12.011 | |
| Status: | fast stof | |
| Smeltepunkt: | 3550 oC, 3823 K | |
| Bemærk: Ved normalt atmosfærisk tryk smelter kulstof ikke ved opvarmning, det sublimeres. Dvs. det gennemgår en faseændring direkte fra fast stof til gas. Hvis trykket øges til 10 atmosfærer, observeres det, at kulstof (grafit) smelter ved 3550 °C. | ||
| Sodningspunkt: | 3825 oC, 4098 K | |
| Det angivne kogepunkt registreres, når grafitdamptrykket over sublimerende grafit når op på 1 atmosfære. | ||
| Elektroner: | 6 | |
| Protoner: | 6 | 6 |
| Neutroner i den hyppigst forekommende isotop: | 6 | |
| Elektronskaller: | 2,4 | |
| Elektronkonfiguration: | 1s2 2s2 2p2 | |
| Densitet @ 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) | |
Vis mere, herunder: Varme, energi, oxidation, reaktioner,
forbindelser, radier, ledningsevner
| Atomvolumen: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Struktur: | hexagonale lag (grafit), tetraedriske (diamant) |
| Hårdhed: | 0,5 mohs (grafit), 10,0 mohs (diamant) |
| Specifik varmekapacitet | 0,71 J g-1 K-1 (grafit), 0.5091 J g-1 K-1 (diamant) |
| Smeltningsvarme | 117 kJ mol-1 (grafit) |
| Atomiseringsvarme | 717 kJ mol-1 |
| Fordampevarme | 710.9 kJ mol-1 |
| 1. ioniseringsenergi | 1086.5 kJ mol-1 |
| 2. ioniseringsenergi | 2352,6 kJ mol-1 |
| 3. ioniseringsenergi | 4620,5 kJ mol-1 |
| Elektronaffinitet | 121.55 kJ mol-1 |
| Minimalt oxidationstal | -4 |
| Min. almindeligt oxidationsnr. | -4 |
| Maksimalt oxidationstal | 4 |
| Maksimalt fælles oxidationstal | |
| 4 | |
| Elektronegativitet (Pauling-skala) | 2,55 |
| Polarisérbarhedsmængde | 1.8 Å3 |
| Reaktion med luft | kraftig, ⇒ CO2 |
| Reaktion med 15 M HNO3 | mild, w/ht ⇒ C6(CO2H)6 (mellitisk/grafittisk syre) |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | CO , CO2 |
| Hydrid(er) | CH4 og mange CxHy |
| Klorid(er) | CCl4 |
| Atomradius | 70 pm |
| Ionisk radius (1+ ion) | – |
| Ionisk radius (2+ ion) | – |
| Ionisk radius (3+ ion) | – |
| Ionisk radius (1- ion) | – |
| Ionisk radius (2-ion) | – |
| Ionisk radius (3-ion) | – |
| Varmeledningsevne | 25-470 W m-1 K-1 (grafit), 470 W m-1 K-1 (diamant) |
| Elektrisk ledningsevne | 0.07 x 106 S m-1 |
| Frost-/smeltepunkt: | 3550 oC, 3823 K |

Modeller af kulstofnanorørets struktur.

Lavoisier bruger en kæmpelinse i forbrændingsforsøg
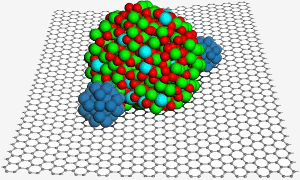
En grafenoverflade er vært for en indiumtinoxid-nanopartikel, som er med til at fastgøre to platinnanopartikler (blå) for at forbedre katalysen i en brændselscelle. Image: PNL.
Offentliggørelse af kulstof
Kulstof har været kendt siden oldtiden i form af sod, trækul, grafit og diamanter. De gamle kulturer var naturligvis ikke klar over, at disse stoffer var forskellige former for det samme grundstof
Den franske videnskabsmand Antoine Lavoisier gav kulstof et navn, og han udførte en række eksperimenter for at afsløre dets natur.
I 1772 slog han sig sammen med andre kemikere for at købe en diamant, som de placerede i en lukket glaskrukke. De fokuserede solens stråler på diamanten med en bemærkelsesværdig kæmpe lup og så diamanten brænde og forsvinde.
Lavoisier bemærkede, at glassets samlede vægt var uændret, og at diamanten, da den brændte, havde forenet sig med ilt til kuldioxid. (1), (2) Han konkluderede, at diamant og trækul var lavet af det samme grundstof – kulstof.
I 1779 viste den svenske videnskabsmand Carl Scheele, at grafit ved forbrænding dannede kuldioxid og derfor måtte være en anden form for kulstof. 3)
I 1796 fastslog den engelske kemiker Smithson Tennant, at diamant var rent kulstof og ikke en kulstofforbindelse; den brændte og dannede kun kuldioxid. 3)
Tennant beviste også, at når lige store mængder trækul og diamanter blev brændt, producerede de den samme mængde kuldioxid. (4)
I 1855 fremstillede den engelske kemiker Benjamin Brodie ren grafit af kulstof, hvilket beviste, at grafit var en form for kulstof.(4)
Selv om det tidligere var blevet forsøgt uden held, viste den amerikanske videnskabsmand Francis Bundy og hans medarbejdere ved General Electric i 1955 endelig, at grafit kunne omdannes til diamant ved høj temperatur og højt tryk.(5)
I 1985 opdagede Robert Curl, Harry Kroto og Richard Smalley fullerener, en ny form for kulstof, hvor atomerne er arrangeret i form af fodbolde. Den bedst kendte fulleren er buckminsterfulleren, også kendt som C60, der består af 60 kulstofatomer. Der findes en stor familie af fullerener, der starter ved C20 og når op til C540. (6), (7)
Den senest opdagede allotrope af kulstof er grafen, som består af et enkelt lag kulstofatomer arrangeret i sekskantede sekskanter. Hvis disse lag blev stablet oven på hinanden, ville resultatet være grafit. Grafen har en tykkelse på kun ét atom.
Graphenes opdagelse blev annonceret i 2004 af Kostya Novoselov og Andre Geim, som brugte tape til at løsne et enkelt lag atomer fra grafit for at fremstille den nye allotrope.
Interessante fakta om kulstof
- Omkring 20 % af vægten af levende organismer består af kulstof.
- Der kendes flere forbindelser, der indeholder kulstof, end der ikke gør.
- Kulstof er det fjerde mest hyppige grundstof i universet.
- På trods af dets store hyppighed skylder vi kulstoffets eksistens et usandsynligt sæt omstændigheder
- Diamant er et fremragende slibemiddel, fordi det er det hårdeste almindelige materiale, og det har også den højeste varmeledningsevne. Det kan slibe ethvert stof ned, mens den varme, der opstår ved friktion, hurtigt ledes væk.
- Kulstofatomerne i din krop var alle engang en del af kuldioxidfraktionen i atmosfæren.
- Grafen er det tyndeste og stærkeste materiale, der nogensinde er kendt.
- Grafen er lavet af 2-dimensionelle atomkrystaller, hvilket er første gang, at sådanne strukturer nogensinde er set.
- Grafitten i en typisk trykblyant har en diameter på 0,7 mm. Det svarer til 2 millioner lag grafen.
- Autodæk er sorte, fordi de består af ca. 30 % carbon black, som tilsættes til gummi for at styrke det. Carbon black er også med til at beskytte mod UV-skader på dækkene. 8.
- Kulstof fremstilles i stjerner, når de forbrænder helium i kernefusionsreaktioner. Kulstof er en del af den “aske”, der dannes ved heliumforbrænding.
- Kulstof gennemgår kernefusionsreaktioner i tunge stjerner for at lave neon, magnesium og ilt.




Venstre: Forbrænding af kul (hovedsageligt amorft kulstof) i luft. Til højre: Diamanter (krystallinsk kulstof). Vi overvejede at tage et billede af diamanter i forbrænding – de forbrændes ved ca. 800oC – men det havde vi ikke råd til!

Kulstofbaserede livsformer, som disse, dominerer vores planet.

DNA. Det berømte dobbelt-helix-molekyle er muliggjort af kulstofs evne til at danne lange molekylære kæder.
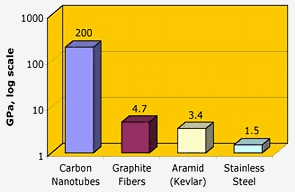
Nasa: Carbon nanotubes har en enestående trækstyrke – to størrelsesordener højere end grafitfibre, kevlar eller stål.
Kulstofs periodiske system nabo
| Gruppe 13 |
Gruppe 14 |
Gruppe 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
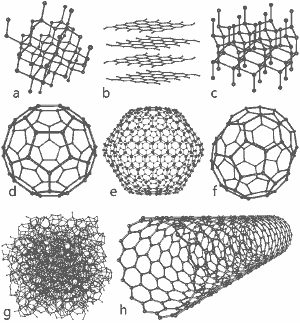
Et vidunderligt billede udgivet af Michael Ströck under GNU Free Documentation License: Strukturen af otte allotroper af kulstof: a) Diamant b) Grafit c) Lonsdaleit d) C60 (Buckminsterfullerene) e) C540 Fullerene f) C70 Fullerene g) Amorft kulstof h) Enkeltvægget kulstofnanorør. Klik her for større billede.
Udseende og karakteristika
Skadelige virkninger:
Rent kulstof har meget lav toksicitet. Indånding af store mængder kulsort støv (sod/kulstøv) kan forårsage irritation og skade på lungerne.
Egenskaber:
Kulstof kan eksistere med flere forskellige 3-dimensionelle strukturer, hvor dets atomer er arrangeret forskelligt (allotroper).
Tre almindelige krystallinske allotroper er grafit, diamant og (normalt) fullerener. Grafen har en 2D-krystalstruktur. (Fullerener kan undertiden eksistere i amorf form.)(9)
Kulstof kan også eksistere i amorf tilstand. Mange allotroper, der almindeligvis beskrives som amorfe, som f.eks. glasagtigt kulstof, sod eller kulsort, har dog normalt tilstrækkelig struktur til ikke at være virkelig amorfe. Selv om der er observeret krystallinske nanorør, er de generelt amorfe. 10)
Strukturen af otte allotroper er vist nederst på denne side.
Interessant nok er grafit et af de blødeste stoffer, og diamant blev indtil for nylig anset for at være det hårdeste naturligt forekommende stof.
En ekstremt sjælden allotrope af kulstof, lonsdaleit, er i ren form blevet beregnet til at være 58% stærkere end diamant. Lonsdaleit er et diamantlignende kulstofnetværk, som har grafitens sekskantede struktur. Det opstår, når meteoritter, der indeholder grafit, rammer et andet legeme, f.eks. jorden. De høje temperaturer og det høje tryk ved nedslaget omdanner grafit til lonsdaleit.
Kulstof har det højeste smelte-/sublimeringspunkt af alle grundstoffer og har i form af diamant den højeste varmeledningsevne af alle grundstoffer.
Diamantens høje varmeledningsevne er oprindelsen til slangudtrykket “is”. Ved typiske stuetemperaturer er din kropstemperatur højere end rummets temperatur – inklusive eventuelle store diamanter, som du tilfældigvis har liggende. Hvis du rører ved en af disse diamanter, transporterer deres høje varmeledningsevne varmen væk fra din hud hurtigere end noget andet materiale. Din hjerne fortolker denne hurtige overførsel af varmeenergi væk fra din hud som et tegn på, at du rører ved noget meget koldt – så diamanter ved stuetemperatur kan føles som is.
Anvendelser af kulstof
Kulstof (i form af kul, som hovedsageligt består af kulstof) bruges som brændstof.
Grafit bruges til blyantspidser, højtemperaturdigler, tørceller, elektroder og som smøremiddel.
Diamanter anvendes i smykker og – fordi de er så hårde – i industrien til skæring, boring, slibning og polering.
Carbon black anvendes som sort pigment i trykfarve.
Carbon kan danne legeringer med jern, hvoraf det mest almindelige er kulstofstål.
Den radioaktive isotop 14C anvendes til arkæologisk datering.
Kulstofforbindelser er vigtige inden for mange områder af den kemiske industri – kulstof danner et stort antal forbindelser med brint, ilt, nitrogen og andre grundstoffer.
Forsyning og isotoper
Forsyning jordskorpen: 200 vægtdele pr. million, 344 dele pr. million i mol
Forsyning solsystemet: 3000 vægtdele pr. million, 300 moldele pr. million
Omkostninger, ren: 2,4 $ pr. 100 g
Omkostninger, bulk: $ pr. 100 g
Kilde: Kulstof kan fås ved forbrænding af organiske forbindelser med utilstrækkelig ilt. De fire vigtigste allotroper af kulstof er grafit, diamant, amorf kulstof og fullerener.
Naturlige diamanter findes i kimberlit fra gamle vulkaner.
Grafit kan også findes i naturlige forekomster.
Fullerener blev opdaget som biprodukter fra molekylærstråleeksperimenter i 1980’erne.
Amorft kulstof er den vigtigste bestanddel af trækul, sod (carbon black) og aktivt kul.
Isotoper: 13, hvis halveringstider er kendt, med massetal 8 til 20. Naturligt forekommende kulstof er en blanding af to isotoper, og de findes i de viste procentdele: 12C (99 %) og 13C (1 %).
Isotop 14C, med en halveringstid på 5730 år, anvendes i vid udstrækning til at datere kulstofholdige materialer som træ, arkæologiske prøver osv. for aldre op til ca. 40 000 år.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide, (2006) s192. Greenwood Publishing Group
- Mary Elvira Weeks, The discovery of the elements. I. Elementer kendt i den antikke verden, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers, (1999) s145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) s423. Wiley.
- Nobelprisen for kemi, 1996
- Hvad skal vi bruge for at lave et dæk?
- Ming Gao og Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite this Page
For online linking, please copy and paste one of the following:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
or
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
To cite this page in a academic document, please use the following MLA compliant citation:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.