Kemiallinen alkuaine hiili luokitellaan ei-metalliin. Se on tunnettu jo antiikin ajoista lähtien. Sen löytäjä ja löytämisajankohta ovat tuntemattomia.

Tietovyöhyke
| Luokitus: | Hiili on epämetalli |
| Väri: | Musta (grafiitti), läpinäkyvä (timantti) |
| Atomipaino: | 12.011 |
| Tila: | kiinteä |
| Sulamispiste: | 3550 oC, 3823 K |
| Huomautus: Normaalissa ilmanpaineessa hiilidioksidi ei sula kuumentuessaan, vaan se sublimoituu. eli se käy läpi faasimuutoksen suoraan kiinteästä aineesta kaasuksi. Jos paine nostetaan 10 atmosfääriin, hiilen (grafiitin) havaitaan sulavan 3550 °C:ssa. | |
| Kiehumispiste: | 3825 oC, 4098 K |
| Kiehumispisteen ilmoittama kiehumispiste merkitään, kun sublimoituvan grafiitin yläpuolella oleva grafiitin höyrynpaine saavuttaa 1 atmosfäärin. | |
| Elektronit: | 6 |
| Protonit: | 6 |
| Neutronit runsaslukuisimmassa isotoopissa: | 6 |
| Elektronikuoret: | 2,4 |
| Elektronikonfiguraatio: | 1s2 2s2 2p2 |
| Tiheys @ 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Näytä lisää, mm: Lämmöt, energiat, hapettuminen, reaktiot,
Yhdisteet, säteet, johtavuudet
| Atomin tilavuus: | 5.31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Rakenne: | heksagonaaliset kerrokset (grafiitti), tetraedriset (timantti) |
| Kovuus: | 0.5 mohs (grafiitti), 10.0 mohs (timantti) |
| Ominaislämpökapasiteetti | 0.71 J g-1 K-1 (grafiitti), 0.5091 J g-1 K-1 (timantti) |
| Sulamislämpö | 117 kJ mol-1 (grafiitti) |
| Suihkutuslämpö | 717 kJ mol-1 |
| höyrystymislämpö | 710.9 kJ mol-1 |
| 1. ionisaatioenergia | 1086.5 kJ mol-1 |
| 2. ionisaatioenergia | 2352.6 kJ mol-1 |
| 3. ionisaatioenergia | 4620.5 kJ mol-1 |
| Elektronien affiniteetti | 121.55 kJ mol-1 |
| Minimi hapetusluku | -4 |
| Min. yleinen hapetusluku. | -4 |
| Maksimi hapetusluku | 4 |
| Max. yhteinen hapetusluku nro. | 4 |
| Elektronegatiivisuus (Paulingin asteikko) | 2.55 |
| Polarisoituvuusmäärä | 1.8 Å3 |
| Reaktio ilman kanssa | voimakas, ⇒ CO2 |
| Reaktio 15 M HNO3 | lievä, w/ht ⇒ C6(CO2H)6 (melliitti/grafiittihappo) |
| Reaktio 6 M HCl:n kanssa | ei mitään |
| Reaktio 6 M NaOH:n kanssa | ei ole |
| Oksidi(t) | CO , CO2 |
| Hydridi(t) | CH4 ja monet CxHy |
| Kloridi(t) | CCl4 |
| Atomisäde | 70 pm |
| Ionisäde (1+-ioni) | – |
| Ionisäde (2+-ioni) | – |
| Ionisäde (3+-ioni) | – |
| Ionisäde (1- ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtokyky | 25-470 W m-1 K-1 (graphite), 470 W m-1 K-1 (timantti) |
| Sähkönjohtavuus | 0.07 x 106 S m-1 |
| Pakkas-/ sulamispiste: | 3550 oC, 3823 K |

Hiilinanoputkien rakenteen mallit.

Lavoisier käyttää jättilinssiä palamiskokeissa
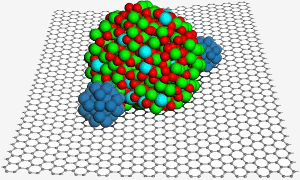
Grafeenin pinnalla on indiumtinaoksidi-nanohiukkanen, joka auttaa kiinnittämään kaksi platina-nanohiukkasta (sininen) parempaan katalyysiin polttokennossa. Kuva: PNL.
Hiilen löytäminen
Hiili on tunnettu jo muinaisista ajoista lähtien noen, puuhiilen, grafiitin ja timanttien muodossa. Muinaiset kulttuurit eivät tietenkään ymmärtäneet, että nämä aineet olivat saman alkuaineen eri muotoja
Ranskalainen tiedemies Antoine Lavoisier antoi hiilestä nimen ja teki erilaisia kokeita sen luonteen selvittämiseksi.
Vuonna 1772 hän yhdisti voimavarojaan muiden kemistien kanssa ostaakseen timantin, jonka he panivat suljettuun lasipurkkiin. He kohdistivat auringon säteet timanttiin huomattavan jättimäisen suurennuslasin avulla ja näkivät timantin palavan ja katoavan.
Lavoisier totesi, että purkin kokonaispaino pysyi muuttumattomana ja että palamisen yhteydessä timantti oli yhdistynyt hapen kanssa hiilidioksidiksi. (1), (2) Hän päätteli, että timantti ja hiili koostuivat samasta alkuaineesta – hiilestä.
Vuonna 1779 ruotsalainen tiedemies Carl Scheele osoitti, että grafiitti paloi muodostaen hiilidioksidia, joten sen täytyi olla hiilen toinen muoto.(3)
Vuonna 1796 englantilainen kemisti Smithson Tennant osoitti, että timantti oli puhdasta hiiltä eikä hiilen yhdiste; se paloi muodostaen vain hiilidioksidia.(3)
Tennant osoitti myös, että kun poltettiin samanpainoisia hiili- ja timanttimassoja, niistä muodostui hiilidioksidia yhtä paljon. (4)
Vuonna 1855 englantilainen kemisti Benjamin Brodie valmisti hiilestä puhdasta grafiittia, mikä osoitti, että grafiitti oli hiilen eräs muoto.(4)
Vaikka sitä oli aiemmin yritetty tuloksetta, vuonna 1955 amerikkalainen tiedemies Francis Bundy ja työtoverit General Electricillä osoittivat vihdoin, että grafiitti voitiin muuttaa timantiksi korkeassa lämpötilassa ja korkeassa paineessa.(5)
Vuonna 1985 Robert Curl, Harry Kroto ja Richard Smalley löysivät fullereenit, hiilen uuden muodon, jossa atomit ovat järjestäytyneet jalkapallon muotoon. Tunnetuin fullereeni on buckminsterfullereeni, joka tunnetaan myös nimellä C60 ja joka koostuu 60 hiiliatomista. Fullereenejä on suuri joukko, joka alkaa C20:stä ja ulottuu C540:een. (6), (7)
Hiljattain löydetty hiilen allotrooppi on grafeeni, joka koostuu yhdestä kerroksesta kuusikulmioiksi järjestettyjä hiiliatomeja. Jos nämä kerrokset pinottaisiin päällekkäin, tuloksena olisi grafiitti. Grafeenin paksuus on vain yksi atomi.
Grafeenin löytämisestä ilmoittivat vuonna 2004 Kostya Novoselov ja Andre Geim, jotka irrottivat teipin avulla yhden atomikerroksen grafiitista ja saivat näin aikaan uuden allotroopin.
Interenkiintoisia faktoja hiilestä
- Noin 20 % elävien organismien painosta on hiiltä.
- Yhdisteistä, jotka sisältävät hiiltä, tiedetään enemmän yhdisteitä, kuin mitä ei sisällä.
- Hiili on maailmankaikkeuden neljänneksi runsain alkuaine.
- Hiilen suuresta runsaudesta huolimatta olemme hiilen olemassaolon velkaa epätodennäköisille olosuhteille
- Timantti on erinomainen hioma-aine, koska se on kovinta tavallista materiaalia, ja sillä on myös suurin lämmönjohtavuus. Se voi hioa mitä tahansa ainetta, kun taas kitkan synnyttämä lämpö johdetaan nopeasti pois.
- Kehossasi olevat hiiliatomit olivat aikoinaan kaikki osa ilmakehän hiilidioksidifraktiota.
- Grafiitti on ohuin ja vahvin koskaan tunnettu materiaali.
- Grafiitti koostuu kaksiulotteisista atomikiteistä, ja tällaisia rakenteita on nähty ensimmäistä kertaa.
- Tyypillisen mekaanisen lyijykynän grafiitin halkaisija on 0,7 mm. Tämä vastaa 2 miljoonaa grafeenikerrosta.
- Autonrenkaat ovat mustat, koska niissä on noin 30 % hiilimustaa, jota lisätään kumiin sen vahvistamiseksi. Hiilimusta auttaa myös suojaamaan renkaita UV-vaurioilta.(8)
- Hiiltä syntyy tähtien sisällä, kun ne polttavat heliumia ydinfuusioreaktioissa. Hiili on osa heliumin palamisesta syntyvää ”tuhkaa”.
- Hiili käy läpi ydinfuusioreaktioita raskaissa tähdissä muodostaen neonia, magnesiumia ja happea.




Vasemmalla: Kivihiilen (lähinnä amorfisen hiilen) palaminen ilmassa. Oikealla: Timantit (kiteinen hiili). Ajattelimme ottaa kuvan palavista timanteista – ne palavat noin 800oC:ssa – mutta meillä ei ollut varaa siihen!

Hiilipohjaiset elämänmuodot, kuten nämä, hallitsevat planeettaamme.

DNA. Kuuluisan kaksoiskierteisen molekyylin mahdollistaa hiilen kyky muodostaa pitkiä molekyyliketjuja.
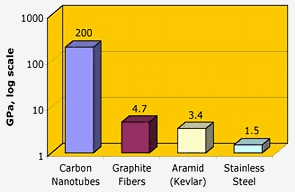
Nasa: Hiilinanoputkilla on erinomainen vetolujuus – kaksi kertaluokkaa suurempi kuin grafiittikuiduilla, kevlarilla tai teräksellä.
Hiilen jaksollisen järjestelmän naapuruus
| ryhmä 13 |
ryhmä 14 |
Ryhmä 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
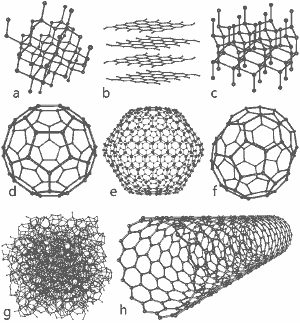
Hieno kuva, jonka on julkaissut Michael Ströck GNU Free Documentation License -lisenssillä: Kahdeksan hiilen allotropin rakenteet: a) Timantti b) Grafiitti c) Lonsdaleiitti d) C60 (Buckminsterfullereeni) e) C540-fullereeni f) C70-fullereeni g) Amorfinen hiili h) Yksiseinäinen hiilinanoputki. Klikkaa tästä saadaksesi suuremman kuvan.
Eritys ja ominaisuudet
Haitalliset vaikutukset:
Puhtaalla hiilellä on hyvin vähäinen myrkyllisyys. Suurten hiilimustapölymäärien (noki/hiilipöly) hengittäminen voi aiheuttaa ärsytystä ja keuhkovaurioita.
Ominaisuudet:
Hiilellä voi olla useita erilaisia kolmiulotteisia rakenteita, joissa sen atomit ovat järjestäytyneet eri tavalla (allotroopit).
Kolme yleistä kiteistä allotrooppia ovat grafiitti, timantti ja (yleensä) fullereenit. Grafeenilla on 2D-kiderakenne.(Fullereenit voivat joskus olla amorfisessa muodossa.)(9)
Hiili voi olla myös amorfisessa tilassa. Monilla yleisesti amorfisiksi kuvatuilla allotroopeilla, kuten lasimainen hiili, noki tai hiilimusta, on kuitenkin yleensä riittävästi rakennetta, jotta ne eivät ole todella amorfisia. Vaikka kiteisiä nanoputkia on havaittu, ne ovat yleensä amorfisia. 10.
Kahdeksan allotropin rakenteet on esitetty tämän sivun alalaidassa. 10.
Mielenkiintoista on, että grafiitti on yksi pehmeimmistä aineista, ja timanttia pidettiin viime aikoihin asti kovimpana luonnossa esiintyvänä aineena.
Erittäin harvinaisen hiilen allotroopin, lonsdaleiitin, on laskettu olevan puhtaassa muodossa 58 % vahvempi kuin timantti. Lonsdaleiitti on timantin kaltainen hiiliverkko, jolla on grafiitin kuusikulmainen rakenne. Sitä syntyy, kun grafiittia sisältävät meteoriitit osuvat toiseen kappaleeseen, kuten Maahan. Törmäyksen aiheuttamat korkeat lämpötilat ja paineet muuttavat grafiitin lonsdaleiitiksi.
Hiilellä on kaikista alkuaineista korkein sulamis-/sublimoitumispiste, ja timantin muodossa sillä on kaikista alkuaineista korkein lämmönjohtavuus.
Timantin korkeasta lämmönjohtavuudesta juontaa juurensa slangisanasto ”jää”. Tyypillisissä huonelämpötiloissa kehosi lämpötila on korkeampi kuin huoneen lämpötila – mukaan lukien kaikki suuret timantit, joita sinulla sattuu olemaan lojumassa. Jos kosketat mitä tahansa näistä timanteista, niiden korkea lämmönjohtavuus siirtää lämmön pois iholtasi nopeammin kuin mikään muu materiaali. Aivosi tulkitsevat tämän nopean lämpöenergian siirtymisen pois iholta niin, että kosketat jotain hyvin kylmää – joten huoneenlämpöiset timantit voivat tuntua jäältä.
Hiilen käyttötarkoitukset
Hiiltä (kivihiilen muodossa, joka on pääasiassa hiiltä) käytetään polttoaineena.
Grafiittia käytetään kynänkärjissä, korkealämpöisissä upokkaissa, kuivakennoissa, elektrodeissa ja voiteluaineena.
Timantteja käytetään koruissa ja – koska ne ovat niin kovia – teollisuudessa leikkaamiseen, poraamiseen, hiontaan ja kiillottamiseen.
Hiilimustaa käytetään painovärin mustana pigmenttinä.
Hiili voi muodostaa raudan kanssa seoksia, joista yleisin on hiiliteräs.
Radioaktiivista 14C-isotooppia käytetään arkeologisessa ajoituksessa.
Hiiliyhdisteet ovat tärkeitä monilla kemianteollisuuden aloilla – hiili muodostaa valtavan määrän yhdisteitä vedyn, hapen, typen ja muiden alkuaineiden kanssa.
Runsaus ja isotoopit
Runsaus maankuori: 200 miljoonasosaa painosta, 344 miljoonasosaa mooleista
Runsaus aurinkokunta: 3000 miljoonasosaa painosta, 300 miljoonasosaa mooleista
Kustannus, puhdas: 2,4 $/100g
Kustannus, irtotavarana: $/100g
Lähde: Hiiltä saadaan polttamalla orgaanisia yhdisteitä, joissa ei ole riittävästi happea. Hiilen neljä tärkeintä allotrooppia ovat grafiitti, timantti, amorfinen hiili ja fullereenit.
Luonnontimantteja löytyy muinaisista tulivuorista peräisin olevasta kimberliitistä.
Grafiittia löytyy myös luonnollisista esiintymistä.
Fullereenit löydettiin molekyylisuihkukokeiden sivutuotteina 1980-luvulla.
Amorfinen hiili on puuhiilen, nokihiilen (noen eli hiili-mustan) ja aktivoidun hiilen pääainesosa.
Isotooppeja: 13, joiden puoliintumisajat tunnetaan, massanumerot 8-20. Luonnossa esiintyvä hiili on kahden isotoopin seos, ja niitä esiintyy esitetyissä prosenttiosuuksissa: 12C (99 %) ja 13C (1 %).
Isotooppia 14C, jonka puoliintumisaika on 5730 vuotta, käytetään laajalti hiilipitoisten materiaalien, kuten puun, arkeologisten näytteiden jne. ajoittamiseen noin 40 000 vuoden ikään asti.

- Robert E. Krebs, Maapallomme kemiallisten alkuaineiden historiaa ja käyttöä: viitteellinen käsikirja., (2006) s192. Greenwood Publishing Group
- Mary Elvira Weeks, Alkuaineiden löytäminen. I. Antiikin maailmassa tunnetut alkuaineet, J. Chem. Educ., 1932, 9 (1), s4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) s507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) s3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) s145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) s423. Wiley.
- Nobelin kemianpalkinto, 1996
- Mitä tarvitaan renkaan valmistamiseen?
- Ming Gao ja Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite this Page
Verkkolinkitystä varten kopioi ja liitä jompikumpi seuraavista:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
tai
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Jos haluat siteerata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA:n mukaista viittaustapaa:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.
.