L’elemento chimico carbonio è classificato come un non metallo. È conosciuto fin dall’antichità. Il suo scopritore e la data di scoperta sono sconosciuti.

Data Zone
| Classificazione: | Il carbonio è un non metallo |
| Colore: | nero (grafite), trasparente (diamante) |
| Peso atomico: | 12.011 |
| Stato: | solido |
| Punto di fusione: | 3550 oC, 3823 K |
| Nota: A pressione atmosferica normale, il carbonio non fonde quando viene riscaldato, sublima. Cioè subisce un cambiamento di fase direttamente da solido a gas. Se la pressione viene aumentata a 10 atmosfere il carbonio (grafite) si osserva fondere a 3550 °C. | |
| Punto di ebollizione: | 3825 oC, 4098 K |
| Il punto di ebollizione citato viene registrato quando la pressione del vapore della grafite sopra la grafite sublima raggiunge 1 atmosfera. | |
| Elettroni: | 6 |
| Protoni: | 6 |
| Neutroni nell’isotopo più abbondante: | 6 |
| Gusci di elettroni: | 2,4 |
| Configurazione degli elettroni: | 1s2 2s2 2p2 |
| Densità @ 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Mostra altro, incluso: Calori, Energie, Ossidazione, Reazioni,
Composti, Raggi, Conducibilità
| Volume atomico: | 5.31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Struttura: | strati esagonali (grafite), tetraedrici (diamante) |
| Durezza: | 0,5 mohs (grafite), 10,0 mohs (diamante) |
| Capacità termica specifica | 0,71 J g-1 K-1 (grafite), 0.5091 J g-1 K-1 (diamante) |
| Calore di fusione | 117 kJ mol-1 (grafite) |
| Caldo di atomizzazione | 717 kJ mol-1 |
| Caldo di vaporizzazione | 710.9 kJ mol-1 |
| energia di prima ionizzazione | 1086.5 kJ mol-1 |
| 2a energia di ionizzazione | 2352,6 kJ mol-1 |
| 3a energia di ionizzazione | 4620,5 kJ mol-1 |
| Affinità degli elettroni | 121.55 kJ mol-1 |
| Numero minimo di ossidazione | -4 |
| Numero minimo di ossidazione comune. | -4 |
| Numero massimo di ossidazione | 4 |
| Numero massimo di ossidazione comune | 4 |
| Elettronegatività (Scala Pauling) | 2.55 |
| Volume di polarizzabilità | 1.8 Å3 |
| Reazione con aria | vigorosa, ⇒ CO2 |
| Reazione con 15 M HNO3 | lieve, w/ht ⇒ C6(CO2H)6 (acido mellitico/grafitico) |
| Reazione con 6 M HCl | nessuno |
| Reazione con 6 M NaOH | nessuno |
| Ossido(i) | CO , CO2 |
| Idruro(i) | CH4 e molti CxHy |
| Cloruro(i) | CCl4 |
| Raggio atomico | 70 pm |
| – | |
| Raggio ionico (ione 2+) | – |
| Raggio ionico (ione 3+) | – |
| Raggio ionico (1- ione) | – |
| Raggio ionico (2-ione) | – |
| Raggio ionico (3-ione) | – |
| Conducibilità termica | 25-470 W m-1 K-1 (grafite), 470 W m-1 K-1 (diamante) |
| Conducibilità elettrica | 0.07 x 106 S m-1 |
| Punto di congelamento/fusione: | 3550 oC, 3823 K |

Modelli di struttura dei nanotubi di carbonio.

Lavoisier usa una lente gigante negli esperimenti di combustione
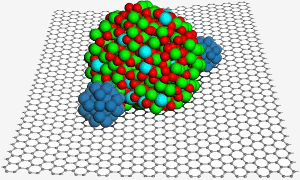
Una superficie di grafene ospita una nanoparticella di ossido di indio e stagno, che aiuta a fissare due nanoparticelle di platino (blu) per una migliore catalisi in una cella a combustibile. Immagine: PNL.
Scoperta del carbonio
Il carbonio è conosciuto fin dall’antichità sotto forma di fuliggine, carbone, grafite e diamanti. Le culture antiche non si rendevano conto, naturalmente, che queste sostanze erano forme diverse dello stesso elemento
Lo scienziato francese Antoine Lavoisier diede un nome al carbonio e condusse una serie di esperimenti per rivelarne la natura.
Nel 1772 mise insieme le risorse con altri chimici per comprare un diamante, che misero in un barattolo di vetro chiuso. Concentrarono i raggi del sole sul diamante con una notevole lente d’ingrandimento gigante e videro il diamante bruciare e scomparire.
Lavoisier notò che il peso complessivo del barattolo era invariato e che quando bruciava, il diamante si era combinato con l’ossigeno per formare anidride carbonica. (1), (2) Ha concluso che il diamante e il carbone erano fatti dello stesso elemento: il carbonio.
Nel 1779, lo scienziato svedese Carl Scheele dimostrò che la grafite bruciava per formare anidride carbonica e quindi doveva essere un’altra forma di carbonio.(3)
Nel 1796, il chimico inglese Smithson Tennant stabilì che il diamante era carbonio puro e non un composto del carbonio; bruciava per formare solo anidride carbonica.
Tennant dimostrò anche che quando pesi uguali di carbone e diamanti venivano bruciati, producevano la stessa quantità di anidride carbonica. (4)
Nel 1855, il chimico inglese Benjamin Brodie produsse grafite pura dal carbonio, dimostrando che la grafite era una forma di carbonio.(4)
Anche se era stato precedentemente tentato senza successo, nel 1955 lo scienziato americano Francis Bundy e i colleghi della General Electric dimostrarono finalmente che la grafite poteva essere trasformata in diamante ad alta temperatura e alta pressione.(5)
Nel 1985, Robert Curl, Harry Kroto e Richard Smalley scoprirono i fullereni, una nuova forma di carbonio in cui gli atomi sono disposti a forma di pallone. Il fullerene più conosciuto è il buckminsterfullerene, noto anche come C60, composto da 60 atomi di carbonio. Esiste una grande famiglia di fullereni, che parte da C20 e arriva fino a C540. (6), (7)
L’allotropo del carbonio scoperto più recentemente è il grafene, che consiste in un singolo strato di atomi di carbonio disposti in esagoni. Se questi strati fossero impilati uno sull’altro, il risultato sarebbe la grafite. Il grafene ha uno spessore di un solo atomo.
La scoperta del grafene è stata annunciata nel 2004 da Kostya Novoselov e Andre Geim, che hanno usato del nastro adesivo per staccare un singolo strato di atomi dalla grafite e produrre il nuovo allotropo.
Fatti interessanti sul carbonio
- Circa il 20% del peso degli organismi viventi è carbonio.
- Sono noti più composti contenenti carbonio che non.
- Il carbonio è il quarto elemento più abbondante nell’universo.
- Nonostante la sua grande abbondanza, dobbiamo l’esistenza del carbonio a un insieme improbabile di circostanze
- Il diamante è un eccellente abrasivo perché è il materiale comune più duro e ha anche la più alta conducibilità termica. Può smerigliare qualsiasi sostanza, mentre il calore generato dall’attrito viene rapidamente condotto via.
- Gli atomi di carbonio nel tuo corpo una volta erano tutti parte della frazione di anidride carbonica dell’atmosfera.
- Il grafene è il materiale più sottile e resistente mai conosciuto.
- Il grafene è fatto di cristalli atomici bidimensionali, la prima volta che sono state viste strutture del genere.
- La grafite in una tipica matita meccanica ha un diametro di 0,7 mm. Questo equivale a 2 milioni di strati di grafene.
- I pneumatici delle auto sono neri perché contengono circa il 30% di nerofumo, che viene aggiunto alla gomma per rafforzarla. Il nero di carbonio aiuta anche a proteggere i pneumatici dai danni dei raggi UV.(8)
- Il carbonio si forma nelle stelle quando bruciano l’elio nelle reazioni di fusione nucleare. Il carbonio fa parte della “cenere” formata dalla combustione dell’elio.
- Il carbonio subisce reazioni di fusione nucleare nelle stelle pesanti per produrre neon, magnesio e ossigeno.




Sinistra: Combustione di carbone (principalmente carbonio amorfo) in aria. A destra: Diamanti (carbonio cristallino). Abbiamo pensato di fare una foto di diamanti in combustione – bruciano a circa 800oC – ma non potevamo permettercelo!

Le forme di vita basate sul carbonio, come queste, dominano il nostro pianeta.

DNA. La famosa molecola a doppia elica è resa possibile dalla capacità del carbonio di formare lunghe catene molecolari.
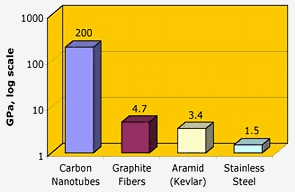
Nasa: I nanotubi di carbonio hanno un’eccezionale resistenza alla trazione – due ordini di grandezza superiori alle fibre di grafite, kevlar o acciaio.
Dintorni della tavola periodica del carbonio
| Gruppo 13 |
Gruppo 14 |
Gruppo 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
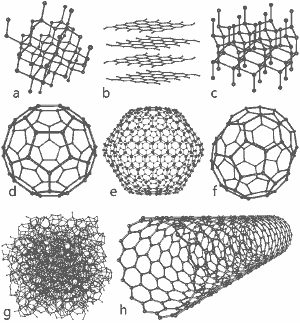
Una splendida immagine rilasciata da Michael Ströck sotto la GNU Free Documentation License: Le strutture di otto allotropi del carbonio: a) Diamante b) Grafite c) Lonsdaleite d) C60 (Buckminsterfullerene) e) C540 Fullerene f) C70 Fullerene g) Carbonio amorfo h) Nanotubi di carbonio a parete singola. Clicca qui per ingrandire l’immagine.
Aspetto e caratteristiche
Effetti nocivi:
Il carbonio puro ha una tossicità molto bassa. L’inalazione di grandi quantità di polvere nera di carbonio (fuliggine/polvere di carbone) può causare irritazione e danni ai polmoni.
Caratteristiche:
Il carbonio può esistere con diverse strutture tridimensionali in cui i suoi atomi sono disposti diversamente (allotropi).
Tre allotropi cristallini comuni sono la grafite, il diamante e (solitamente) i fullereni. Il grafene ha una struttura cristallina 2D (i fullereni possono talvolta esistere in forma amorfa) (9)
Il carbonio può esistere anche allo stato amorfo. Molti allotropi comunemente descritti come amorfi, tuttavia, come il carbonio vetroso, la fuliggine o il nero di carbonio hanno di solito abbastanza struttura da non essere veramente amorfi. Sebbene siano stati osservati nanotubi cristallini, essi sono generalmente amorfi.(10)
Le strutture di otto allotropi sono mostrate in fondo a questa pagina.
È interessante notare che la grafite è una delle sostanze più morbide e il diamante era ritenuto, fino a poco tempo fa, la sostanza naturale più dura.
Un allotropo estremamente raro del carbonio, la lonsdaleite, è stato calcolato, in forma pura, per essere il 58% più forte del diamante. La lonsdaleite è una rete di carbonio simile al diamante che ha la struttura esagonale della grafite. Si forma quando meteoriti contenenti grafite colpiscono un altro corpo, come la Terra. Le alte temperature e pressioni dell’impatto trasformano la grafite in lonsdaleite.
Il carbonio ha il più alto punto di fusione/sublimazione di tutti gli elementi e, sotto forma di diamante, ha la più alta conduttività termica di qualsiasi elemento.
L’alta conduttività termica del diamante è l’origine del termine gergale “ghiaccio”. A temperature tipiche di una stanza, la temperatura del vostro corpo è più alta di quella della stanza – compresi i grandi diamanti che vi può capitare di avere in giro. Se tocchi uno di questi diamanti, la loro alta conduttività termica porta via il calore dalla tua pelle più velocemente di qualsiasi altro materiale. Il vostro cervello interpreta questo rapido trasferimento di energia termica dalla vostra pelle come se steste toccando qualcosa di molto freddo – così i diamanti a temperatura ambiente possono sembrare ghiaccio.
Usi del carbonio
Il carbonio (sotto forma di carbone, che è principalmente carbonio) è usato come combustibile.
La grafite è usata per punte di matite, crogioli ad alta temperatura, celle a secco, elettrodi e come lubrificante.
I diamanti sono usati in gioielleria e – a causa della loro durezza – nell’industria per tagliare, forare, rettificare e lucidare.
Il nero di carbonio è usato come pigmento nero nell’inchiostro da stampa.
Il carbonio può formare leghe con il ferro, di cui la più comune è l’acciaio al carbonio.
L’isotopo radioattivo 14C è usato nella datazione archeologica.
I composti del carbonio sono importanti in molte aree dell’industria chimica – il carbonio forma un vasto numero di composti con idrogeno, ossigeno, azoto e altri elementi.
Abbondanza e Isotopi
Abbondanza crosta terrestre: 200 parti per milione in peso, 344 parti per milione in mole
Abbondanza sistema solare: 3000 parti per milione in peso, 300 parti per milione di moli
Costo, puro: $2,4 per 100g
Costo, sfuso: $ per 100g
Fonte: Il carbonio può essere ottenuto bruciando composti organici con insufficiente ossigeno. I quattro principali allotropi del carbonio sono grafite, diamante, carbonio amorfo e fullereni.
I diamanti naturali si trovano nella kimberlite di antichi vulcani.
Anche la grafite può essere trovata in depositi naturali.
I fullereni sono stati scoperti come sottoprodotti di esperimenti con il raggio molecolare negli anni 80.
Il carbonio amorfo è il principale costituente del carbone, della fuliggine (nerofumo), e del carbone attivo.
Isotopi: 13 la cui emivita è nota, con numeri di massa da 8 a 20. Il carbonio presente in natura è una miscela di due isotopi e si trovano nelle percentuali indicate: 12C (99%) e 13C (1%).
L’isotopo 14C, con un tempo di dimezzamento di 5730 anni, è ampiamente usato per datare materiali carbonacei come legno, campioni archeologici, ecc. per età fino a circa 40 000 anni.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide., (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, La scoperta degli elementi. I. Elementi noti al mondo antico, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, La formula del diamante: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Premio Nobel per la chimica, 1996
- Di cosa abbiamo bisogno per fare un pneumatico?
- Ming Gao e Hui Zhang, Preparazione di un film amorfo di fullerene, Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cita questa pagina
Per il collegamento online, per favore copia e incolla uno dei seguenti:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
o
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Per citare questa pagina in un documento accademico, usa la seguente citazione conforme a MLA:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.