Tiede >Kemia > Kolmannen rivin alkuaineet >Metallisidoksen käsite ja metalliset kiinteät aineet
Tässä artikkelissa tarkastelemme metallisidoksen käsitettä ja metallisidoksia natrium-, magnesium- ja alumiinikiteissä.
Metallisidoksen käsite:
Metallisidos määritellään vetovoimaksi, joka sitoo metallikationit useisiin liikkuviin tai delokalisoituneisiin elektroneihin sen vaikutuspiirissä, mikä pitää metallikationit yhdessä määrätyssä kuviossa. Metallisidoksen luonteen selittämiseksi on esitetty monia teorioita. Vapaiden elektronien teoria tai elektronimeriteoria on yksi yksinkertaisimmista Druden ja Lorentzin ehdottamista teorioista. Joitakin tämän teorian tärkeitä postulaatteja ovat seuraavat:
Vapaan elektronin teoria metallisesta sidoksesta:
Metalliatomeilla on vähemmän valenssielektroneita, joten niillä on paljon vapaita valenssiorbitaaleja. Na:lla, Mg:llä ja Al:lla on 3p-orbitaalia vapaana.
| Nimi | Symboli | Atomin nro. | Elektroninen konfiguraatio | Tarkka konfiguraatio |
| Natrium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesium | Mg | 12 | 2 , 8, 1 | 1s2, 2s2 2p6, 3s2 |
| Alumiini | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Metallien ionisaatiopotentiaaliarvot ovat alhaiset, joten valenssielektronit ovat löyhästi kiinni ja ne voidaan helposti poistaa. Metallisen kiteen tiiviisti pakattu rakenne koostuu metallin atomeista, jotka ovat kaikilta osin identtisiä.
Metallin tiiviisti pakattujen atomien miehittämättömät orbitaalit limittyvät kristalliristikon kautta viereisten atomien samanlaisten orbitaalien kanssa. Valenssielektronit irtoavat orbitaaleistaan ja voivat liikkua vapaasti atomin tyhjiltä valenssiorbitaaleilta toisille. Koska nämä valenssielektronit eivät kuulu mihinkään yksittäiseen atomiin vaan koko kiteeseen, niitä kutsutaan delokalisoiduiksi tai liikkuviksi elektroneiksi. Delokalisaation seurauksena syntyviä metalli-ioneja (kationeja) kutsutaan ytimiksi. Metalli-ioneilla on kiinteät paikat kideruudussa, kun taas delokalisoituneet elektronit voivat vapaasti liikkua kideruudussa. Näin ollen metallia voidaan pitää metallikationien aggregaationa, joka on upotettu liikkuvien elektronien mereen.
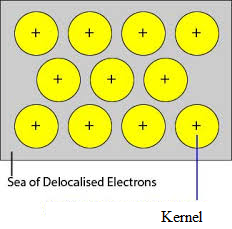
Koska metalleissa olevat elektronit ovat delokalisoituneita, ja niiden oletetaan jakautuvan tasaisesti koko kideruudukkoon. Metalli-ionien ja delokalisoituneiden elektronien väliset vetovoimat ovat tasaisia kaikissa suunnissa. Näin ollen metallisidos on suuntaamaton.
Natriumin, magnesiumin ja alumiinin ristikkopisteitä miehittävät yksiköt ovat vastaavasti niiden positiivisia ioneja, joita ympäröivät liikkuvat elektronit. Näin ollen natrium, magnesium ja alumiini ovat metallisia kiinteitä aineita.
Vasemmalta oikealle eli natriumista alumiiniin siirryttäessä valenssielektronien määrä kasvaa ja siten sidoksen lujuus kasvaa natriumista alumiiniin.
Ominaisuudet, kuten sähkön- ja lämmönjohtavuus, metallin kiilto, muovautuvuus ja sitkeys, voidaan selittää vapaiden elektronien teorian perusteella.
Metallisidosten ominaispiirteet:
- Metallisidos määritellään vetovoimaksi, joka sitoo metallikationit useisiin liikkuviin tai delokalisoituneisiin elektroneihin vaikutuspiirissään, mikä pitää metallikationit yhdessä määrätyssä kuviossa.
- Metallisidos on suuntaamaton.
- Sidokset ovat heikompia kuin kovalenttinen sidos, mutta vahvempia kuin van der Waalin voimat.
- Sidokset eivät ole jäykkiä.
- Metallisidoksen voimakkuus on suoraan yhteydessä metalli-ionin positiiviseen varaukseen. Niinpä metallisidoksen lujuus kasvaa, kun Na < Mg < Al.
Metalliset kiinteät aineet:
Metalliset kiinteät aineet ovat kiteisiä kiinteitä aineita, joissa ristikkopisteitä miehittävät yksiköt ovat positiivisia ioneja, joita ympäröi joukko elektroneja. (Metallisidoksen käsite)
Metallien kiderakenteet:
Erilaisten metallikiteiden röntgenanalyysit ovat osoittaneet, että metallit omaksuvat jommankumman seuraavista kiderakenteista.
- Kappalekeskeinen kuutiorakenne. (BCC)
- Pintakeskitetty kuutiorakenne. (FCC)
- Heksagonaalinen tiiviisti pakattu rakenne. (HCP)
Natrium (Na):
Natriummetallilla on vartalokeskeinen kuutiomainen (BCC) avoin pakattu kiderakenne. Sitoutuminen on suuntautumatonta metallisidosta.
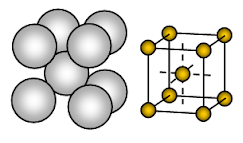
Ionien sijoittuminen yhteen tasoon- Kuutiomuotoinen joukko – avoin tai neliöpakattu rakenne. Tässä järjestelyssä kukin metalli-ioni koskettaa neljää viereistä ionia yhdessä tasossa. Kerrosten järjestys on AB, AB, AB, AB, ……….
Natrium on metallinen kiinteä aine. Natriumin yksikkösolussa kutakin natriumionia ympäröi kahdeksan muuta yhtä kaukana olevaa natriumionia. Koordinaatioluku on siis 8. Nämä natriumionit on sijoitettu kuvitteellisen kuution kulmiin ja kuution keskellä on yksi natriumioni. Yhdessä natriumin yksikkösolussa on 2 ionia.
Natriumionit vievät vain noin 68 % yksikkösolun käytettävissä olevasta tilasta. Yksikkösolusta jää siis 32 % tyhjäksi (void). Koska tässä rakenteessa on enemmän tyhjää tilaa, metallit, jotka omaksuvat tämän rakenteen, ovat pehmeitä. Natrium on siis pehmeä metalli, koska sen kiderakenteessa on enemmän tyhjää tilaa (noin 32 % ) ja melko heikko metallisidos, koska sen kiteessä on vain yksi valenssielektroni Na-atomia kohti.
Magnesium (Mg):
Magnesiumilla on heksagonaalinen tiiviisti pakattu kiderakenne. Sitoutuminen on suuntautumatonta metallisidosta.
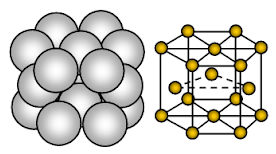
Magnesium on metallinen kiinteä aine. Ristikkopaikkoja miehittävät yksiköt ovat Mg-ioneja ja näitä ioneja ympäröivät liikkuvat tai delokalisoituneet elektronit.
Ionien sijoittelu yhdessä tasossa ionien sijoittelu on kuusikulmainen joukko tai suljettu pakattu kerros. Kukin metalli-ioni koskettaa siis kuutta viereistä ionia yhdessä tasossa. Jokainen magnesiumioni koskettaa kuutta magnesiumionia omassa kerroksessaan, kolmea yläpuolisessa kerroksessa ja kolmea alapuolisessa kerroksessa. Kuusikulmaisessa pakkautuneessa rakenteessa ionien suljetut pakkautuneet kerrokset on pinottu vuorottelevaan järjestykseen, jota kutsutaan yleensä nimellä AB ABA …… Jokainen kolmas ionikerros on täsmälleen samanlainen kuin ensimmäinen kerros ja sijaitsee suoraan sen yläpuolella.
Jokaista Mg-atomia ympäröi 12 muuta yhtä kaukana olevaa Mg-ionia. Koordinaatioluku on siis 12. Yksikkösolussa noin 26 % käytettävissä olevasta tilasta on tyhjää (void). Tämä rakenne on tiiviimmin pakkautunut. Koska kiderakenteessa on vähemmän tyhjää tilaa, Mg+2:n aiheuttama elektronipilvi on suurempi ja metallisidos on vahva, magnesium on kovempaa kuin natriummetalli. Se on muokattavampi ja sitkeämpi kuin natrium.
Alumiini (Al):
Alumiinilla on kasvokeskitetty kuutiomainen (FCC) kiderakenne. Sidos on suuntaamaton metallinen sidos.

Alumiini on metallinen kiinteä aine. Ristikkopaikkoja miehittävät yksiköt ovat Al-ioneja ja näitä ioneja ympäröivät liikkuvat tai delokalisoituneet elektronit.
Ionien sijoittelu yhdessä tasossa ionien sijoittelu on heksagonaalinen joukko tai suljettu pakattu kerros. Näin ollen kukin metalli-ioni koskettaa kuutta viereistä ionia yhdessä tasossa.
Kuutiollisessa tiiviisti pakatussa tai kasvokeskisessä kuutiokiderakenteessa tiiviisti pakattujen ionikerrosten järjestys toistuu joka neljännessä kerroksessa. Toisin sanoen joka neljäs ionikerros on täsmälleen sama kuin ensimmäinen kerros ja sijaitsee suoraan sen yläpuolella. Sitä kutsutaan siis ABC, ABC, ABC, ABC, ….. cubic close packing. Kuutionmuotoista tiivispakkausta kutsutaan myös nimellä face centred close-packed structure, koska tietystä kulmasta katsottuna ionien voidaan katsoa olevan kuution kahdeksassa kulmassa ja kuution eli yksikkösolun jokaisen kuuden sivun keskellä.
Jokaista alumiiniionia (Al+3) ympäröi 12 muuta yhtä kaukana olevaa alumiiniatomia. Koordinaatioluku on siis 12. Alumiinin yksikkösolussa noin 26 % käytettävissä olevasta tilasta on tyhjää (void). Kiderakenteen pienemmän tyhjän tilan ja vahvan metallisidoksen ansiosta alumiini on kovempaa, muokattavampaa ja sitkeämpää kuin natrium ja magnesium.
Piikit (Si):
Kovalenttiset kiinteät aineet ovat kiteisiä kiinteitä aineita, joissa yksikköristikon pisteitä ovat atomit. Tärkein sidosvoima on atomien väliset kovalenttiset sidokset. Pii on kovalenttinen kiinteä aine, jossa ristikkopisteet ovat alkuaineen atomien miehittämiä. Pii on verkkojähmeä kiinteä aine. Si-Si-kovalenttisten sidosten verkosto on olemassa.
Piin järjestysluku on 14. Piin elektroninen konfiguraatio perustilassaan on 1s2, 2s22p6, 3s2 3p2. Sillä on neljä valenssielektronia valenssiorbitaaleillaan. Pii hybridisoituu sp3-hybridisaatiossa muodostaen neljä sp3-hybridisoitunutta orbitaalia, joilla on sama energia. Kukin piiatomi muodostaa neljä kovalenttista sidosta neljän muun viereisen piiatomin kanssa johtuen SP3- SP3 Näin muodostuu tetraedrinen Si4-yksikkö, joka laajenee muodostaen kolmiulotteisen jättimäisen molekyylin.

Si -Si-sidokset kulkevat yhtäjaksoisesti läpi kiteen. Näin piikidettä pidetään jättimäisenä kolmiulotteisena molekyylinä, jossa on tetraedrinen verkosto piiatomeja, jotka ovat sitoutuneet toisiinsa vahvoilla kovalenttisilla sidoksilla. Tällaista rakennetta sisältävää kiinteää ainetta kutsutaan verkkojähteeksi. Si-Si-sidoksen kulma on 109 o 28 ’, kun taas sidoksen pituus on 2,35 o
Hybridiorbitaalien päällekkäisyyden vuoksi Si-Si-kovalenttiset sidokset ovat hyvin vahvoja ja suuntautuneita. Vahvojen kovalenttisten sidosten verkoston läsnäolo selittää piin kovuuden ja korkean sulamispisteen.
Kovalenttisen sidoksen elektronit ovat paikallisia, joten pii ei ole hyvä sähkön- ja lämmönjohdin. Se on kuitenkin puolijohde. Koska vapaita elektroneja ei ole saatavilla, pii on eriste absoluuttisessa nollalämpötilassa. Pii on kuitenkin puolijohde. Jos lämpötilaa nostetaan, kovalenttiset sidokset katkeavat ja elektronit vapautuvat, jolloin ne voivat johtaa sähköä. Näin ollen sähkönjohtavuus kasvaa lämpötilan noustessa.