Qu’est-ce que le caillage ?
En cuisine, le caillage est la rupture d’une émulsion ou d’un colloïde en grandes parties de composition différente par les processus physico-chimiques de floculation, de crémage et de coalescence. Le caillage est intentionnel et souhaitable dans la fabrication du fromage et du tofu ; non intentionnel et indésirable dans la fabrication des sauces et des flans. Le caillage se produit naturellement dans le lait si le lait n’est pas utilisé avant la date d’expiration, ou si le lait reste à l’extérieur à température chaude.
Le lait est composé de plusieurs composés, principalement de la graisse, des protéines et du sucre. Les protéines du lait sont normalement en suspension dans une solution colloïdale, ce qui signifie que les petites molécules de protéines flottent librement et indépendamment. Ces molécules de protéines flottantes réfractent la lumière et contribuent (avec la graisse en suspension) à l’aspect blanc du lait. Normalement, ces molécules de protéines se repoussent mutuellement, ce qui leur permet de flotter sans s’agglutiner, mais lorsque le pH de leur solution change, elles peuvent s’attirer mutuellement et former des agglomérats. C’est ce qui se produit lorsque le lait caille. Lorsque le pH baisse et devient plus acide, les molécules de protéines (caséine et autres) s’attirent les unes les autres et deviennent des « caillés » flottant dans une solution de lactosérum translucide. Cette réaction d’agglutination se produit plus rapidement à des températures plus chaudes qu’à des températures froides.
Quels sont les poduits du lait qui lui permettent de cailler ?
Le lait est une émulsion ou un colloïde de globules de graisse de beurre au sein d’une mixsture contenant de l’eau, des glucides, des minéraux et des protéines.
Les principaux constituants du lait sont l’eau, la graisse, les protéines, le lactose (sucre du lait) et les minéraux (sels). Le lait contient également des traces d’autres substances telles que des pigments, des enzymes, des vitamines, des phospholipides (substances ayant des propriétés semblables à celles des matières grasses) et des gaz.
Quelle est la teneur en matières grasses du lait ?
Selon The Dairy Council, le lait entier contient 3,9% de matières grasses (c’est-à-dire qu’il contient 3,9g de matières grasses par 100g), le lait demi-écrémé 1,7% de matières grasses, le lait 1% de matières grasses 1% de matières grasses et le lait écrémé 0,3% de matières grasses.
Quelles protéines sont contenues dans le lait ?
La plupart du lait bu aux États-Unis provient des glandes mammaires des vaches. Les principales protéines présentes dans le lait sont uniques et ne se trouvent pas dans les tissus autres que les glandes mammaires. Les protéines du lait, en particulier les caséines, ont une composition en acides aminés utile à la croissance et au développement des jeunes. Parmi les autres protéines du lait, on trouve toute une série d’enzymes, des protéines impliquées dans le transport des nutriments, des protéines impliquées dans la résistance aux maladies (anticorps et autres), des facteurs de croissance, etc. (voir référence 1). La caséine constitue 79,5 % des protéines présentes dans le lait de vache.
Le lait contient 3,3 % de protéines totales. Les protéines du lait contiennent les 9 acides aminés essentiels requis par les humains. Les protéines du lait sont synthétisées dans la glande mammaire, mais 60 % des acides aminés utilisés pour construire les protéines proviennent de l’alimentation de la vache. La teneur totale en protéines du lait et la composition en acides aminés varient selon la race de la vache et la génétique de chaque animal.(2)
Les protéines de lactosérum représentent 19,3 % de la teneur en protéines du lait. Il y a 3 ou 4 caséines dans le lait de la plupart des espèces ; les différentes caséines sont des molécules distinctes mais dont la structure est similaire. Toutes les autres protéines présentes dans le lait sont regroupées sous le nom de protéines de lactosérum. Les principales protéines du lactosérum dans le lait de vache sont la bêta-lactoglobuline et l’alpha-lactalbumine.
Laβ-lactoglobuline est la principale protéine de lactosérum du lait de vache et de brebis et est également présente chez de nombreuses autres espèces de mammifères ; une exception notable étant l’homme.

La molécule de caséine
Une famille de phosphoprotéines apparentées (αS1, αS2, β, κ).
La caséine contient un nombre élevé de résidus proline, qui n’interagissent pas. Il n’y a pas non plus de ponts disulfures. Par conséquent, elle possède relativement peu de structure tertiaire. Elle est relativement hydrophobe, ce qui la rend peu soluble dans l’eau. On la trouve dans le lait sous forme de suspension de particules, appelées micelles de caséine,
La caséine contient un nombre élevé de résidus proline, qui n’interagissent pas. Il n’y a pas non plus de ponts disulfure. Par conséquent, elle possède relativement peu de structure tertiaire. Elle est relativement hydrophobe, ce qui la rend peu soluble dans l’eau. On la trouve dans le lait sous forme de suspension de particules, appelées micelles de caséine,
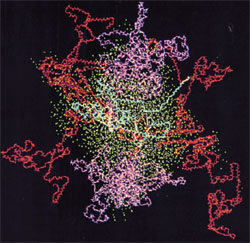
Image : Micelle de caséine, casseine kappa en bleu, caséine alpha en rouge, caséine bêta en magenta, oxygène de l’eau en cyan. Source : Kumosinski, T.F., King, G. et Farrell, H.M., Jr. (1994).Comparaison des modèles moléculaires tridimensionnels des caséines submicellaires bovines avec la diffusion des rayons X aux petits angles.
Les caséines du lait de vache peuvent inclure différentes formes, le lait de vache contenant généralement un des deux types de caséine bêta. selon le profil génétique d’une vache individuelle, le lait produit contiendra soit des caséines A1-bêta, soit des caséines A2-bêta.
Toutes les molécules de caséine ont au moins un phosphate lié à un ester. Aucune des protéines du petit-lait n’en possède.
Le point isoélectrique de la caséine est de 4,6. Comme le pH du lait est de 6,6, la caséine a une charge négative dans le lait.
Les caséines ont une répartition très inégale des charges le long de la molécule alors que dans les principales protéines du lactosérum, les charges sont plus uniformément réparties. Cela explique l’une des principales propriétés des caséines dans le lait, leur nature amphiphile. Les régions chargées sont, en général, hydrophiles ou aimant l’eau et les régions non chargées le long de la molécule sont plus hydrophobes ou détestant l’eau. Comme ces régions sont inégalement réparties le long de la molécule, ces régions sont plus exposées.
Dans les protéines à répartition uniforme, les régions hydrophiles et hydrophobes s’annulent fondamentalement. C’est en raison de la nature amphiphile des molécules de caséine qu’émerge l’une des propriétés les plus importantes de la caséine, la micelle de caséine. La plupart des caséines du lait se trouvent dans des agrégations lâches complexes appelées micelles.
La micelle de caséine est stabilisée de deux façons. Premièrement, le phosphate de calcium se trouve en forte concentration dans le lait et dans la micelle de caséine elle-même. La concentration est telle que de petites agrégations du phosphate se forment. Une partie du phosphate est relativement libre de passer dans et hors de la micelle et une autre partie est fortement liée à la protéine. Ce phosphate lié se trouve dans de minuscules agrégations de phosphate de calcium non dissous (colloïdal). Ceux-ci ont tendance à cimenter la micelle en stabilisant sa structure.
K-caséine et caillage du lait
L’autre effet stabilisateur est dû à une propriété de la K-caséine. La K-caséine possède dans sa structure un groupe glucidique qui est estérifié à la thréonine de la protéine. Ce groupe glucidique contient des groupes chargés négativement. Le résultat est que la K-caséine est rendue plus hydrophile sur une partie de la molécule. Dans la micelle, la K-caséine et, dans une certaine mesure, la B-caséine s’auto-localisent à proximité de l’interface de l’eau de la micelle ou s’y étendent. Cela stabilise la micelle en empêchant l’agrégation des micelles par répulsion stérique (en empêchant le rapprochement entre les micelles de caséine). Pour la K-caséine, la liaison peptidique entre les 105e et 106e acides aminés est vulnérable à l’hydrolyse par les enzymes protéolytiques (coagulateur microbien ou présure). C’est le mécanisme de formation du caillé (en éliminant la partie de la protéine contenant des glucides et en réduisant ainsi la stabilité stérique). La perte de la protection de la K-caséine permet aux micelles de caséine de s’agréger et de former un caillé cohérent.
Pour comprendre comment la chymosine coagule le lait, il faut connaître un peu les protéines du lait. La majorité des protéines du lait sont des caséines et il existe quatre grands types de molécules de caséine : alpha-s1, alpha-s2, bêta et kappa. Les caséines alpha et bêta sont des protéines hydrophobes qui sont facilement précipitées par le calcium – la concentration normale de calcium dans le lait est bien supérieure à celle requise pour précipiter ces protéines. En revanche, la caséine kappa est une molécule nettement différente – elle n’est pas précipitable par le calcium. Lorsque les caséines sont sécrétées, elles s’associent en agrégats appelés micelles dans lesquels les caséines alpha et bêta sont empêchées de précipiter par leurs interactions avec la caséine kappa. En substance, la caséine kappa garde normalement la majorité des protéines du lait solubles et les empêche de coaguler spontanément.
Entrez la chymosine
La chymosine coupe et inactive protéolytiquement la caséine kappa, la convertissant en para-kappa-caséine et en une protéine plus petite appelée macropeptide. La para-kappa-caséine n’a pas la capacité de stabiliser la structure micellaire et les caséines insolubles dans le calcium précipitent, formant un caillé.
Les molécules de caséine peuvent également être séparées du petit-lait par précipitation de la caséine avec de l’acide (similaire à ce qui se passe dans l’estomac lorsque le lait est consommé) ou en perturbant la structure micellaire par hydrolyse partielle des molécules de protéines avec une enzyme protéolytique. Dans l’estomac des jeunes de nombreuses espèces se trouve une enzyme appelée rennine qui hydrolyse spécifiquement une partie de la micelle de caséine, entraînant la formation d’un caillé. Une méthode classique de précipitation de la caséine dans le lait de vache, réalisée en laboratoire, consiste à ajouter lentement du HCl (0,1 N) pour abaisser le pH du lait à 4,6. La caséine va progressivement former un précipité, tandis que les autres protéines du lait ne précipiteront que très peu. Différentes combinaisons de précipitation acide contrôlée et d’hydrolyse enzymatique de la caséine sont à la base des industries fromagères. Souvent, des cultures bactériennes spécifiques sont utilisées pour établir les conditions d’abaissement du pH et de sécrétion d’enzymes protéolytiques qui forment les différents types de fromage.
Qu’est-ce que le lactosérum ?
Le lactosérum est le liquide restant après que le lait ait caillé et ait été filtré. Les protéines du lactosérum sont constituées d’α-lactalbumine, de β-lactoglobuline, de sérum-albumine, d’immunoglobulines,
La protéine de lactosérum est une protéine de haute qualité naturellement présente dans les produits laitiers. C’est une protéine « complète » qui contient tous les acides aminés essentiels requis par le corps humain et qui est facile à digérer.
Les protéines de lactosérum, également appelées protéines sériques, ne contiennent pas de phosphore et ne coagulent pas à un pH de 4,6.
Le lactosérum peut être utilisé pour fabriquer du fromage ricotta. Traditionnellement, le petit-lait du lait de brebis est cuit jusqu’à ce qu’il devienne du caillé mou et moelleux.
Effet du pH
A mesure que le pH baisse et devient plus acide, les molécules de protéines (caséine) s’attirent les unes les autres et deviennent des « caillés » flottant dans une solution de petit-lait translucide. Cette réaction d’agglutination se produit plus rapidement à des températures plus chaudes qu’à des températures froides.
Les caillés sont un produit laitier obtenu par coagulation du lait dans un processus appelé caillage. La coagulation peut être provoquée par l’ajout de présure ou de toute substance acide comestible telle que le jus de citron ou le vinaigre, puis en laissant reposer.