Kulcsszavak
hypermobilitás, kötőszöveti diszplázia, ehlers-danlos-szindróma, Beighton-skála, dysautonómia, poszturális ortosztatikus tachikardia szindróma, irritábilis bél szindróma, hízósejt aktivációs zavar, artikulo-autonómiai diszplázia
Bevezetés
Teljesen alulismert és tragikusan rosszul kezelt a nők 20%-a és a férfiak 10%-a, akiknek a szövetei az átlagosnál rugalmasabbak és törékenyebbek . A megelőzés és a kezelés kevés lehetősége haladja meg a hipermobilitás felismerésének lehetőségét, amelyet könnyen kiszűrhetünk, ha megkérjük a beteget, hogy nyomja a hüvelykujját az alkarjához (1. ábra). Ez az árulkodó jel utat mutathat egy részletesebb vizsgálathoz, amely a háziorvosok hatáskörébe tartozik, mivel széleskörű klinikai ismereteik jól illeszkednek a laza kötőszövetből eredő, több rendszerre kiterjedő problémákhoz. Itt áttekintem a hipermobilitási rendellenességek természetét, bemutatom, hogy az általános és nem a szubspecifikus ismeretek életet megváltoztató terápiákhoz vezethetnek e betegek számára, és bemutatom, hogy a genetikai vizsgálat hogyan hozza a precíziós orvoslás megkülönböztető fényébe az olyan tüneti leírásokat, mint a fibromyalgia vagy a krónikus fáradtság szindróma.
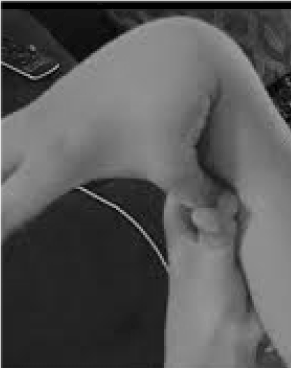
1. ábra. Hipermobilitás.
Egyes akadályokat kell leküzdeni ahhoz, hogy a hipermobilitásban szenvedő betegek élvezhessék az általános orvoslás előnyeit. Az első az Ehlers és Danlos bőrgyógyászok úttörő, de rövidlátó fókuszából ered, akik a kötőszöveti lazasági rendellenességek félrevezető szimbólumaként a bőr hihetetlen és egzotikus megnyúlását nyomták be. A második akadály a gyakorlati és a genetikai orvostudomány közötti növekvő szakadék, az előbbi megfelelően a gyakori betegségekre koncentrál, míg az utóbbi egészen a közelmúltig speciális technológiát használt a ritkák leírására. A homályos névalakok ijesztő altípusokkal és szakkifejezésekkel olyanok, mint egy barátságtalan idegen ország kis tartományai, amelyek feltérképezésére egyetlen globális utazó sem szán időt. Ezekkel az akadályokkal szemben a hipermobilitási rendellenességek gyakorlati megközelítése áll, amely a kórtörténet és a fizikális vizsgálat alapján történő felismerésre összpontosít, a névalakok, altípusok és genetikai vizsgálatok technikai részleteit pedig a feltételezett diagnózis létfontosságú első lépése után megkeresett alszakorvosokra hagyja. Miután felismerték és beutalták, a rugalmas beteg továbbra is a háziorvosától függ, mivel csak ő tudja az ajánlásokat és a vizsgálati eredményeket integrálni az általános orvosi otthonba.
Terminológia
A több ízületi (ízületi) helyen megnövekedett mozgástartomány számos betegségben előfordul, a Down-szindrómához hasonló kromoszóma rendellenességektől kezdve a hipermobilitásukról ismert Ehlers-Danlos-szindrómához (EDS) hasonló rendellenességekig. McKusick népszerűsítette a szövetek lazaságáról ismert rendellenességek e kategóriáját azzal, hogy a kötőszövet örökletes rendellenességeiként csoportosította őket, beleértve a Marfan-szindrómát, amelyre kardiológusként összpontosított. Dr. Peter Beighton, aki a rugalmasságot mérő skálájáról ismert, 1977-ben 6-7 EDS-típus posztulálásával rendszerezte a közbeeső szakirodalmat, amelyet a legújabb irányelvek ma EDS klasszikus, vaszkuláris és hipermobilis típusokként egyszerűsítenek le. Mára világossá vált, hogy ezek a típusok jelentős tüneti átfedéseket mutatnak egymás között és az olyan kapcsolódó rendellenességek között, mint az osteogenesis imperfect (számos töréssel), a Marfan-szindróma (nagy érkitágulás/dissectio), a Stickler-szindróma (szem- és ízületi elváltozások) és sok más.
Ahelyett, hogy egyes betegségekkel foglalkoznék, hasznosabbnak tartom, ha a kötőszöveti diszpláziák két fő betegségfolyamatára összpontosítok, amelyeket az 1. táblázatban felsorolt számos tünet szemléltet. Az első a kopásos ízületi fájdalom (osteoarthritis), amely különbözik a gyulladásos (autoimmun vagy gyulladásos) arthritis duzzadt, vörös ízületeitől, amellyel a rheumatoid arthritisben, lupusban, Sjögren-szindrómában vagy Bechterew-kórban találkozhatunk. A második a hipermobilitási zavarokban a rugalmas erek által okozott autonóm idegrendszeri egyensúlyzavar (dysautonómia) . A táguló erek a vér összecsapódását okozzák a medencében és a lábakban, ami alacsonyabb vérnyomással és szédüléssel/ájulással jár álló helyzetben (ortosztatikus hipotenzió). Idővel a fej felé irányuló csökkent véráramlás aktiválja a vegetatív idegrendszer szimpatikus ágát (az adrenalin “menekülés vagy harc” ágát), ami számos problémához vezet: 1) poszturális ortosztatikus tachikardia szindróma (POTS) tachikardiával, szorongással, krónikus fáradtsággal és “agyköddel” (a figyelem és a memória csökkenésével járó időszakok), 2) irritábilis bél szindróma a bélmozgás gátlása (paraszimpatikus szuppresszió) miatt, hasmenéssel váltakozó székrekedéssel, puffadás, reflux, gyomorfájás, diszfágia, hányinger, és 3) hízósejt-aktivációs zavar átmeneti kiütésekkel, csalánkiütéssel/reaktív bőrrel, asztmával/légszomjjal és étel/gyógyszerintoleranciával. Kifejlesztettem egy tágabb fogalmat, amely megkönnyíti bármely hipermobilitási zavar felismerését, felismerve az ízületi/szöveti lazaság két fő következményét: artikulo-autonómiai diszplázia vagy ízületi-fáradtság komplexum.
1. táblázat. Tipikus leletek és gyakoriságuk a hipermobilitási szindrómákban. *2017-ben részletes kérdőívekkel vizsgált 320 12 év feletti női és 54 férfi betegből; TMJ, temporomandibuláris ízület; POTS, poszturális ortosztatikus tachycardia szindróma. A tünetlista részben adaptálva a Wilson GN, Cooley WC: Preventive Health Care for Children with Genetic Condition (Preventív egészségügyi ellátás genetikai betegségben szenvedő gyermekek számára) című könyvből: Providing a Medical Home. 2nd ed. Cambridge, MA. Cambridge University Press, 2006.
TÖRTÉNET (százalékok)*
Kiskorban: Kólika (28), táplálkozási nehézségek (19,4); ügyetlen, sok esés (29,1)
gyermek/tini: Lassú súlygyarapodás (12); tudatában a hajlékonyságnak (55,6); megmutatta ízületi trükkjeit (53,6)
korai ízületi fájdalmak (42,1); a tizenévesek tevékenységeit fájdalom-sérülés korlátozta (55,4); korai szemüveg (46,8)
fogszabályozás (61,4%) fogínybetegség (11,3); rossz zománc/ sok szuvasodás (31,6)
ízületi problémák: Pattogás (81,6); subluxációk (62); TMJ pattogás, fogás, fájdalom (51,2)
fájdalom legalább 2 ízületben (80,3); ízületi műtétek (33); sok ficam (26); törések >2 (31,5)
porckorongsérv (29,3)
Skeletális problémák: (31); pectus pectus (2,2); járás-betegség (9,3); lúdtalp (15,5)
Bőr: Könnyű véraláfutások (61); nyúlós bőr (15); bársonyos (18); szokatlan hegek (36,3)
terhesség előtti striák (73); lassú gyógyulás (32,4)
Genitális (nők): (61,2); endometriózis (11,3); petefészekciszták (55)
policisztás ovárium szindróma (8,5); hólyagproblémák (46,1); lágyék-/ combsérv (11,5)
Neuromuszkuláris: Migrén (51,7); mindennapos fejfájás (62,3); fejfájás elleni gyógyszerre volt szükség (45)
Chiari deformáció (10,6); idegsebészeti beavatkozás (2,9); zsibbadás/zsibbadás (48,7); egyensúlyzavar (48,6)
neuropátiás nyilalló fájdalom (37,3); izomfájdalom/görcs (51,7); izomgyengeség (32,4)
GI/bél: (67,1); puffadás-reflux-gyomorfájdalom (57,3)
epehólyagproblémák (12,9); nyelési nehézség (23); gyakori hányinger (44,9)
Szív: (8,7); aneurizma (0,9); ritmuszavarok, kivéve tachycardia (6,8)
POTS: Szédülés álló helyzetben (69,8); ájulás (34,5); krónikus fáradtság (81,8); alvászavarok (43,5)
agyköd (időnként rossz memória vagy koncentráció – 70,8); hő-/hidegérzékenység (77,5); rendellenes izzadás (25); tachycardia (72,8); szorongásos-pánikroham (61,3); sószomj (51,2)
Immun/mastasejt: (33,4%); csalánkiütés/reaktív bőr (45,9%); asztma/légszomj (39,3); étel-gyógyszer intolerancia (61,5%)
Labor/képalkotás: Alacsony csontsűrűség (2,1); alacsony D-vitamin (28,7); alacsony B12-vitamin (2,7); hypothyreosis (11,5); alacsony ferritin (1,7); alacsony vas (6,7); emelkedett antinukleáris antitest (7.1)
Leletek átlagos száma 80-ból: nők >12 (35,4 lelet) férfiak >12 (21,5 lelet)
Fizikai (százalék)
Ép: (55,2); nehéz-BMI >28 (21,3); sovány-BMI <19 (14,2)
Marfanoid habitus (44); arachnodaktíliás (46,4); Walker-Murdoch jel jelen (40,2)
arc: Hosszú (25,7); feszes alsó arc (5,4); kékesszürke sclera (1,6); magas szájpadlás (53,5)
Bőr: Puha (81,4); áttetsző (23,8); rugalmas-emelő >1 hüvelykes ránc az állkapocs körül az alkar közepén (51,3)
A ráncok külső (epidermális) rétegből állnak (35.4); szokatlan hegek (42,1%)
Beighton-pontszám: 0-3 pont (8,4); 4-6 pont (32,6); 7-8 pont (38,8); 9-ből 9 pont (20,2)
Más manőverek: Kezek összefogása a váll fölött-hátul (68)
felfelé irányuló imajel a hát mögött (71.3); a háton körbevezetett kéz megérinti a köldököt (19.5)
Vázizomzat: Nyaki kyphosis (41.2); scoliosis (22.3); lordosis (32.8); lúdtalp (39.6)
járás – befelé vagy kifelé lépés (28.3)
Neurológiai: Izomgyengeség (11,2); csökkent izomtömeg (8,8)
egyensúlyzavar tandemjárásnál (33,4)
Leletek átlagos száma 40-ből: nők >12 (17,9 lelet) férfiak >12 (15.7 lelet)
Artikulo-autonómiai diszplázia (AAD)
Az “artikulo-autonómiai diszplázia” vagy AAD kifejezés egységesítheti a kötőszöveti lazaság/hipermobilitási zavarok megközelítését, és ellensúlyozhat három problémát, amelyek megnehezítik felismerésüket: 1) sok orvos és genetikus a kötőszöveti diszpláziákat ritka és szélsőséges betegségeknek tekinti, holott valójában a népesség mintegy 1%-át érintik 2) az EDS diagnosztikai irányelvei , bár leegyszerűsítik a főbb EDS-típusokat klasszikus, vaszkuláris és hipermobilitásként, még mindig zavart okoznak azzal, hogy számos kisebb típusra hivatkoznak, amelyek átfedő tünetspektrumot alkotnak, és 3) az EDS-t és a kapcsolódó rendellenességeket kísérő, szinte kötelezően fennálló dysautonomia (1. táblázat) mint diagnosztikai kritérium kimarad, hasonlóan az elefánt leírásához, a törzsének említése nélkül. Az AAD ugyanúgy jelöli a laza szövet és a dysautonómia közötti elkerülhetetlen fiziológiai kapcsolatot, ahogyan a metabolikus vagy hepatorenális szindrómák leírják, hogy az elhízás hogyan vezet májbetegséghez/diabéteszhez, vagy a májelégtelenség hogyan okoz vesebetegséget.
A legtöbb orvosi mintához vagy szindrómához hasonlóan, beleértve az EDS-t is, az AAD egy tünetegyüttes, amelynek számos kiváltó oka van. Az “articulo” az ízületre utal, felismerve, hogy bármely ízületi komponens – bőr, ideg, izom, csont, kötőszövet, ér – érintettsége hasonló mintázatot okoz az ízületi-szöveti lazaság autonóm egyensúlyzavarral. A bőr törékenysége, a csontsűrűség csökkenése törésekre való hajlam, izomgyengeség fájdalommal (myalgia), neuropátia zsibbadással/zsibbadással, kéztőalagút vagy regionális fájdalom szindróma, autonóm változások, beleértve a tachycardia, szorongás, nem pihentető alvás, bélmozgás, csalánkiütés/kiütés, étel-gyógyszer intolerancia, mind változó mértékben jelen vannak még az EDS bizonyos “típusain” belül is. Nem találtam nagy különbségeket az EDS egyes típusaihoz illeszkedő betegek között, amit az I. típusú klasszikus cEDS esetében a gyakoribb bőrelváltozások, míg a III. típusú hipermobilis hEDS esetében a nagyobb ízületi rugalmasság szemléltet. A szisztematikus lekérdezéssel regisztrált 374 beteg tüneteinek gyakorisága nem különbözött jelentősen azok között, akiket cEDS-nek vagy hEDS-nek diagnosztizáltam, és még az a 8 beteg sem különbözött jelentősen, akiket a III-as típusú kollagén génmutációjuk révén lehetséges vaszkuláris vEDS-ként azonosítottak (a 8 beteg egyikénél jelen lévő aneurizmák ugyanolyan alacsony gyakorisággal fordultak elő más EDS-kategóriákban). A legfontosabb az EDS spektrumának fogalma, amelyet véleményem szerint legjobban az AAD képvisel.
Az EDS és a kapcsolódó kötőszöveti diszpláziák által okozott AAD tünetegyüttes felismerése megelőzi a szomorú betegutakat specialistáról specialistára, az olyan tüneti diagnózisokat, mint a szédülés, ájulás, fibromyalgia vagy krónikus fáradtság, és a tragikus szenvedést, amikor számos megelőző stratégia és kezelés áll rendelkezésre. Továbbá a dysautonómia felismerése megmagyarázza a POTS okozta szorongást és a krónikus fájdalommal vagy aktivitáskorlátozással gyakran együtt járó depressziót , olyan viselkedésbeli különbségeket, amelyek inkább az orvosi, mint a pszichiátriai betegség következményeiként ismerhetők fel.
A genetikai vizsgálatok alátámasztják az artikulo-autonómiai diszplázia koncepcióját
Az EDS és a kapcsolódó rendellenességek szélsőségesebb formáiról megállapították, hogy autoszomális domináns öröklődést mutatnak, ami azt jelenti, hogy az érintett egyének a gén (allél) egy normális és egy kóros formájával rendelkeznek. A domináns öröklődésnek azért van értelme, mert az abnormális allél által termelt hibás fehérje – egy torz téglához hasonlóan – keveredne a másik allél normál tégláival, és egy ingatag szerkezetet hozna létre. Ha az ízületet vagy az artikulációt többkomponensű szerkezetként ismerjük fel, amelyet a felette lévő bőr korlátoz, a belső csont és porc támogat, és a belső ideg, izom, ín, ízületi bélés és ér hatására, az viszont azt jelenti, hogy ezen elemek bármelyike hatással lehet a diszplázia kialakulására, amely a más genetikai rendellenességek által okozott rendellenességektől eltérő szöveti rendellenesség. A DNS klónozásának és szekvenálásának fejlődése megerősítené az autoszomális domináns öröklődés működését és azt, hogy az ízületi szerkezet bármely elemét megváltoztató gének képesek az AAD tünetegyüttesét előidézni.
A genetikai vizsgálatok a beteg tünetei miatt kiválasztott “jelölt” génre összpontosítva kezdődtek, amit a Marfan-szindróma fibrillin-1 génjének vizsgálata szemléltet. A gén DNS AGCT betűinek, a nukleotidok “szövegének” szekvenálása olyan helyettesítéseket vagy “gépelési hibákat” tárhatott fel, amelyek megváltoztatták a kódolt fehérje aminosavát és annak tervezett funkcióját. Ezután jött a NextGen vagy gyors párhuzamos DNS-szekvenálásnak nevezett új technológia, amely ahhoz hasonló, mintha egy könyv összes oldalát egyszerre olvasnánk, nem pedig a végétől a végéig. Ez lehetővé tette olyan géncsoportok (panelek) szekvenálását 2-3 hónap alatt, mint például a kardiomiopátiát vagy a kötőszöveti diszpláziát okozó gének, vagy akár az emberi sejtek (a genomunk) mind a 23 000 génje. A fehérjéket kódoló vagy exonikus génrégiók szekvenálása, az úgynevezett teljes exom szekvenálás (WES) számos cégtől megrendelhető, és az én praxisomban a betegeim felénél kevesebb, mint 200-300 dolláros önköltségi költséggel járt (a listaár 9000 dollár, a biztosítónak kiszámlázott összeg pedig 20 000 dollár körül van).
Bár a WES által részletezett átlagosan 12 000 DNS-variáns értelmezése továbbra is probléma, amelyet a normális és beteg populációkban előforduló variánsok növekvő epidemiológiája csökkent, a praxisomban WES-en átesett 620 beteg körében az AAD tüneteihez hozzájáruló génváltozások hozama több mint 60%. A több mint 80 mutáción kívül a kollagén gének, köztük az általában az osteogenesis imperfectához társított I. típusú kollagén, a klasszikus EDS-hez gyakran társított V. típusú kollagén, a VI., IX. és XII. típusú kollagének, amelyeket eredetileg myopátiákkal írtak le, és az érrendszeri EDS-hez társított, félelmetes III. típusú kollagén, a bőr-, ideg-, izom-, fibrilláris és érkomponenseket érintő gének visszatérő mutációi erősítik az AAD fogalmát, ahol bármelyik ízületi komponens megváltozása az 1. táblázatban vázolt jel- és tünetmintát eredményezi. Most az EDS és az AAD koncepció által felölelt kapcsolódó rendellenességek felismerése objektív DNS bizonyítékokkal támaszthatja alá a klinikai benyomást, ami lehetővé teszi a beteg és a család tanácsadását.
A hipermobilitási rendellenességek/AAD diagnózisa és terápiája
Az ízületi fájdalom/szilárdság és a vegetatív (bél, szív, immunrendszer zavara) fő tüneteinek felismerése a hipermobilitás gyors vizsgálatához vezethet, amint az az 1. ábrán látható. A hüvelykujj az alkarhoz jel előlegezheti a teljes Beighton-skálát, egy pontot adva kétoldalt a 90 fokon túl hátranyomott ujjakra a kézen, a hüvelykujjak alkarhoz való érintésére, a könyök hiperextrakciójára nyújtott karral, a térd hiperextrakciójára, hogy hátrafelé irányuló lábhajlatot képezzen, és 1 pontot a tenyerek padlóhoz való érintésének képességére . Az 1. táblázatban felsoroltakhoz hasonló tünetek rövid felmérése megerősítheti a gyanút, esetleg az 1. táblázat alsó részében felsorolt értékelések némelyikének a fizikális vizsgálatba történő bevonásával. Vegyük figyelembe, hogy nem minden AAD-beteg magas vagy vékony, és hogy jelentős részük túlsúlyos a fájdalom és a fáradtság miatti mozgáskorlátozottság miatt. Sokuknak rugalmas lesz a bőre, amit az állkapocs körüli vagy az alkaron lévő ráncok felhúzásával vizsgálhatunk, különösen, ha ezek a vékony, felszíni hámréteg ráncai. Gyakori a fehér szövet felhalmozódása vagy keloidképződés a hegek körül, és a Beighton- vagy más, az 1. táblázatban felsorolt hipermobilitási manőverek értékelése hasznos lehet. Előre görbült nyakkal, szkoliózissal és lordózissal járó beesett testtartás figyelhető meg, valamint lúdtalp vagy járáskor a lábujjak kilépése (jobban, mint befelé). Az izomerő néhány betegnél csökken, a rossz egyensúlyérzékkel együtt a tandemjárásnál, de a korlátozott idővel rendelkező általános orvosnak csak néhány ilyen fizikai jelre kell figyelnie; a többit a beutaló fogja megállapítani.
A legfontosabbak azok az ortopédusok, akik ismerik az EDS osteoarthritisét és kísérő elváltozásait, mint a degeneratív ízületi elváltozások, a porcok romlása, a plica sávok és az elhalt csontok területei. Kívánatos egy tapasztalt és konzervatív ortopéd orvos, aki felismeri az ízületek “meghúzására” vagy cseréjére irányuló műtétek rossz eredményeit. A kardiológus dokumentálhatja a POTS-t a szívfrekvencia és a vérnyomás ortosztatikus változásait vizsgáló billenőasztal-teszttel, valamint elektro- és echokardiográfiás vizsgálatokat végezhet az aortatágulat vagy aneurizma kizárására. A neurológus felmérheti a gyakori migrént vagy napi fejfájást, a laza agyszövet csúszásával és sérvével járó Chiari-deformációt, a laza ízületekben fellépő szűkület miatti neuropátiát, valamint a fibromyalgia tünetleírással jelzett és a gyakori myopátiás génváltozások által kiemelt izomelváltozásokat, ami elősegíti a myopátiás EDS új kifejezésének kialakulását. A hízósejtek aktivációját jól ismerő allergológusok és az alacsony bélmozgást dokumentálni tudó gasztroenterológusok értékes kiegészítői az alszakmai csapatnak, és senki sem értékesebb a háziorvosnál a számos ajánlás és az esetlegesen szükséges gyógyszerek kezelésében. Bár furcsának tűnhet, hogy ez egy genetikus szájából hangzik el, úgy gondolom, hogy a terápiához vezető alszakmai értékelések magasabb rendűek, mint a genetikai értékelés és tesztelés, de az utóbbi hasznos lehet a pszichiátriai betegséggel kapcsolatos feltételezések eloszlatásában .
A kezelés egy olyan mozgásprogrammal kezdődik, amely mind az ízületi hipermobilitás miatti artritisz, mind a reflexív dysautonomia javára válhat. Az ízületi fájdalmakra (a növekvő fájdalmak éjszaka jelentkeznek) vagy a sérülésekre/csontdeformitásra való odafigyelés beindíthatja a megelőzést azáltal, hogy a beteg tudatosítja az állapotát (az 1. táblázatban megjegyezzük, hogy sokan nem ismerik fel a hajlékonyságukat kórosnak). A kopásos sérülések megelőzhetők az érzékeny ízületek merevítésével, derékszíjakkal a hát megtámasztására, és olyan ízületkímélő tevékenységek választásával, mint az úszás a kocogás helyett. A betegeknek továbbra is aktívnak kell maradniuk mérsékelt súlyemeléssel és más ésszerű tevékenységekkel az ízületek körüli izmok építése érdekében, megelőzve az inaktivitás ciklusait, amelyek súlyosbítják a krónikus fáradtságot vagy a fibromyalgiát. A megfelelő fizikoterápia, a fájdalomcsillapítás, a testmozgás-irányítás és az anekdotikus gyógyszerek, például a glükozamin/kondroitin készítmények sokaknak segítettek, de kerülni kell az ízületek izomvédelmét elvevő relaxánsokat és a szteroid injekciókat, amelyek elfedik a sérülést, elősegítik a csontritkulást/degenerációt, és csak átmeneti enyhülést adnak.
A dysautonomia terápiájának alappillére a hidratálás (napi 8-10 pohár folyadék), a só (labilis hipertónia hiányában) és a magas fehérjetartalmú diéta, mindezek célja a vér folyadékmennyiségének növelése és az agyi keringés javítása. Kiegészítő táplálkozási terápia lehet a C-vitamin (napi 2 g) D-vitamin (>2000 egység naponta, több mint a multivitaminokban lévő 400-800), B12-vitamin (napi 1-2,5 mg). Az alacsony bélmozgékonyságon vagy gasztroparézisen segít az étkezések előtti folyadékfogyasztás kerülése, kisebb és gyakoribb étkezések, probiotikumok, enzimkészítmények és sokak beszámolója szerint a glutén és a tejtermékek csökkentése, amelyek gyakori irritáló hatásúak. A POTS esetében kardiológusokon keresztül kardiológusoknál (pl. béta-blokkolók, Midodrine, Florinef), neurológusokon vagy fájdalomcsillapítókon keresztül (pl. Gabapentin, Lyrica), vagy allergológusokon keresztül, akik antihisztamin protokollokat tudnak biztosítani a hízósejtek elnyomására (pl. Zyrtec, Zantac, Cromolyn, Singulair), számos gyógyszeres lehetőség áll rendelkezésre. A WES-hez hasonló, a kötőszöveti diszpláziát okozó ismert géneken túlmutató genomikai vizsgálatok előnyei az olyan új felfedezések, mint az EDS-t okozó, az izmokkal kapcsolatos, ma már ismert gének, valamint a véletlen vagy másodlagos felfedezések dokumentálása, mint az emlő-petefészekrák génmutációk. A súlyosabb tünetekkel összefüggő gének megtalálása lehetővé teszi a betegek számára, hogy megismerjék az utódokra vonatkozó kockázatokat, és hogy az értékeikkel összeegyeztethető prenatális vagy preimplantációs genetikai diagnosztikai stratégiákat válasszanak.”
Az eset bemutatása
Eve 18 évesen, szédülten, ájultan, szorongva és gyomorrontással jelentkezett orvosánál, annyira kimerült volt, hogy péntek esténként visszavonult, hogy egész hétvégén pihenjen. Egészséges volt, aktívan tornázott és szurkolt, bátor és okos lány, akinek kitartása a sérülések ellenére az edzői tapsot szerzett. Aztán influenza, amelyből soha nem gyógyult fel, olyan erős hányinger, hogy nem tudott enni, fogyás, ájulás az órán, éjszakánként szívdobogással ébredt, reggel pihentető alvás nélkül ébredt. Eve sok orvosnál járt, még a sürgősségin is, amikor a szívdobogás és a pánik elvette a lélegzetét. Semmi baj, csak a stressz, mondták, minden a fejében van. A tabletták megnyugtatták, de nem gyógyították meg, a fáradtság és a zavarodottság miatt nem tudott dolgozni, és azon tűnődött, hogy talán megőrült. Nem ismerték fel puha és törékeny bőrét, kemény és erős menstruációját, mindennapos fejfájását, és ami a legszembetűnőbb, hipermobilitását, amit ő és a családja normálisnak vélt: “Igen, hajlékonyak és kettős ízületűek vagyunk, nem mindenki?”. válaszolta volna Eve, ha megkérdezik.
Szerencsére Eve új háziorvost keresett, aki az I. táblázatban felsorolt jelek és tünetek közül sokat dokumentálni tudott. Eve-nek korai kólikája és refluxa volt, nehezen szoptatott, nagyon hajlékony volt, az édesanyja “csont nélküli” babának nevezte, és amikor idősebb lett, térdre ült, a lábait hátratett lábakkal (“W”-állás), mondván, hogy így kényelmesebb. Kezdetben lassan járt, gyakran elesett és ügyetlennek tűnt, de hamarosan aktív lett, és mindenhová felmászott, szüleit pedig azzal késztette megrándulásra, hogy a nyakába tette a lábát, vagy könnyedén spárgázott. Ám ahogy belépett az általános iskolába, ízületi fájdalmakra kezdett panaszkodni, éjszaka fájt a lába, a térdei és a bokái pedig aktivitás után zavarták. A gyermekorvosa megnyugtatta a szüleit, hogy csak “növekedési fájdalmai” vannak, de a szülők jobban aggódtak, amikor megpróbált focizni, és folyton kifordult a bokája, az egyik ficam miatt két hónapig bakancsot kellett hordani, miután terheléses törést állapítottak meg.
Eve-nek abba kellett hagynia a focit, de ahogy idősebb lett, a tornában kitűnt, a talajgyakorlatokat választotta, mert a gerendán rosszul egyensúlyozott, és a párhuzamos rúdnál hajlamos volt kihúzni a vállát. Észrevette, hogy az ízületei mozgás közben pattognak, és gyakran szándékosan pattogtatta őket, mert úgy tűnt, ez oldja a feszültséget és a fájdalmat. Kipróbálta a szurkolótornát, sikerrel a manővereknél, de úgy találta, hogy túl érzékeny a hőre. A többi lány “paradicsomarcúnak” nevezte, mivel a gyakorlatok közben túlmelegedett, és könnyen elfáradt, gyakran volt szüksége egy nap pihenőre az edzés után. Emésztési problémái újra felszínre törtek, gyakori székrekedéssel és gyomorfájdalommal, gyakran érezte magát felpuffadva, és hashajtóra volt szüksége. A 6. osztályban a bélproblémái és az ízületi fájdalmai miatt már hiányzott az iskolából, gyakran érezte magát fáradtnak és szédültnek. Reggelente nem érezte magát kipihentnek, és hétvégén gyakran szundikált, ami eltért korábbi aktív és lelkes életmódjától. Gyakran érezte magát szorongónak, amit nem tudott konkrét iskolai vagy családi stresszre visszavezetni, és reggelente fejfájások kezdtek jelentkezni, amiről azt hitte, hogy a rossz alvás miatt van. A szülei ismét elvitték a gyermekorvoshoz, és ismét azt mondták, hogy nincs semmi baj, csak a szokásos iskolai stressz.
Amikor 14 éves volt, Eve súlyos, influenzaszerű betegségben szenvedett, és egy hónapig hiányzott az iskolából, súlyos fáradtsággal, fejfájással, hányingerrel, hányással és súlyvesztéssel. Szörnyű szédülése és némi mellkasi fájdalom volt, úgy érezte, hogy a szíve időnként kalapál (szívdobogása volt). A szülei egy másik gyermekorvos tanácsát kérték, aki elküldte Évát egy kardiológushoz, aki úgy gondolta, hogy a betegségével kapcsolatos stressz és szorongás miatt van tachycardia. Eve-nek propranololt, egy béta-blokkolót adott, hogy lelassítsa a szívverését, de Eve még fáradékonyabb lett, és most már a nap nagy részében ágyhoz volt kötve. Betegsége után az ízületi fájdalmai fokozódtak, és a nap nagy részét az ágyban töltötte, szomorú volt, és szorongott, amikor a szülei megpróbálták kivinni a szabadba vagy elvinni kocsikázni. Visszavitték a második gyermekorvoshoz, aki beutalta a pszichiátriára, és Zoloftot kezdtek használni a szorongás és a depresszió kezelésére. Néhány nap múlva Eve-nek csalánkiütéses kiütései lettek, és le kellett állítani ezt a gyógyszert. Továbbra is szédült, és még két szakorvosnál járt, egy gasztroenterológusnál, aki szerint cöliákiája lehet, és egy fül-orr-gégésznél, aki szédülést diagnosztizált, és neurológiára küldte. Ennek az orvosnak a tarkójából kiinduló fejfájásról beszélt, és egy háton fekvő fej MRI-vizsgálatot végeztek, amely normális volt.
Azzal, hogy az elsődleges orvosa felismerte a valószínű AAD-diagnózist, egy másik szakorvosi beutaló kör indult, beleértve a neurológiát, ahol egy függőleges fej MRI-vizsgálat kimutatta a Chiari-deformáció sérvét. Egy kardiológus abnormális billenőasztal-tesztet dokumentált alacsony bélmozgékonysággal együtt, és bebizonyította, hogy szorongása és stressz-fáradtsága dysautonomiára vezethető vissza. A béta-blokkoló és antihisztamin terápiával kísért táplálkozási hidratációs-só- és magas fehérjetartalmú stratégiák javították fáradtságát és bélrendszeri tüneteit, és csökkentették fejfájását. Úgy döntöttek, hogy a 4-5 mm-es Chiari-sérv nem elegendő ahhoz, hogy műtétet igényeljen, és pszichiátriai kezelését egy orvosi rendellenesség másodlagos tüneteinek kezelésének tekintették. Néhány, a klinikai diagnózissal kapcsolatban szkeptikusnak tűnő szakorvosát meggyőzte a genetikai vizsgálat, amely az V típusú kollagén alfa-1 láncának génjében (rövidítve COL5A1) bekövetkezett változást dokumentálta, ami az EDS-ben szenvedő betegeknél gyakori lelet. Eve a mutációt az édesanyjától örökölte, akinek enyhébb AAD-tünetei voltak, és most már jobban tudta kezelni azokat.
Eve egészsége és életereje több hónap alatt helyreállt, és “visszakapta az életét”, ahogy ő és a szülei mondanák. Alkalmanként még mindig voltak ízületi fájdalmai, szorongása és fáradtsága, de a “bölcs testmozgás” az izmok védelmének kiépítésére az ízületei körül, a táplálkozási megközelítések a dysautonomia ellen, és a biofeedback megközelítések a szorongás megelőzésére megváltoztatták az életét . Ezek a kezelések mind a háziorvosa felismerésének köszönhetőek, aki most már képes volt koordinálni Eve és édesanyja ellátását, és forrásokat biztosítani mind az EDS, mind az annak hátterében álló génváltozások megértéséhez. A következő generációra való átmenet az volt, hogy Eve-et tájékoztatni tudta a COL5A mutáció továbbadásának 50%-os kockázatáról, valamint a korai szülés és a szülés utáni vérzés bizonyos kockázatairól bármely jövőbeli terhességben .
- Remvig L, Jensen DV, Ward RC (2007) Epidemiology of general joint hypermobility and basis for the proposed criteria for benign joint hypermobility syndrome: review of the literature . J Rheumatol 34: 804-809.
- Steinman B, Royce PM, Superti-Furga A (1993) The Ehlers-Danlos syndrome. In: Connective Tissue and its Heritable Disorders. B Steinman, PM Royce (szerk.) Wiley-Liss: New York pp. 351-407.
- McKusick VA (1956) Heritable disorders of connective tissue. CV Mosby: St. Louis.
- Bloom L, Byers P, Francomano C, Tinkle B, Malfait F (2017) The International Consortium on the Ehlers-Danlos Syndromes. Am J Med Genet Part C Semin Med Genet 175: 5-7.
- Gazit Y1, Nahir AM, Grahame R, Jacob G (2003) Dysautonomia az ízületi hipermobilitás szindrómában. Am J Med 115: 33-40.
- Pizzo PA1 (2013) Tanulságok a fájdalomcsillapításról–egy személyes posztgraduális tapasztalat. N Engl J Med 369: 1092-1093.
- Pyeritz RE (2008) Egy kis molekula egy nagy betegségre. N Engl J Med 358: 2829-2831.
- 8. Wyandt HE, Wilson GN, Tonk VS. 11. fejezet: Gén- és genomszekvenálás: A genetikai variáció értelmezése nukleotidszinten. In: Human Chromosome Variation: Heteromorphism, Polymorphism, and Pathogenesis, Ed.2. Springer Nature, Singapore
- Mefford HC (2012) Diagnostic exome sequencing–are we there yet? N Engl J Med 367: 1951-1953.
- http://hypermobility.org/help-advice/hypermobility-syndromes/beighton-score/
- Castori M, Morlino S, Celletti C (2013) Rewriting the natural history of pain and related symptoms in the joint hypermobility syndrome/Ehlers-Danlos syndrome, hypermobility type. Am J Med Genet A 12: 2989-3004.
- Simpson MR (2006) Benign joint hypermobility syndrome: evaluation, diagnosis, and management. J Am Osteopath Assoc 106: 531-536.
- Kirk JA, Ansell BM, Bywaters EG (1967) The hypermobility syndrome. Generalizált ízületi hipermobilitással járó mozgásszervi panaszok. Ann Rheum Dis 26: 419-425.
- Wilson GN (2014) Presymptomatic and preimplantation genetic diagnosis: Neurológia, NextGenetics és a következő generáció. JAMA Neurol 71: 403-404.
- Castori M, Morlino S, Celletti C (2012) Management of pain and fatigue in the joint hypermobility syndrome (a.k.a. Ehlers- Danlos syndrome, hypermobility type): principles and proposal for a multidisciplinary approach. Am J Med Genet A 158: 2055-2070.
- Castori M, Morlino S, Celletti C (2013) Rewriting the natural history of pain and related symptoms in the joint hypermobility syndrome/Ehlers-Danlos syndrome, hypermobility type. Am J Med Genet A 161A: 2989-3004.
- Bathen T, Hangmann AB, Hoff M (2013) A fogyatékosság multidiszciplináris kezelése az Ehlers-Danlos-szindróma hipermobilitás típusa/ hipermobilitás szindróma esetén: egy kísérleti tanulmány, amely a fizikai és kognitív-viselkedésterápia kombinációját alkalmazza 12 nőn. Am J Med Genet A 161A: 3005-3011.
- EDS (2018) Ehlers-Danlos Syndrome National Foundation.
- OMIM (2018) Online Mendelian Inheritance in Man.
- Wilson GN (2014) Exome analysis of connective tissue dysplasia: death and rebirth of clinical genetics? Am J Med Genet A 164A: 1209-1212.