Pierwiastek chemiczny węgiel jest klasyfikowany jako niemetal. Jest on znany od czasów starożytnych. Jego odkrywca i data odkrycia nie są znane.

Strefa danych
| Klasyfikacja: | Węgiel jest niemetalem |
| Kolor: | czarny (grafit), przezroczysty (diament) |
| Waga atomowa: | 12.011 |
| Stan: | ciało stałe |
| Temperatura topnienia: | 3550 oC, 3823 K |
| Uwaga: Przy normalnym ciśnieniu atmosferycznym węgiel nie topi się po podgrzaniu, sublimuje. To znaczy, że ulega przemianie fazowej bezpośrednio z ciała stałego w gaz. Jeśli ciśnienie zostanie zwiększone do 10 atmosfer, obserwuje się topnienie węgla (grafitu) w temperaturze 3550 °C. | |
| Temperatura wrzenia: | 3825 oC, 4098 K |
| Podana temperatura wrzenia jest rejestrowana, gdy ciśnienie pary grafitu nad sublimującym grafitem osiąga 1 atmosferę. | |
| Elektrony: | 6 |
| Protony: | 6 |
| Neutrony w najliczniejszym izotopie: | 6 |
| Powłoki elektronowe: | 2,4 |
| Konfiguracja elektronów: | 1s2 2s2 2p2 |
| Gęstość @ 20oC: | 2.267 g/cm3 (gr), 3,513 g/cm3 (di) |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie, Reakcje,
Związki, Promienie, Przewodności
| Objętość atomowa: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) | |
| Struktura: | warstwy heksagonalne (grafit), tetraedryczne (diament) | |
| Twardość: | 0,5 mohs (grafit), 10,0 mohs (diament) | |
| Ciepło właściwe | 0,71 J g-1 K-1 (grafit), 0.5091 J g-1 K-1 (diament) |
|
| Ciepło topnienia | 117 kJ mol-1 (grafit) | |
| Ciepło atomizacji | 717 kJ mol-1 | |
| Ciepło parowania | 710.9 kJ mol-1 | |
| 1. energia jonizacji | 1086.5 kJ mol-1 | |
| 2-gie energia jonizacji | 2352,6 kJ mol-1 | |
| 3-cie energia jonizacji | 4620,5 kJ mol-1 | |
| Przybliżenie elektronów | 121.55 kJ mol-1 | |
| Minimalna liczba utleniania | -4 | |
| Min. wspólna liczba utleniania. | -4 | |
| Maksymalna liczba utlenienia | 4 | |
| Maks. wspólna liczba utlenienia. | 4 | |
| Elektronegatywność (skala Paulinga) | 2,55 | |
| Objętość polaryzacji | 1.8 Å3 | |
| Reakcja z powietrzem | energiczna, ⇒ CO2 | |
| Reakcja z 15 M HNO3 | łagodna, w/ht ⇒ C6(CO2H)6 (kwas mellitowy/grafitowy) | |
| Reakcja z 6 M HCl | brak | |
| Reakcja z 6 M NaOH | brak | |
| Tlenek(i) | CO , CO2 | |
| Wodorek(i) | CH4 i wiele CxHy | |
| Chlorek(i) | CCl4 | |
| Promień atomowy | 70 pm | |
| Chlorki | ||
| . | Promień jonowy (1+ jon) | – |
| Promień jonowy (2+ jon) | – | |
| Promień jonowy (3+ jon) | – | |
| Promień jonowy (1- jon) | – | |
| Promień jonowy (2-jon) | – | |
| Promień jonowy (3-jon) | – | |
| Przewodność cieplna | 25-470 W m-1 K-1 (grafit), 470 W m-1 K-1 (diament) | |
| Przewodność elektryczna | 0.07 x 106 S m-1 | |
| Temperatura zamarzania/topnienia: | 3550 oC, 3823 K |

Modele struktury nanorurek węglowych.

Lavoisier używający olbrzymiej soczewki w eksperymentach nad spalaniem
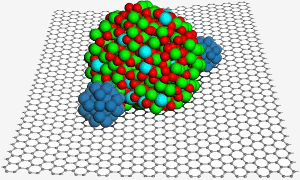
Powierzchnia grafenu gości nanocząstkę tlenku indu cyny, która pomaga zabezpieczyć dwie nanocząstki platyny (niebieskie) w celu poprawy katalizy w ogniwie paliwowym. Obraz: PNL.
Odkrycie węgla
Węgiel był znany od czasów starożytnych w postaci sadzy, węgla drzewnego, grafitu i diamentów. Starożytne kultury nie zdawały sobie oczywiście sprawy, że te substancje były różnymi formami tego samego pierwiastka
Francuski naukowiec Antoine Lavoisier nazwał węgiel i przeprowadził szereg eksperymentów, aby ujawnić jego naturę.
W 1772 roku połączył zasoby z innymi chemikami, aby kupić diament, który umieścili w zamkniętym szklanym słoju. Skupili promienie słoneczne na diamencie za pomocą niezwykłego gigantycznego szkła powiększającego i zobaczyli, jak diament płonie i znika.
Lavoisier zauważył, że całkowita waga słoika pozostała niezmieniona i że podczas spalania diament połączył się z tlenem, tworząc dwutlenek węgla. (1), (2) Doszedł do wniosku, że diament i węgiel drzewny są zbudowane z tego samego pierwiastka – węgla.
W 1779 r. szwedzki uczony Carl Scheele wykazał, że grafit spala się, tworząc dwutlenek węgla, a więc musi być inną formą węgla.(3)
W 1796 r. angielski chemik Smithson Tennant ustalił, że diament jest czystym węglem, a nie związkiem węgla; spala się, tworząc jedynie dwutlenek węgla.
Tennant dowiódł również, że podczas spalania równych wagowo węgli drzewnych i diamentów powstaje taka sama ilość dwutlenku węgla. (4)
W 1855 r. angielski chemik Benjamin Brodie wyprodukował czysty grafit z węgla, udowadniając, że grafit jest formą węgla.(4)
Chociaż wcześniej próbowano tego bez powodzenia, w 1955 r. amerykański naukowiec Francis Bundy i współpracownicy z General Electric ostatecznie wykazali, że grafit można przekształcić w diament w wysokiej temperaturze i pod wysokim ciśnieniem.(5)
W 1985 r. Robert Curl, Harry Kroto i Richard Smalley odkryli fulereny, nową formę węgla, w której atomy są ułożone w kształt piłki nożnej. Najbardziej znanym fullerenem jest buckminsterfulleren, znany również jako C60, składający się z 60 atomów węgla. Istnieje duża rodzina fulerenów, zaczynająca się od C20 i sięgająca aż do C540. (6), (7)
Ostatnio odkrytym alotropem węgla jest grafen, który składa się z pojedynczej warstwy atomów węgla ułożonych w sześciokąty. Gdyby te warstwy zostały ułożone jedna na drugiej, powstałby grafit. Grafen ma grubość zaledwie jednego atomu.
Odkrycie grafenu zostało ogłoszone w 2004 roku przez Kostię Novoselova i Andre Geima, którzy użyli taśmy klejącej, aby oderwać pojedynczą warstwę atomów od grafitu w celu wytworzenia nowego alotropu.
Interesujące fakty o węglu
- Około 20% masy organizmów żywych stanowi węgiel.
- Znanych jest więcej związków, które zawierają węgiel niż nie zawierają.
- Węgiel jest czwartym najbardziej obficie występującym pierwiastkiem we wszechświecie.
- Mimo jego wysokiej obfitości, istnienie węgla zawdzięczamy nieprawdopodobnemu splotowi okoliczności
- Diament jest doskonałym materiałem ściernym, ponieważ jest najtwardszym powszechnie występującym materiałem, a także ma najwyższą przewodność cieplną. Może zetrzeć każdą substancję, podczas gdy ciepło powstałe w wyniku tarcia jest szybko odprowadzane.
- Atomy węgla w twoim ciele były kiedyś częścią frakcji dwutlenku węgla w atmosferze.
- Grafen jest najcieńszym i najmocniejszym materiałem, jaki kiedykolwiek poznano.
- Grafen jest zbudowany z dwuwymiarowych kryształów atomowych, po raz pierwszy w historii zaobserwowano takie struktury.
- Grafit w typowym ołówku mechanicznym ma średnicę 0,7 mm. Jest to równe 2 milionom warstw grafenu.
- Opony samochodowe są czarne, ponieważ zawierają około 30% sadzy, która jest dodawana do gumy, aby ją wzmocnić. Sadza pomaga również chronić opony przed uszkodzeniami spowodowanymi promieniowaniem UV.(8)
- Węgiel powstaje w gwiazdach podczas spalania helu w reakcjach fuzji jądrowej. Węgiel jest częścią „popiołu” powstałego w wyniku spalania helu.
- Węgiel przechodzi reakcje syntezy jądrowej w ciężkich gwiazdach w celu wytworzenia neonu, magnezu i tlenu.




Lewa: Spalanie węgla (głównie węgla amorficznego) w powietrzu. Po prawej: Diamenty (węgiel krystaliczny). Myśleliśmy o zrobieniu zdjęcia palących się diamentów – spalają się w temperaturze około 800oC – ale nie mogliśmy sobie na to pozwolić!

Formy życia oparte na węglu, takie jak te, dominują na naszej planecie.

DNA. Słynna cząsteczka podwójnej helisy jest możliwa dzięki zdolności węgla do tworzenia długich łańcuchów molekularnych.
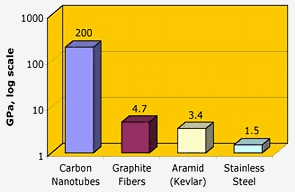
Nasa: Nanorurki węglowe mają wyjątkową wytrzymałość na rozciąganie – o dwa rzędy wielkości większą niż włókna grafitowe, kevlar czy stal.
Sąsiedztwo układu okresowego węgla
| Grupa 13 |
Grupa 14 |
Grupa 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
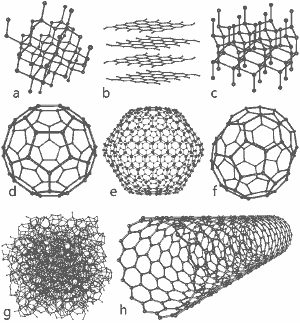
Wspaniały obraz udostępniony przez Michaela Ströcka na licencji GNU Free Documentation License: Struktury ośmiu alotropów węgla: a) Diament b) Grafit c) Lonsdaleit d) C60 (Buckminsterfullerene) e) C540 Fullerene f) C70 Fullerene g) Amorficzny węgiel h) Jednościenna nanorurka węglowa. Kliknij tutaj, aby powiększyć obraz.
Wygląd i charakterystyka
Szkodliwe skutki:
Czysty węgiel ma bardzo niską toksyczność. Wdychanie dużych ilości pyłu sadzy (sadzy/pyłu węglowego) może powodować podrażnienie i uszkodzenie płuc.
Charakterystyka:
Węgiel może istnieć z kilkoma różnymi strukturami trójwymiarowymi, w których jego atomy są ułożone inaczej (alotropy).
Trzy powszechnie występujące alotropy krystaliczne to grafit, diament i (zazwyczaj) fulereny. Grafen ma strukturę krystaliczną 2D.(Fullereny mogą czasami istnieć w postaci amorficznej.)(9)
Węgiel może również istnieć w stanie amorficznym. Wiele alotropów powszechnie opisywane jako amorficzne, jednak, takie jak węgiel szklisty, sadza lub sadza zazwyczaj mają wystarczającą strukturę, aby nie być naprawdę amorficzne. Chociaż zaobserwowano krystaliczne nanorurki, są one na ogół amorficzne.(10)
Struktury ośmiu alotropów są pokazane na dole tej strony.
Co ciekawe, grafit jest jedną z najbardziej miękkich substancji, a diament był do niedawna uważany za najtwardszą naturalnie występującą substancję.
Bardzo rzadki alotrop węgla, lonsdaleite, został obliczony, w czystej postaci, aby być 58% silniejsze niż diament. Lonsdaleit jest diamentopodobną siecią węglową, która ma heksagonalną strukturę grafitu. Powstaje on, gdy meteoryty zawierające grafit uderzają w inne ciało, takie jak Ziemia. Wysoka temperatura i ciśnienie uderzenia przekształcają grafit w lonsdaleite.
Węgiel ma najwyższą temperaturę topnienia/sublimacji ze wszystkich pierwiastków, a w postaci diamentu ma najwyższą przewodność cieplną ze wszystkich pierwiastków.
Wysoka przewodność cieplna diamentu jest źródłem slangowego określenia „lód”. W typowych temperaturach pokojowych temperatura twojego ciała jest wyższa niż temperatura pomieszczenia – w tym wszelkich dużych diamentów, które możesz po prostu przypadkiem mieć leżące wokół. Jeśli dotkniesz któregokolwiek z tych diamentów, ich wysoka przewodność cieplna przenosi ciepło z dala od skóry szybciej niż jakikolwiek inny materiał. Twój mózg interpretuje ten szybki transfer energii cieplnej z dala od skóry, co oznacza, że jesteś dotykając czegoś bardzo zimno – więc diamenty w temperaturze pokojowej może czuć się jak lód.
Usługi węgla
Węgiel (w postaci węgla, który jest głównie węglem) jest używany jako paliwo.
Grafit jest używany do końcówek ołówków, tygli wysokotemperaturowych, suchych ogniw, elektrod i jako smar.
Diamenty są używane w jubilerstwie oraz – ponieważ są tak twarde – w przemyśle do cięcia, wiercenia, szlifowania i polerowania.
Sadza jest używana jako czarny pigment w farbach drukarskich.
Węgiel może tworzyć stopy z żelazem, z których najbardziej powszechna jest stal węglowa.
Izotop promieniotwórczy 14C jest wykorzystywany w datowaniu archeologicznym.
Związki węgla są ważne w wielu dziedzinach przemysłu chemicznego – węgiel tworzy ogromną liczbę związków z wodorem, tlenem, azotem i innymi pierwiastkami.
Abundance and Isotopes
Abundance earth’s crust: 200 parts per million by weight, 344 parts per million by moles
Abundance solar system: 3000 części na milion wagowo, 300 części na milion molowo
Koszt, czysty: 2,4$ za 100g
Koszt, luzem: $ za 100g
Źródło: Węgiel można uzyskać przez spalanie związków organicznych przy niedostatecznej ilości tlenu. Cztery główne alotropy węgla to grafit, diament, węgiel amorficzny i fulereny.
Naturalne diamenty znajdują się w kimberlitach pochodzących ze starożytnych wulkanów.
Grafit można również znaleźć w naturalnych złożach.
Fulereny zostały odkryte jako produkty uboczne eksperymentów z wiązkami molekularnymi w latach 80-tych.
Węgiel amorficzny jest głównym składnikiem węgla drzewnego, sadzy (węgla technicznego) i węgla aktywnego.
Izotopy: 13, których okresy połowicznego rozpadu są znane, o liczbach masowych od 8 do 20. Naturalnie występujący węgiel jest mieszaniną dwóch izotopów i występują one w podanych procentach: 12C (99%) i 13C (1%).
Izotop 14C, o okresie połowicznego rozpadu 5730 lat, jest powszechnie stosowany do datowania materiałów węglowych, takich jak drewno, okazy archeologiczne itp. na wiek do około 40 000 lat.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide, (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, Odkrycie pierwiastków. I. Pierwiastki znane światu starożytnemu, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Chemia supramolekularna., (2009) p423. Wiley.
- Nagroda Nobla w dziedzinie chemii, 1996
- Czego potrzebujemy, aby zrobić oponę?
- Ming Gao and Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite this Page
Aby zamieścić link online, proszę skopiować i wkleić jeden z poniższych fragmentów:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
lub
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Aby zacytować tę stronę w dokumencie naukowym, proszę użyć następującego cytatu zgodnego z MLA:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.
.