Kyselost fenolu
Sloučeniny jako alkoholy a fenol, které obsahují skupinu -OH připojenou k uhlovodíku, jsou velmi slabé kyseliny. Alkoholy jsou tak slabě kyselé, že pro běžné laboratorní účely lze jejich kyselost prakticky ignorovat. Fenol je však dostatečně kyselý na to, aby měl rozpoznatelné kyselé vlastnosti – i když je to stále velmi slabá kyselina. Vodíkový iont se může odtrhnout od skupiny -OH a přejít na zásadu. Například v roztoku ve vodě:

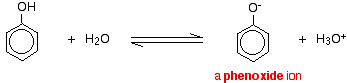
Fenol je velmi slabá kyselina a poloha rovnováhy leží hodně vlevo. Fenol může ztrácet vodíkový iont, protože vzniklý fenoxidový iont je do určité míry stabilizován. Záporný náboj na atomu kyslíku je delokalizován kolem kruhu. Čím je iont stabilnější, tím je pravděpodobnější, že se vytvoří. Jeden z osamělých párů na atomu kyslíku se překrývá s delokalizovanými elektrony na benzenovém kruhu.
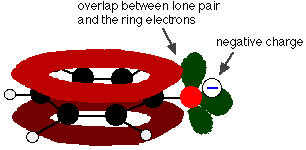
Toto překrytí vede k delokalizaci, která sahá od kruhu ven přes atom kyslíku. Výsledkem je, že záporný náboj již není zcela lokalizován na kyslíku, ale je rozprostřen kolem celého iontu.
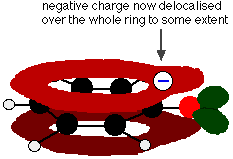
Rozprostřením náboje je iont stabilnější, než kdyby veškerý náboj zůstal na kyslíku. Kyslík je však elektronegativnějším prvkem v iontu a delokalizované elektrony budou přitahovány k němu. To znamená, že kolem kyslíku bude stále hodně náboje, který bude mít tendenci přitahovat vodíkový iont zpět. Proto je fenol jen velmi slabou kyselinou.
Proč je fenol mnohem silnější kyselinou než cyklohexanol? K zodpovězení této otázky musíme vyhodnotit způsob, jakým substituent kyslíku interaguje s benzenovým kruhem. Jak jsme uvedli v předchozím pojednání o reakcích elektrofilní aromatické substituce, substituent kyslíku zvyšuje reaktivitu kruhu a upřednostňuje útok elektrofilů na ortho a para místa. Bylo navrženo, že za tento účinek substituentu je zodpovědná rezonanční delokalizace nevázaného elektronového páru kyslíku do pi-elektronového systému aromatického kruhu. Podobný soubor rezonančních struktur pro konjugovanou bázi fenolátového aniontu se objevuje pod strukturami fenolu.
Stabilizace rezonance je v těchto dvou případech velmi odlišná. Důležitým principem rezonance je, že separace náboje snižuje význam kanonických přispěvatelů k rezonančnímu hybridu a snižuje celkovou stabilizaci. Všechny struktury přispívající k fenolovému hybridu trpí separací náboje, což vede k velmi skromné stabilizaci této sloučeniny. Na druhé straně fenolátový aniont je již nabitý a kanonické přispěvatele působí na rozptýlení náboje, což vede k podstatné stabilizaci tohoto druhu. Konjugované báze jednoduchých alkoholů nejsou stabilizovány delokalizací náboje, takže kyselost těchto sloučenin je podobná kyselosti vody. Energetický diagram znázorňující vliv rezonance na kyselost cyklohexanolu a fenolu je uveden vpravo. Protože rezonanční stabilizace konjugované báze fenolátu je mnohem větší než stabilizace samotného fenolu, kyselost fenolu vzhledem k cyklohexanolu se zvyšuje. Podpůrný důkaz, že záporný náboj fenolátu je delokalizován na ortho a para uhlících benzenového kruhu, pochází z vlivu substituentů stahujících elektrony na těchto místech.

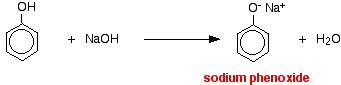
V této reakci byl vodíkový ion odstraněn silně bazickým hydroxidovým iontem v roztoku hydroxidu sodného.
Kyseliny reagují s reaktivnějšími kovy za vzniku plynného vodíku. Fenol není výjimkou – jediným rozdílem je pomalá reakce, protože fenol je tak slabá kyselina. Fenol se zahřívá v suché zkumavce, dokud se neroztaví, a přidá se malý kousek sodíku. Při uvolňování plynného vodíku dochází k šumění. Směs, která zůstane ve zkumavce, bude obsahovat fenoxid sodný.

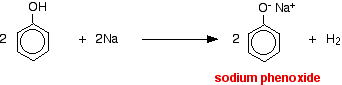
.