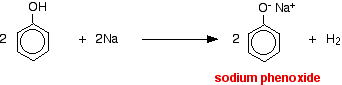Acidità del fenolo
Composti come alcoli e fenoli che contengono un gruppo -OH attaccato a un idrocarburo sono acidi molto deboli. Gli alcoli sono così debolmente acidi che, per i normali scopi di laboratorio, la loro acidità può essere virtualmente ignorata. Tuttavia, il fenolo è sufficientemente acido da avere proprietà acide riconoscibili – anche se è ancora un acido molto debole. Uno ione idrogeno può staccarsi dal gruppo -OH e trasferirsi a una base. Per esempio, in soluzione in acqua:

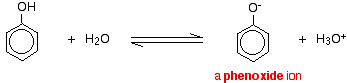
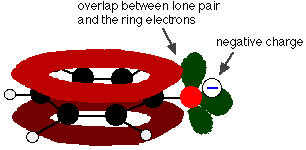
Il fenolo è un acido molto debole e la posizione di equilibrio si trova bene a sinistra. Il fenolo può perdere uno ione idrogeno perché lo ione fenossido formato è stabilizzato in una certa misura. La carica negativa sull’atomo di ossigeno è delocalizzata intorno all’anello. Più lo ione è stabile, più è probabile che si formi. Una delle coppie solitarie sull’atomo di ossigeno si sovrappone agli elettroni delocalizzati sull’anello del benzene.
Questa sovrapposizione porta a una delocalizzazione che si estende dall’anello all’atomo di ossigeno. Di conseguenza, la carica negativa non è più interamente localizzata sull’ossigeno, ma è diffusa intorno a tutto lo ione.
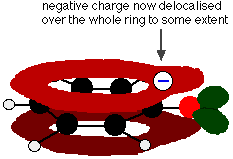
La diffusione della carica rende lo ione più stabile di quanto sarebbe se tutta la carica rimanesse sull’ossigeno. Tuttavia, l’ossigeno è l’elemento più elettronegativo nello ione e gli elettroni delocalizzati saranno attirati verso di esso. Ciò significa che ci sarà ancora molta carica intorno all’ossigeno che tenderà ad attrarre di nuovo lo ione idrogeno. Ecco perché il fenolo è solo un acido molto debole.
Perché il fenolo è un acido molto più forte del cicloesanolo? Per rispondere a questa domanda dobbiamo valutare il modo in cui un sostituente dell’ossigeno interagisce con l’anello benzenico. Come notato nel nostro precedente trattamento delle reazioni di sostituzione aromatica elettrofila, un sostituente dell’ossigeno aumenta la reattività dell’anello e favorisce l’attacco elettrofilo nei siti orto e para. È stato proposto che la delocalizzazione per risonanza di una coppia di elettroni non legati all’ossigeno nel sistema pi-elettronico dell’anello aromatico sia responsabile di questo effetto del sostituente. Una serie simile di strutture di risonanza per la base coniugata dell’anione fenolato appare sotto le strutture del fenolo.
La stabilizzazione della risonanza in questi due casi è molto diversa. Un principio importante della risonanza è che la separazione delle cariche diminuisce l’importanza dei contributori canonici all’ibrido di risonanza e riduce la stabilizzazione complessiva. Le strutture che contribuiscono all’ibrido di fenolo subiscono tutte la separazione di carica, con conseguente stabilizzazione molto modesta di questo composto. D’altra parte, l’anione fenolato è già carico, e i contributori canonici agiscono per disperdere la carica, risultando in una sostanziale stabilizzazione di questa specie. Le basi coniugate degli alcoli semplici non sono stabilizzate dalla delocalizzazione della carica, quindi l’acidità di questi composti è simile a quella dell’acqua. Un diagramma energetico che mostra l’effetto della risonanza sulle acidità del cicloesanolo e del fenolo è mostrato sulla destra. Poiché la stabilizzazione per risonanza della base coniugata del fenolato è molto maggiore della stabilizzazione del fenolo stesso, l’acidità del fenolo rispetto al cicloesanolo è aumentata. La prova che la carica negativa del fenolato è delocalizzata sui carboni orto e para dell’anello benzenico viene dall’influenza dei sostituenti che sottraggono elettroni in quei siti.

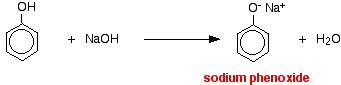
In questa reazione, lo ione idrogeno è stato rimosso dallo ione idrossido fortemente basico nella soluzione di idrossido di sodio.
Gli acidi reagiscono con i metalli più reattivi per dare idrogeno gassoso. Il fenolo non fa eccezione – l’unica differenza è la reazione lenta perché il fenolo è un acido così debole. Il fenolo viene riscaldato in un tubo asciutto fino a quando non è fuso, e viene aggiunto un piccolo pezzo di sodio. C’è un po’ di effervescenza perché viene emesso gas idrogeno. La miscela rimasta nella provetta conterrà fenossido di sodio.