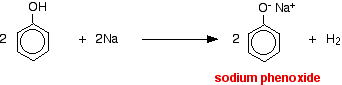Acidez de Fenol
Compostos como álcoois e fenol que contêm um grupo -OH ligado a um hidrocarboneto são ácidos muito fracos. Os álcoois são tão fracamente ácidos que, para fins normais de laboratório, a sua acidez pode ser virtualmente ignorada. No entanto, o fenol é suficientemente ácido para ter propriedades reconhecidamente ácidas – mesmo que ainda seja um ácido muito fraco. Um íon de hidrogênio pode se separar do grupo -OH e se transferir para uma base. Por exemplo, em solução em água:

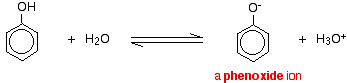
Fenol é um ácido muito fraco e a posição de equilíbrio fica bem à esquerda. O fenol pode perder um íon de hidrogênio porque o íon fenóxido formado é estabilizado até certo ponto. A carga negativa sobre o átomo de oxigênio é deslocada ao redor do anel. Quanto mais estável for o íon, maior a probabilidade da sua formação. Um dos pares solitários no átomo de oxigênio sobrepõe-se aos elétrons deslocalizados no anel de benzeno.
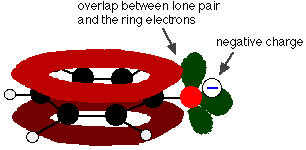
Esta sobreposição leva a uma deslocalização que se estende do anel para fora sobre o átomo de oxigênio. Como resultado, a carga negativa não está mais totalmente localizada sobre o oxigênio, mas se espalha em torno do íon inteiro.
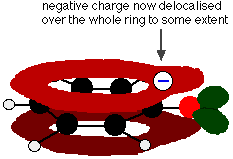
Disseminar a carga em torno torna o íon mais estável do que seria se toda a carga permanecesse sobre o oxigênio. Entretanto, o oxigênio é o elemento mais eletronegativo no íon e os elétrons deslocalizados serão atraídos para ele. Isso significa que ainda haverá muita carga ao redor do oxigênio que tenderá a atrair o íon de hidrogênio de volta. É por isso que o fenol é apenas um ácido muito fraco.
Por que o fenol é um ácido muito mais forte do que o ciclohexanol? Para responder a esta pergunta temos de avaliar a forma como um substituto do oxigénio interage com o anel de benzeno. Como observado em nosso tratamento anterior de reações de substituição eletrofílica aromática, um substituto de oxigênio aumenta a reatividade do anel e favorece o ataque eletrofílico em locais de ortopedia e para. Foi proposto que a deslocalização por ressonância de um par de electrões não ligados ao oxigénio para o sistema pi-electrónico do anel aromático foi responsável por este efeito de substituição. Um conjunto semelhante de estruturas de ressonância para a base conjugada do anião fenolato aparece abaixo das estruturas fenoladas.
A estabilização de ressonância nestes dois casos é muito diferente. Um princípio importante da ressonância é que a separação de cargas diminui a importância dos contribuidores canônicos para o híbrido de ressonância e reduz a estabilização geral. As estruturas que contribuem para o híbrido de fenol sofrem todas separação de carga, resultando em uma estabilização muito modesta deste composto. Por outro lado, o ânion fenolato já está carregado, e os contribuidores canônicos agem para dispersar a carga, resultando em uma estabilização substancial desta espécie. As bases conjugadas de álcoois simples não são estabilizadas pela deslocalização da carga, de modo que a acidez destes compostos é semelhante à da água. Um diagrama energético mostrando o efeito da ressonância no ciclohexanol e na acidez dos fenóis é mostrado à direita. Como a estabilização da ressonância da base conjugada do fenolato é muito maior que a estabilização do próprio fenol, a acidez do fenol em relação ao ciclohexanol é aumentada. Evidências de suporte de que a carga negativa de fenolato é deslocalizada no orto e para carbonos do anel de benzeno provém da influência de substituintes de retirada de elétrons nesses locais.

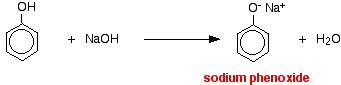
Nesta reação, o íon hidrogênio foi removido pelo íon hidróxido fortemente básico na solução de hidróxido de sódio.
Acids reagem com os metais mais reativos para dar hidrogênio gás. O fenol não é excepção – a única diferença é a reacção lenta porque o fenol é um ácido tão fraco. O fenol é aquecido em um tubo seco até ser fundido, e um pequeno pedaço de sódio é adicionado. Há um pouco de efervescência quando o gás hidrogênio é liberado. A mistura deixada no tubo conterá fenóxido de sódio.