Aciditatea fenolului
Compușii precum alcoolul și fenolul, care conțin o grupare -OH atașată unei hidrocarburi, sunt acizi foarte slabi. Alcoolii sunt atât de slab acizi încât, în scopuri normale de laborator, aciditatea lor poate fi practic ignorată. Cu toate acestea, fenolul este suficient de acid pentru a avea proprietăți acide recognoscibile – chiar dacă este încă un acid foarte slab. Un ion de hidrogen se poate desprinde de gruparea -OH și se poate transfera la o bază. De exemplu, în soluție în apă:

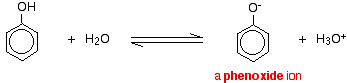
Fenolul este un acid foarte slab, iar poziția de echilibru se află bine la stânga. Fenolul poate pierde un ion de hidrogen deoarece ionul fenoxid format este într-o oarecare măsură stabilizat. Sarcina negativă de pe atomul de oxigen este delocalizată în jurul inelului. Cu cât ionul este mai stabil, cu atât este mai probabil ca acesta să se formeze. Una dintre perechile singuratice de pe atomul de oxigen se suprapune cu electronii delocalizați de pe inelul benzenic.
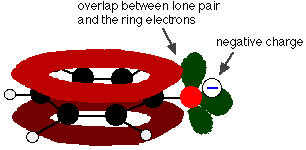
Această suprapunere duce la o delocalizare care se extinde de la inel în afară peste atomul de oxigen. Ca urmare, sarcina negativă nu mai este localizată în întregime pe oxigen, ci este răspândită în jurul întregului ion.
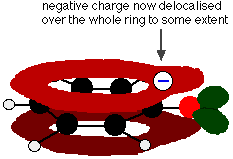
Răspândirea sarcinii face ca ionul să fie mai stabil decât ar fi fost dacă toată sarcina ar fi rămas pe oxigen. Cu toate acestea, oxigenul este elementul cel mai electronegativ din ion și electronii delocalizați vor fi atrași spre el. Aceasta înseamnă că în jurul oxigenului va exista încă o mulțime de sarcină care va tinde să atragă din nou ionul de hidrogen. Acesta este motivul pentru care fenolul este doar un acid foarte slab.
De ce este fenolul un acid mult mai puternic decât ciclohexanolul? Pentru a răspunde la această întrebare trebuie să evaluăm modul în care un substituent de oxigen interacționează cu inelul benzenic. Așa cum am menționat în tratarea anterioară a reacțiilor de substituție aromatică electrofilă, un substituent oxigenat sporește reactivitatea inelului și favorizează atacul electrofil la situsurile orto și para. S-a propus că delocalizarea prin rezonanță a unei perechi de electroni nelegate de oxigen în sistemul de electroni pi al inelului aromatic este responsabilă pentru acest efect de substituent. Un set similar de structuri de rezonanță pentru baza conjugată a anionului fenolat apare sub structurile fenolului.
Stabilizarea rezonanței în aceste două cazuri este foarte diferită. Un principiu important al rezonanței este acela că separarea sarcinilor diminuează importanța contribuitorilor canonici la hibridul de rezonanță și reduce stabilizarea globală. Structurile care contribuie la hibridul de fenol suferă toate o separare de sarcină, ceea ce duce la o stabilizare foarte modestă a acestui compus. Pe de altă parte, anionul fenolat este deja încărcat, iar contribuitorii canonici acționează pentru a dispersa sarcina, ceea ce duce la o stabilizare substanțială a acestei specii. Bazele conjugate ale alcoolilor simpli nu sunt stabilizate prin delocalizare de sarcină, astfel încât aciditatea acestor compuși este similară cu cea a apei. În dreapta este prezentată o diagramă energetică care arată efectul rezonanței asupra acidității ciclohexanolului și fenolului. Deoarece stabilizarea prin rezonanță a bazei conjugate a fenolatului este mult mai mare decât stabilizarea fenolului însuși, aciditatea fenolului în raport cu cea a ciclohexanolului este crescută. Dovezile în sprijinul faptului că sarcina negativă a fenolatului este delocalizată pe carbonii orto și para ai inelului benzenic provin din influența substituenților retractori de electroni în aceste locuri.

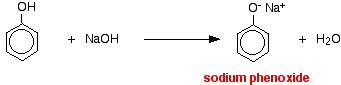
În această reacție, ionul de hidrogen a fost eliminat de către ionul hidroxid puternic bazic din soluția de hidroxid de sodiu.
Acizii reacționează cu metalele mai reactive pentru a da hidrogen gazos. Fenolul nu face excepție – singura diferență este reacția lentă, deoarece fenolul este un acid atât de slab. Fenolul se încălzește într-un tub uscat până când este topit și se adaugă o mică bucată de sodiu. Se produce o mică efervescență în timp ce se degajă hidrogen gazos. Amestecul rămas în tub va conține fenoxid de sodiu.

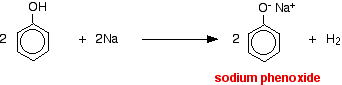
.