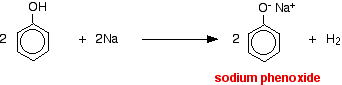Fenolers surhedsgrad
Forbindelser som alkoholer og fenol, der indeholder en -OH-gruppe knyttet til et kulbrinte, er meget svage syrer. Alkoholer er så svagt sure, at man til normale laboratorieformål stort set kan se bort fra deres surhedsgrad. Phenol er imidlertid tilstrækkeligt surt til at have genkendelige sure egenskaber – selv om det stadig er en meget svag syre. En hydrogenion kan løsrive sig fra -OH-gruppen og overføres til en base. F.eks. i opløsning i vand:

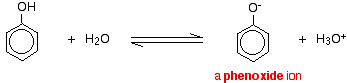
Phenol er en meget svag syre, og ligevægtspositionen ligger godt til venstre. Phenol kan miste en hydrogenion, fordi den dannede phenoxidion er stabiliseret til en vis grad. Den negative ladning på oxygenatomet er delokaliseret rundt om ringen. Jo mere stabil ionen er, jo mere sandsynligt er det, at den dannes. Et af de ensomme par på iltatomet overlapper med de delokaliserede elektroner på benzenringen.
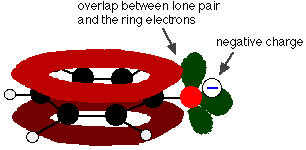
Denne overlapning fører til en delokalisering, der strækker sig fra ringen ud over iltatomet. Som følge heraf er den negative ladning ikke længere helt lokaliseret på iltstoffet, men spredes ud over hele ionen.
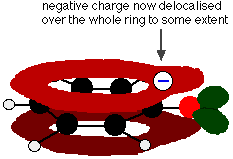
Den spredte ladning gør ionen mere stabil, end den ville være, hvis al ladningen forblev på iltstoffet. Oxygen er imidlertid det mest elektronegative element i ionen, og de delokaliserede elektroner vil blive trukket mod det. Det betyder, at der stadig vil være en masse ladning omkring ilten, som vil have en tendens til at tiltrække hydrogenionen tilbage igen. Det er derfor, at phenol kun er en meget svag syre.
Hvorfor er phenol en meget stærkere syre end cyclohexanol? For at besvare dette spørgsmål må vi vurdere den måde, hvorpå en oxygen-substituent interagerer med benzenringen. Som nævnt i vores tidligere behandling af elektrofil aromatiske substitutionsreaktioner øger en oxygen-substituent ringens reaktivitet og favoriserer elektrofilangreb på ortho- og para-steder. Det blev foreslået, at resonansdelokalisering af et ikke-bundet elektronpar af ilt i den aromatiske rings pi-elektronsystem var ansvarlig for denne substituentvirkning. Et lignende sæt af resonansstrukturer for phenolatanionkonjugatbasen vises under phenolstrukturerne.
Resonansstabiliseringen i disse to tilfælde er meget forskellig. Et vigtigt princip for resonans er, at ladningsadskillelse mindsker betydningen af de kanoniske bidragsydere til resonanshybridet og reducerer den samlede stabilisering. De strukturer, der bidrager til phenolhybridet, lider alle under ladningsadskillelse, hvilket resulterer i en meget beskeden stabilisering af denne forbindelse. På den anden side er phenolat-anionen allerede ladet, og de kanoniske bidragsydere virker for at sprede ladningen, hvilket resulterer i en betydelig stabilisering af denne art. De konjugerede baser af simple alkoholer stabiliseres ikke af ladningsdelokalisering, så surhedsgraden af disse forbindelser svarer til vands surhedsgrad. Et energidiagram, der viser resonansens virkning på cyclohexanol- og phenolsyreindholdet, er vist til højre. Da resonansstabiliseringen af phenolatkonjugatbasen er meget større end stabiliseringen af phenol selv, øges syreindholdet af phenol i forhold til cyclohexanol. Understøttende beviser for, at phenolatets negative ladning er delokaliseret på benzenringens orto- og para-kulbrinter på de ortho- og para-kulbrinter kommer fra indflydelsen af elektron-fortrængende substituenter på disse steder.

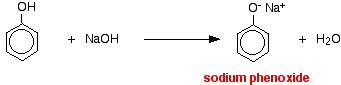
I denne reaktion er hydrogenionen blevet fjernet af den stærkt basiske hydroxid-ion i natriumhydroxidopløsningen.
Syrer reagerer med de mere reaktive metaller for at give hydrogengas. Phenol er ingen undtagelse – den eneste forskel er den langsomme reaktion, fordi phenol er en så svag syre. Phenol opvarmes i et tørt rør, indtil det er smeltet, og der tilsættes et lille stykke natrium. Der opstår en vis brusning, idet der afgives brintgas. Den blanding, der er tilbage i røret, vil indeholde natriumfenoxid.