Ciencia >Química >Elementos de tercera fila >Concepto de enlace metálico y sólidos metálicos
En este artículo estudiaremos el concepto de enlace metálico y los enlaces metálicos en cristales de sodio, magnesio y aluminio.
Concepto de enlace metálico:
El enlace metálico se define como la fuerza de atracción que une a los cationes metálicos con un número de electrones móviles o deslocalizados dentro de su esfera de influencia que mantiene a los cationes metálicos juntos en un patrón definido. Para explicar la naturaleza del enlace metálico se han propuesto muchas teorías. La teoría de los electrones libres o teoría del mar de electrones es una de las más sencillas propuestas por Drude y Lorentz. Algunos de los postulados importantes de esta teoría son los siguientes:
Teoría de los electrones libres del enlace metálico:
Los átomos metálicos tienen menos número de electrones de valencia por lo que tienen muchos orbitales de valencia vacíos. Na, Mg y Al tienen 3 orbitales de valencia vacantes.
| Nombre | Símbolo | Número atómico | Configuración electrónica | Configuración detallada |
| Sodio | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnesio | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminio | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Los valores de potencial de ionización de los metales son bajos, por lo que los electrones de valencia se mantienen sueltos y se pueden eliminar fácilmente. La estructura estrechamente empaquetada del cristal metálico consiste en los átomos del metal que son idénticos en todos los aspectos.
Los orbitales desocupados de los átomos estrechamente empaquetados del metal se superponen con el orbital similar de los átomos adyacentes a través de la red cristalina. Los electrones de valencia se retiran de sus orbitales y pueden moverse libremente de los orbitales de valencia vacantes de un átomo a otro. Dado que estos electrones de valencia no pertenecen a ningún átomo individual, sino al cristal en su conjunto, se denominan electrones deslocalizados o móviles. Los iones metálicos (cationes) producidos debido a la deslocalización se denominan núcleos. Los iones metálicos tienen posiciones fijas en la red cristalina mientras que los electrones deslocalizados son libres de moverse en la red cristalina. Así, el metal puede considerarse como un agregado de cationes metálicos inmersos en un mar de electrones móviles.
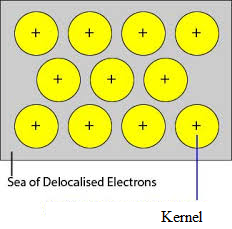
Dado que los electrones de los metales están deslocalizados, y se supone que están uniformemente distribuidos por la red cristalina. Las fuerzas de atracción entre los iones metálicos y los electrones deslocalizados son uniformes en toda la dirección. Por lo tanto el enlace metálico es no direccional.
Las unidades que ocupan los puntos de la red en el Sodio, Magnesio, Aluminio son iones positivos de ellos respectivamente y están rodeados por electrones móviles. Por lo tanto, el sodio, el magnesio y el aluminio son sólidos metálicos.
A medida que nos movemos de izquierda a derecha, es decir, del sodio al aluminio, el número de electrones de valencia aumenta y, por lo tanto, la fuerza del enlace aumenta del sodio al aluminio.
Las propiedades como la conductividad eléctrica y térmica, el brillo metálico, la maleabilidad y la ductilidad pueden explicarse sobre la base de la teoría de los electrones libres.
Características de los enlaces metálicos:
- El enlace metálico se define como la fuerza de atracción que une a los cationes metálicos con un número de electrones móviles o deslocalizados dentro de su esfera de influencia que mantiene los cationes metálicos juntos en un patrón definido.
- El enlace metálico no es direccional.
- Son más débiles que el enlace covalente pero más fuertes que las fuerzas de van der Waal.
- Los enlaces no son rígidos.
- La fuerza del enlace metálico está directamente relacionada con la carga positiva del ion metálico. Así, la fuerza del enlace metálico aumenta a medida que Na < Mg < Al.
Sólidos metálicos:
Los sólidos metálicos son sólidos cristalinos en los que las unidades que ocupan los puntos de la red son iones positivos rodeados por un conjunto de electrones. (Concepto de enlace metálico)
Estructuras cristalinas de los metales:
El análisis de rayos X de diferentes cristales metálicos ha demostrado que los metales adoptan alguna de las siguientes estructuras cristalinas.
- Estructura cúbica centrada en el cuerpo. (BCC)
- Estructura cúbica centrada en la cara. (FCC)
- Estructura cúbica hexagonal cerrada. (HCP)
Sodio (Na):
El sodio metálico tiene una estructura cristalina de empaquetamiento abierto centrada en el cuerpo (BCC). El enlace es metálico no direccional.
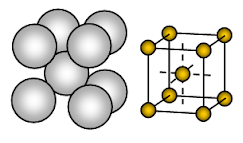
La disposición de los iones en un plano- Conjunto cúbico – estructura de empaquetamiento abierto o cuadrado. En esta disposición, cada ion metálico está en contacto con cuatro iones adyacentes en un plano. La secuencia de las capas es AB, AB, AB, ……….
El sodio es un sólido metálico. En la celda unitaria del sodio, cada ion de sodio está rodeado por otros ocho iones de sodio equidistantes. Por lo tanto, el número de coordinación es 8. Estos iones de sodio están dispuestos en las esquinas de un cubo imaginario y en el centro del cubo hay un ion de sodio. Hay 2 iones presentes en una celda unidad de sodio.
Los iones de sodio ocupan sólo un 68% del espacio disponible en una celda unidad. Por lo tanto, el 32% de la celda unitaria permanece vacía (vacío). Como esta estructura tiene más espacio vacío, los metales que adoptan esta estructura son blandos. El sodio es, por tanto, un metal blando debido a que tiene más espacio vacío (alrededor del 32%) en su estructura cristalina y un enlace metálico bastante débil debido a que sólo hay un electrón de valencia por átomo de Na en su cristal.
Magnesio (Mg):
El magnesio tiene una estructura cristalina hexagonal cerrada (HCP). El enlace es metálico no direccional.
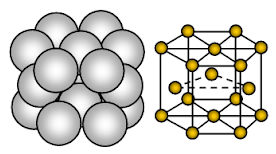
El magnesio es un sólido metálico. Las unidades que ocupan los sitios de la red son iones de Mg y estos iones están rodeados de electrones móviles o deslocalizados.
La disposición de los iones en un plano la disposición de los iones es una matriz hexagonal o capa empaquetada cerrada. Así, cada ion metálico está tocando seis iones adyacentes en un plano. Cada ion de magnesio toca seis iones de magnesio en su propia capa, tres en la capa superior y tres en la capa inferior. En la estructura empaquetada hexagonal, las capas empaquetadas cerradas de iones se apilan en una secuencia alterna que suele llamarse AB ABA ….. Cada tercera capa de iones es exactamente igual y se encuentra directamente encima de la primera capa.
Cada átomo de Mg está rodeado por otros 12 iones de Mg equidistantes. Por lo tanto, el número de coordinación es 12. En la celda unitaria, cerca del 26% del espacio disponible está vacío (void). Esta estructura está más empaquetada. Debido al menor espacio vacío en la estructura cristalina, a la mayor nube de electrones debida al Mg+2 y al fuerte enlace metálico, el magnesio es más duro que el metal sódico. Es más maleable y dúctil que el sodio.
Aluminio (Al):
El aluminio tiene una estructura cristalina cúbica centrada en la cara (FCC). El enlace es metálico no direccional.

El aluminio es un sólido metálico. Las unidades que ocupan los sitios de la red son iones de Al y estos iones están rodeados por electrones móviles o deslocalizados.
La disposición de los iones en un plano la disposición de los iones es una matriz hexagonal o capa empaquetada cerrada. Así, cada ion metálico está en contacto con seis iones adyacentes en un plano.
En una estructura cristalina cúbica de empaquetamiento cerrado o centrada en las caras, la secuencia de capas de iones de empaquetamiento cerrado se repite cada cuatro capas. Es decir, cada cuarta capa de iones es exactamente igual y se encuentra directamente encima de la primera capa. Por lo tanto, se denomina empaquetamiento cúbico cerrado ABC, ABC, ABC, …… El empaquetamiento cúbico cerrado también se llama estructura de empaquetamiento cerrado centrado en la cara porque si se ve desde un ángulo particular, se puede considerar que los iones están en las ocho esquinas del cubo y en el centro de cada una de las seis caras del cubo, es decir, la celda unitaria.
Cada ion de aluminio (Al+3) está rodeado por otros 12 átomos de aluminio equidistantes. Por lo tanto, el número de coordinación es 12. En la celda unitaria del aluminio, alrededor del 26% del espacio disponible está vacío (void). Debido a la menor cantidad de espacio vacío en la estructura cristalina y al fuerte enlace metálico, el aluminio es más duro, maleable y dúctil que el sodio y el magnesio.
Silicio (Si):
Los sólidos covalentes son sólidos cristalinos en los que los puntos de la red unitaria son átomos. La principal fuerza de unión son los enlaces covalentes entre los átomos. El silicio es un sólido covalente en el que los puntos de red están ocupados por los átomos del elemento. El silicio es un sólido de red. Existe una red de enlaces covalentes Si-Si.
El número atómico del Silicio es 14. La configuración electrónica del silicio en su estado básico es 1s2, 2s22p6, 3s2 3p2. Tiene cuatro electrones de valencia en sus orbitales de valencia. El silicio sufre hibridación sp3 formando cuatro orbitales hibridados sp3 de igual energía. Cada átomo de silicio forma cuatro enlaces covalentes con otros cuatro átomos de silicio vecinos debido a la SP3- SP3 Así se forma la unidad tetraédrica Si4 que se extiende para formar una molécula gigante tridimensional.

Los enlaces Si -Si se extienden continuamente por todo el cristal. Así, un cristal de silicio se considera una molécula tridimensional gigante que tiene una red tetraédrica de átomos de silicio unidos por fuertes enlaces covalentes. Los sólidos que contienen esta estructura se denominan sólidos de red. El ángulo de enlace Si-Si es de 109 o 28 ‘ mientras que la longitud del enlace es de 2,35 o
Debido a la superposición de orbitales híbridos, los enlaces covalentes Si-Si son muy fuertes y son direccionales. La presencia de una red de enlaces covalentes fuertes explica la dureza y su alto punto de fusión.
Los electrones del enlace covalente están localizados, por lo que el silicio no es un buen conductor de la electricidad y el calor. Pero es un semiconductor. Debido a la no disponibilidad de electrones libres, el silicio es un aislante a temperatura cero absoluta. Sin embargo, el silicio es un semiconductor. Si se aumenta la temperatura, los enlaces covalentes rompen los electrones libres que pueden conducir la electricidad. Por lo tanto, la conductividad aumenta con el aumento de la temperatura.