El elemento químico carbono se clasifica como un no metal. Se conoce desde la antigüedad. Se desconoce su descubridor y fecha de descubrimiento.

Zona de Datos
| Clasificación: | El carbono es un no metal |
| Color: | negro (grafito), transparente (diamante) |
| Peso atómico: | 12.011 |
| Estado: | sólido |
| Punto de fusión: | 3550 oC, 3823 K |
| Nota: A presión atmosférica normal, el carbono no se funde al calentarse, sino que se sublima. Es decir, sufre un cambio de fase directamente de sólido a gas. Si se aumenta la presión a 10 atmósferas se observa que el carbono (grafito) se funde a 3550 °C. | |
| Punto de ebullición: | 3825 oC, 4098 K |
| El punto de ebullición citado se registra cuando la presión de vapor del grafito que se sublima alcanza 1 atmósfera. | |
| Electrones: | 6 |
| Protones: | 6 |
| Neutrones en el isótopo más abundante: | 6 |
| Configuración de electrones: | 2,4 |
| Configuración de electrones: | 1s2 2s2 2p2 |
| Densidad a 20oC: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Mostrar más, incluyendo: Calores, Energías, Oxidación, Reacciones,
Compuestos, Radios, Conductividades
| Volumen atómico: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Estructura: | capas hexagonales (grafito), tetraédricas (diamante) |
| Dureza: | 0,5 mohs (grafito), 10,0 mohs (diamante) |
| Capacidad calorífica específica | 0,71 J g-1 K-1 (grafito), 0.5091 J g-1 K-1 (diamante) |
| Calor de fusión | 117 kJ mol-1 (grafito) |
| Calor de atomización | 717 kJ mol-1 |
| Calor de vaporización | 710.9 kJ mol-1 |
| Energía de primera ionización | 1086.5 kJ mol-1 |
| 2ª energía de ionización | 2352,6 kJ mol-1 |
| 3ª energía de ionización | 4620,5 kJ mol-1 |
| Afinidad de los electrones | 121.55 kJ mol-1 |
| Número de oxidación mínimo | -4 |
| Número de oxidación común mínimo. | -4 |
| Número máximo de oxidación | 4 |
| Número máximo de oxidación común | 4 |
| Electronegatividad (escala de Pauling) | 2,55 |
| Volumen de polarizabilidad | 1.8 Å3 |
| Reacción con aire | vigorosa, ⇒ CO2 |
| Reacción con 15 M HNO3 | suave, w/ht ⇒ C6(CO2H)6 (ácido melítico/grafítico) |
| Reacción con 6 M HCl | ninguna |
| . | |
| Reacción con 6 M NaOH | ninguno |
| Óxido(s) | CO , CO2 |
| Hidruro(s) | CH4 y muchos CxHy |
| Cloruro(s) | CCl4 |
| Radio atómico | 70 pm |
| Radio iónico (1+ ion) | – |
| Radio iónico (2+ ion) | – |
| Radio iónico (3+ ion) | – |
| Radio iónico (1- ion) | – |
| Radio iónico (2 iones) | – |
| Radio iónico (3 iones) | – |
| Conductividad térmica | 25-470 W m-1 K-1 (grafito) 470 W m-1 K-1 (diamante) |
| Conductividad eléctrica | 0.07 x 106 S m-1 |
| Punto de congelación/fusión: | 3550 oC, 3823 K |

Modelos de estructura de nanotubos de carbono.

Lavoisier utilizando una lente gigante en experimentos de combustión
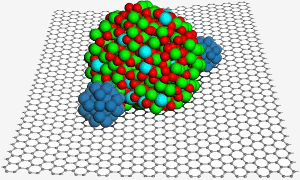
Una superficie de grafeno alberga una nanopartícula de óxido de indio y estaño, que ayuda a fijar dos nanopartículas de platino (azul) para mejorar la catálisis en una pila de combustible. Imagen: PNL.
Descubrimiento del carbono
El carbono se conoce desde la antigüedad en forma de hollín, carbón vegetal, grafito y diamantes. Las culturas antiguas no se dieron cuenta, por supuesto, de que estas sustancias eran formas diferentes del mismo elemento
El científico francés Antoine Lavoisier dio nombre al carbono y realizó diversos experimentos para revelar su naturaleza.
En 1772 reunió recursos con otros químicos para comprar un diamante, que colocaron en un frasco de cristal cerrado. Enfocaron los rayos del sol sobre el diamante con una notable lupa gigante y vieron cómo el diamante se quemaba y desaparecía.
Lavoisier observó que el peso total del frasco no cambiaba y que, al quemarse, el diamante se había combinado con el oxígeno para formar dióxido de carbono. (1), (2) Concluyó que el diamante y el carbón vegetal estaban hechos del mismo elemento: el carbono.
En 1779, el científico sueco Carl Scheele demostró que el grafito se quemaba para formar dióxido de carbono, por lo que debía ser otra forma de carbono.(3)
En 1796, el químico inglés Smithson Tennant estableció que el diamante era carbono puro y no un compuesto de carbono; se quemaba para formar sólo dióxido de carbono.
Tennant también demostró que cuando se quemaban pesos iguales de carbón vegetal y diamantes, producían la misma cantidad de dióxido de carbono. (4)
En 1855, el químico inglés Benjamin Brodie produjo grafito puro a partir de carbón, demostrando que el grafito era una forma de carbono.(4)
Aunque se había intentado anteriormente sin éxito, en 1955 el científico estadounidense Francis Bundy y sus colaboradores de General Electric demostraron finalmente que el grafito podía transformarse en diamante a alta temperatura y alta presión.(5)
En 1985, Robert Curl, Harry Kroto y Richard Smalley descubrieron los fullerenos, una nueva forma de carbono en la que los átomos están dispuestos en forma de balón de fútbol. El fullereno más conocido es el buckminsterfullereno, también conocido como C60, que consta de 60 átomos de carbono. Existe una gran familia de fullerenos, que comienza en el C20 y llega hasta el C540. (6), (7)
El alótropo del carbono descubierto más recientemente es el grafeno, que consiste en una única capa de átomos de carbono dispuestos en hexágonos. Si estas capas se apilaran unas sobre otras, el resultado sería el grafito. El grafeno tiene un grosor de sólo un átomo.
El descubrimiento del grafeno fue anunciado en 2004 por Kostya Novoselov y Andre Geim, que utilizaron cinta adhesiva para desprender una sola capa de átomos del grafito y producir el nuevo alótropo.
Hechos interesantes sobre el carbono
- Alrededor del 20% del peso de los organismos vivos es carbono.
- Se conocen más compuestos que contienen carbono que los que no lo contienen.
- El carbono es el cuarto elemento más abundante del universo.
- A pesar de su gran abundancia, debemos la existencia del carbono a un conjunto de circunstancias improbables
- El diamante es un excelente abrasivo porque es el material común más duro y también tiene la mayor conductividad térmica. Puede triturar cualquier sustancia, mientras que el calor generado por la fricción se aleja rápidamente.
- Los átomos de carbono de tu cuerpo formaron una vez parte de la fracción de dióxido de carbono de la atmósfera.
- El grafeno es el material más fino y resistente jamás conocido.
- El grafeno está formado por cristales atómicos bidimensionales, la primera vez que se han visto estas estructuras.
- El grafito de un portaminas típico tiene un diámetro de 0,7 mm. Esto equivale a 2 millones de capas de grafeno.
- Los neumáticos de los coches son negros porque tienen un 30% de negro de humo, que se añade al caucho para reforzarlo. El negro de humo también ayuda a proteger los neumáticos de los daños causados por los rayos ultravioleta.(8)
- El carbono se produce en las estrellas cuando éstas queman helio en reacciones de fusión nuclear. El carbono forma parte de la «ceniza» formada por la quema de helio.
- El carbono se somete a reacciones de fusión nuclear en las estrellas pesadas para producir neón, magnesio y oxígeno.




Izquierda: Combustión de carbón (principalmente carbono amorfo) en el aire. Derecha: Diamantes (carbono cristalino). Pensamos en hacer una foto de los diamantes en combustión -que arden a unos 800oC- pero no pudimos permitírnoslo.

Las formas de vida basadas en el carbono, como éstas, dominan nuestro planeta.

ADN. La famosa molécula de doble hélice es posible gracias a la capacidad del carbono para formar largas cadenas moleculares.
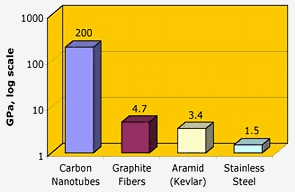
Nasa: Los nanotubos de carbono tienen una extraordinaria resistencia a la tracción, dos órdenes de magnitud superior a la de las fibras de grafito, el kevlar o el acero.
La vecindad de la tabla periódica del carbono
| Grupo 13 |
Grupo 14 |
Grupo 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
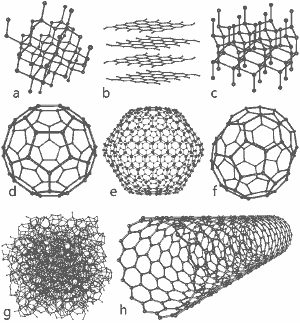
Una maravillosa imagen publicada por Michael Ströck bajo la licencia de documentación libre de GNU: Las estructuras de ocho alótropos del carbono: a) Diamante b) Grafito c) Lonsdaleita d) C60 (Buckminsterfullereno) e) C540 Fullereno f) C70 Fullereno g) Carbono amorfo h) Nanotubo de carbono de pared simple. Haga clic aquí para ampliar la imagen.
Aspecto y características
Efectos nocivos:
El carbón puro tiene una toxicidad muy baja. La inhalación de grandes cantidades de polvo de negro de humo (hollín/polvo de carbón) puede causar irritación y daños en los pulmones.
Características:
El carbono puede existir con varias estructuras tridimensionales diferentes en las que sus átomos están dispuestos de forma distinta (alótropos).
Tres alótropos cristalinos comunes son el grafito, el diamante y (normalmente) los fullerenos. El grafeno tiene una estructura cristalina 2D. (Los fullerenos pueden existir a veces en forma amorfa).(9)
El carbono también puede existir en estado amorfo. Sin embargo, muchos alótropos comúnmente descritos como amorfos, como el carbono vítreo, el hollín o el negro de humo, suelen tener suficiente estructura para no ser verdaderamente amorfos. Aunque se han observado nanotubos cristalinos, generalmente son amorfos.(10)
Las estructuras de ocho alótropos se muestran al final de esta página.
Curiosamente, el grafito es una de las sustancias más blandas y hasta hace poco se pensaba que el diamante era la sustancia natural más dura.
Se ha calculado que un alótropo extremadamente raro del carbono, la lonsdaleíta, en estado puro, es un 58% más fuerte que el diamante. La lonsdaleíta es una red de carbono similar al diamante que tiene la estructura hexagonal del grafito. Se forma cuando los meteoritos que contienen grafito chocan con otro cuerpo, como la Tierra. Las altas temperaturas y presiones del impacto transforman el grafito en lonsdaleíta.
El carbono tiene el punto de fusión/sublimación más alto de todos los elementos y, en forma de diamante, tiene la mayor conductividad térmica de cualquier elemento.
La alta conductividad térmica del diamante es el origen del término de argot «hielo». A la temperatura típica de una habitación, la temperatura de su cuerpo es más alta que la de la habitación, incluyendo cualquier diamante grande que pueda tener por ahí. Si toca alguno de estos diamantes, su alta conductividad térmica transporta el calor fuera de su piel más rápidamente que cualquier otro material. El cerebro interpreta que esta rápida transferencia de energía térmica fuera de la piel significa que está tocando algo muy frío, por lo que los diamantes a temperatura ambiente pueden parecer hielo.
Usos del carbono
El carbono (en forma de carbón, que es principalmente carbono) se utiliza como combustible.
El grafito se utiliza para puntas de lápices, crisoles de alta temperatura, pilas secas, electrodos y como lubricante.
Los diamantes se utilizan en joyería y -por su dureza- en la industria para cortar, perforar, esmerilar y pulir.
El negro de humo se utiliza como pigmento negro en la tinta de imprenta.
El carbono puede formar aleaciones con el hierro, de las cuales la más común es el acero al carbono.
El isótopo radiactivo 14C se utiliza en la datación arqueológica.
Los compuestos de carbono son importantes en muchas áreas de la industria química – el carbono forma un gran número de compuestos con hidrógeno, oxígeno, nitrógeno y otros elementos.
Abundancia e isótopos
Abundancia corteza terrestre: 200 partes por millón en peso, 344 partes por millón en moles
Abundancia sistema solar: 3000 partes por millón en peso, 300 partes por millón en moles
Coste, puro: 2,4 dólares por 100g
Coste, a granel: $ por 100g
Fuente: El carbono puede obtenerse mediante la combustión de compuestos orgánicos con insuficiente oxígeno. Los cuatro principales alótropos del carbono son el grafito, el diamante, el carbono amorfo y los fullerenos.
Los diamantes naturales se encuentran en la kimberlita de antiguos volcanes.
El grafito también puede encontrarse en depósitos naturales.
Los fullerenos se descubrieron como subproductos de experimentos con haces moleculares en la década de 1980.
El carbono amorfo es el principal componente del carbón vegetal, el hollín (negro de humo) y el carbono activado.
Isótopos: 13 cuyas vidas medias se conocen, con números de masa del 8 al 20. El carbono natural es una mezcla de dos isótopos y se encuentran en los porcentajes indicados: 12C (99%) y 13C (1%).
El isótopo 14C, con una vida media de 5730 años, se utiliza ampliamente para datar materiales carbonosos como la madera, especímenes arqueológicos, etc. para edades de hasta unos 40 000 años.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide. (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, El descubrimiento de los elementos. I. Elementos conocidos en el mundo antiguo, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Minerales industriales &rocas: materias primas, mercados y usos., (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Premio Nobel de Química, 1996
- ¿Qué necesitamos para hacer un neumático?
- Ming Gao y Hui Zhang, Preparation of an amorphous fullerene film, Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6.
Cite esta página
Para enlazar en línea, por favor copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
o
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Para citar esta página en un documento académico, por favor use la siguiente cita que cumple con MLA:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.