Rédacteur en chef : C. Michael Gibson, M.S., M.D. ; Rédacteur(s) en chef adjoint(s) : Aparna Vuppala, M.B.B.S.
- Disclaimer
- Aperçu
- Indications et posologie chez l’adulte
- Indications et posologie conformes à la FDA (adulte)
- Maux de tête
- Utilisation et posologie hors AMM (adulte)
- Utilisation soutenue par les directives
- Utilisation non soutenue par une ligne directrice
- Indications et posologie pédiatriques
- Indications et posologie indiquées par la FDA (pédiatrie)
- Indications et posologie hors AMM (pédiatrie)
- Utilisation soutenue par les guides
- Utilisation non soutenue par la ligne directrice
- Contra-indications
- Avertissements
- Dépendance médicamenteuse:
- Utilisation chez les patients ambulatoires:
- Précautions
- Effets indésirables
- Expérience des essais cliniques
- Expérience post-commercialisation
- Interactions médicamenteuses
- Utilisation dans des populations spécifiques
- Grossesse
- Labor et accouchement
- Mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Genre
- Race
- Insuffisance rénale
- Insuffisance hépatique
- Femmes en âge de procréer et hommes
- Patients immunodéprimés
- Administration et surveillance
- Administration
- Surveillance
- Compatibilité IV
- Surdosage
- Pharmacologie
- Mécanisme d’action
- Structure
- Pharmacodynamique
- Pharmacocinétique
- Aspirine:
- Butalbital:
- Caféine:
- Toxicologie non clinique
- Etudes cliniques
- Comment se présenter
- Stockage
- Images
- Images du médicament
- Panneau d’affichage des emballages et des étiquettes
- Information sur les conseils aux patients
- Précautions avec l’alcool
- Noms de marque
- Noms de médicaments similaires
- État de pénurie de médicaments
Disclaimer
WikiDoc NE DONNE AUCUNE GARANTIE DE VALIDITÉ. WikiDoc n’est pas un fournisseur de soins de santé professionnel, et ne peut pas remplacer un fournisseur de soins de santé agréé. WikiDoc est destiné à être un outil éducatif, et non un outil pour une quelconque forme de prestation de soins de santé. Le contenu éducatif des pages de WikiDoc consacrées aux médicaments est basé sur la notice de la FDA, le contenu de la National Library of Medicine et les directives de pratique / déclarations de consensus. WikiDoc ne promeut pas l’administration d’un médicament ou d’un dispositif qui n’est pas conforme à son étiquetage. Veuillez lire notre clause de non-responsabilité complète ici.
Aperçu
Le butalbital est une combinaison qui est approuvée par la FDA pour le traitement du pour le soulagement du complexe de symptômes des céphalées de tension (ou de contraction musculaire). Les effets indésirables courants comprennent des vertiges et des troubles gastro-intestinaux, notamment des nausées, des vomissements et des flatulences, une nécrolyse épidermique toxique et un érythème polymorphe.
Indications et posologie chez l’adulte
Indications et posologie conformes à la FDA (adulte)
Maux de tête
- Les comprimés de butalbital, d’aspirine et de caféine sont indiqués pour le soulagement du complexe de symptômes des céphalées de tension (ou de contraction musculaire).
- Les preuves soutenant l’efficacité et la sécurité du butalbital, de l’aspirine et de la caféine dans le traitement des céphalées récurrentes multiples ne sont pas disponibles. La prudence à cet égard est requise car le butalbital crée une accoutumance et peut potentiellement faire l’objet d’abus.
Utilisation et posologie hors AMM (adulte)
Utilisation soutenue par les directives
Il existe des informations limitées concernant l’utilisation hors AMM du butalbital chez les patients adultes.
Utilisation non soutenue par une ligne directrice
Il existe des informations limitées concernant l’utilisation non soutenue par une ligne directrice du Butalbital chez les patients adultes.
Indications et posologie pédiatriques
Indications et posologie indiquées par la FDA (pédiatrie)
Il existe des informations limitées concernant l’utilisation indiquée par la FDA du Butalbital chez les patients pédiatriques.
Indications et posologie hors AMM (pédiatrie)
Utilisation soutenue par les guides
Il existe des informations limitées concernant l’utilisation hors AMM soutenue par les guides du Butalbital chez les patients pédiatriques.
Utilisation non soutenue par la ligne directrice
Il existe des informations limitées concernant l’utilisation non soutenue par la ligne directrice du Butalbital chez les patients pédiatriques.
Contra-indications
- Hypersensibilité à l’aspirine, à la caféine ou aux barbituriques. Patients atteints de porphyrie.
Avertissements
Dépendance médicamenteuse:
- L’utilisation prolongée de barbituriques peut entraîner une pharmacodépendance, caractérisée par une dépendance psychique et, moins fréquemment, une dépendance physique et une tolérance. Le risque d’abus du butalbital, de l’aspirine et de la caféine est similaire à celui des autres associations médicamenteuses contenant des barbituriques. Il convient d’être prudent lors de la prescription de médicaments à des patients ayant une propension connue à prendre des quantités excessives de médicaments, ce qui n’est pas rare chez les patients souffrant de céphalées de tension chroniques.
Utilisation chez les patients ambulatoires:
- Le butalbital, l’aspirine et la caféine peuvent altérer les capacités mentales et/ou physiques nécessaires à l’exécution de tâches potentiellement dangereuses, telles que la conduite d’une voiture ou l’utilisation de machines. Le patient doit être mis en garde en conséquence. Les effets dépressifs du butalbital sur le système nerveux central peuvent s’ajouter à ceux d’autres dépresseurs du SNC. L’utilisation concomitante avec d’autres sédatifs-hypnotiques ou l’alcool doit être évitée. Lorsqu’un tel traitement combiné est nécessaire, il peut être nécessaire de réduire la dose d’un ou plusieurs agents.
Précautions
- Les salicylés doivent être utilisés avec une extrême prudence en présence d’un ulcère gastroduodénal ou d’anomalies de la coagulation.
Effets indésirables
Expérience des essais cliniques
- Les effets indésirables les plus fréquents sont la somnolence et les vertiges. Les effets indésirables moins fréquents sont des vertiges et des troubles gastro-intestinaux, notamment des nausées, des vomissements et des flatulences. Une seule incidence de suppression de la moelle osseuse a été signalée lors de l’utilisation du butalbital, de l’aspirine et de la caféine. Plusieurs cas de réactions dermatologiques incluant une nécrolyse épidermique toxique et un érythème polymorphe ont été rapportés.
Expérience post-commercialisation
Il existe des informations limitées concernant l’expérience post-commercialisation du butalbital dans la notice du médicament.
Interactions médicamenteuses
Il existe des informations limitées concernant les interactions médicamenteuses du Butalbital dans la notice du médicament.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse (FDA) : C
- Des études adéquates n’ont pas été réalisées chez l’animal pour déterminer si ce médicament affecte la fertilité des mâles ou des femelles, a un potentiel tératogène ou a d’autres effets indésirables sur le fœtus. Bien qu’il n’existe pas d’études bien contrôlées chez la femme enceinte, plus de vingt ans de commercialisation et d’expérience clinique n’apportent aucune preuve positive d’effets indésirables sur le fœtus. Bien qu’il n’existe pas de risque clairement défini, cette expérience ne peut exclure la possibilité de dommages peu fréquents ou subtils pour le foetus humain. Le butalbital, l’aspirine et la caféine ne doivent être utilisés chez les femmes enceintes que lorsque cela est clairement nécessaire.
Catégorie de grossesse (AUS) : Il n’existe pas de directive de l’Australian Drug Evaluation Committee (ADEC) sur l’utilisation du Butalbital chez les femmes enceintes.
Labor et accouchement
Il n’existe pas de directive de la FDA sur l’utilisation du Butalbital pendant le travail et l’accouchement.
Mères allaitantes
- Les effets du Butalbital, de l’aspirine et de la caféine sur les nourrissons des mères allaitantes ne sont pas connus. Les salicylés et les barbituriques sont excrétés dans le lait maternel des mères qui allaitent. Les taux sériques chez les nourrissons sont considérés comme insignifiants avec des doses thérapeutiques.
Utilisation pédiatrique
- La sécurité et l’efficacité chez les patients pédiatriques âgés de moins de 12 ans n’ont pas été établies.
Utilisation gériatrique
Il n’y a pas de guidance de la FDA sur l’utilisation du Butalbital en ce qui concerne les patients gériatriques.
Genre
Il n’y a pas de guidance de la FDA sur l’utilisation du Butalbital en ce qui concerne les populations de genre spécifiques.
Race
Il n’y a pas de guidance de la FDA sur l’utilisation du Butalbital concernant des populations raciales spécifiques.
Insuffisance rénale
Il n’y a pas de guidance de la FDA sur l’utilisation du Butalbital chez les patients présentant une insuffisance rénale.
Insuffisance hépatique
Il n’y a pas de guidance de la FDA sur l’utilisation du Butalbital chez les patients présentant une insuffisance hépatique.
Femmes en âge de procréer et hommes
Il n’existe pas de guidance de la FDA sur l’utilisation du Butalbital chez les femmes en âge de procréer et les hommes.
Patients immunodéprimés
Il n’existe pas de guidance de la FDA sur l’utilisation du Butalbital chez les patients immunodéprimés.
Administration et surveillance
Administration
- Oral
Surveillance
Il existe des informations limitées concernant la surveillance du Butalbital dans la notice du médicament.
Compatibilité IV
Il existe des informations limitées concernant la compatibilité IV du butalbital dans la notice du médicament.
Surdosage
- Les effets toxiques d’un surdosage aigu de butalbital, d’aspirine et de caféine sont attribuables principalement à son composant barbiturique et, dans une moindre mesure, à l’aspirine. Comme les effets toxiques de la caféine ne se produisent qu’à des doses très élevées, la possibilité d’une toxicité significative de la caféine par un surdosage de butalbital, d’aspirine et de caféine est peu probable. Les symptômes attribuables à une intoxication aiguë aux barbituriques comprennent la somnolence, la confusion et le coma, la dépression respiratoire, l’hypotension et le choc. Les symptômes attribuables à une intoxication aiguë par l’aspirine sont les suivants : hyperpnée, troubles acido-basiques avec développement d’une acidose métabolique, vomissements et douleurs abdominales, acouphènes, hyperthermie, hypoprothrombinémie, agitation, délire, convulsions. Une intoxication aiguë à la caféine peut provoquer de l’insomnie, de l’agitation, des tremblements et du délire ; de la tachycardie et des extrasystoles. Le traitement consiste principalement à gérer l’intoxication aux barbituriques et à corriger le déséquilibre acide-base dû au salicylisme. Les vomissements doivent être provoqués mécaniquement ou avec des émétiques chez le patient conscient. Le lavage gastrique peut être utilisé si les réflexes pharyngés et laryngés sont présents et si moins de 4 heures se sont écoulées depuis l’ingestion. Un tube endotrachéal à ballonnet doit être inséré avant le lavage gastrique du patient inconscient et lorsque cela est nécessaire pour assurer la respiration assistée. La diurèse, l’alcalinisation de l’urine et la correction des perturbations électrolytiques doivent être réalisées par l’administration de liquides intraveineux tels que le bicarbonate de sodium à 1 % dans du dextrose à 5 % dans l’eau. Une attention méticuleuse doit être accordée au maintien d’une ventilation pulmonaire adéquate. La correction de l’hypotension peut nécessiter l’administration de bitartrate de lévartérénol ou de chlorhydrate de phényléphrine par perfusion intraveineuse. Dans les cas graves d’intoxication, la dialyse péritonéale, l’hémodialyse ou l’exsanguino-transfusion peuvent sauver la vie. L’hypoprothrombinémie doit être traitée par la vitamine K, par voie intraveineuse.
Il existe des informations limitées concernant le surdosage chronique de Butalbital dans la notice du médicament.
Pharmacologie
Il existe des informations limitées concernant la pharmacologie du Butalbital dans la notice du médicament.
Mécanisme d’action
- Pharmacologiquement, le butalbital, l’aspirine et la caféine associent les propriétés analgésiques de l’aspirine aux propriétés anxiolytiques et myorelaxantes du butalbital.
L’efficacité clinique du butalbital, de l’aspirine et de la caféine dans les céphalées de tension a été établie dans des essais multicliniques en double aveugle, contrôlés par placebo. Une étude de conception factorielle a comparé le butalbital, l’aspirine et la caféine avec chacun de ses principaux composants. Cette étude a démontré que chaque composant contribue à l’efficacité du butalbital, de l’aspirine et de la caféine dans le traitement des symptômes cibles de la céphalée de tension (douleur de la céphalée, tension psychique et contraction musculaire dans la région de la tête, du cou et des épaules). Pour chaque symptôme et pour le complexe de symptômes dans son ensemble, il a été démontré que le butalbital, l’aspirine et la caféine avaient des effets cliniques significativement supérieurs à ceux de l’un ou l’autre des composants pris séparément.
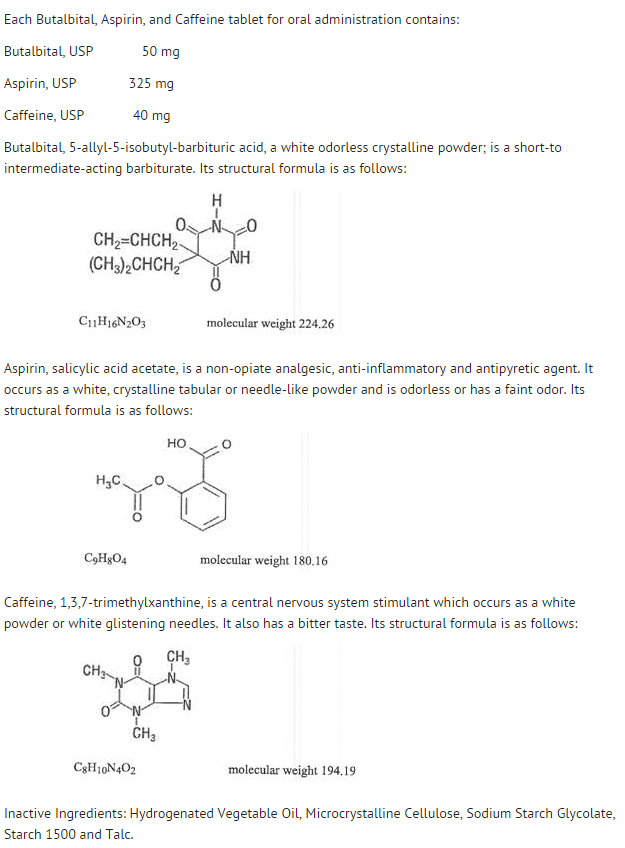
Structure
- Le comportement des différents composants est décrit ci-dessous.
- La disponibilité systémique de l’aspirine après une dose orale dépend fortement de la forme galénique, de la présence d’aliments, du temps de vidange gastrique, du pH gastrique, des antiacides, des agents tampons et de la taille des particules. Ces facteurs n’affectent pas nécessairement l’étendue de l’absorption des salicylates totaux mais davantage la stabilité de l’aspirine avant l’absorption.
- Pendant le processus d’absorption et après l’absorption, l’aspirine est principalement hydrolysée en acide salicylique et distribuée dans tous les tissus et fluides corporels, y compris les tissus fœtaux, le lait maternel et le système nerveux central (SNC). Les concentrations les plus élevées se trouvent dans le plasma, le foie, le cortex rénal, le cœur et les poumons. Dans le plasma, environ 50 % à 80 % de l’acide salicylique et de ses métabolites sont faiblement liés aux protéines plasmatiques.
- La clairance des salicylates totaux est soumise à une cinétique saturable ; cependant, la cinétique d’élimination de premier ordre reste une bonne approximation pour des doses allant jusqu’à 650 mg. La demi-vie plasmatique de l’aspirine est d’environ 12 minutes et celle de l’acide salicylique et/ou des salicylates totaux est d’environ 3,0 heures.
- L’élimination des doses thérapeutiques se fait par les reins soit sous forme d’acide salicylique soit sous forme d’autres produits de biotransformation. La clairance rénale est fortement augmentée par une urine alcaline comme celle produite par l’administration simultanée de bicarbonate de sodium ou de citrate de potassium.
- La biotransformation de l’aspirine se produit principalement dans les hépatocytes. Les principaux métabolites sont l’acide salicylurique (75 %), les glucuronides phénoliques et acyliques du salicylate (15 %) et les acides gentisque et gentisurique (1 %). La biodisponibilité du composant aspirine, butalbital, aspirine et caféine est équivalente à celle d’une solution, à l’exception d’une vitesse d’absorption plus lente. Une concentration maximale de 8,80 mcg/mL a été obtenue 40 minutes après une dose de 650 mg.
- Le butalbital est bien absorbé par le tractus gastro-intestinal et devrait se distribuer dans la plupart des tissus de l’organisme. Les barbituriques, en général, peuvent apparaître dans le lait maternel et traversent facilement la barrière placentaire. Ils sont liés aux protéines plasmatiques et tissulaires à un degré variable et la liaison augmente directement en fonction de la solubilité lipidique.
- L’élimination du butalbital se fait principalement par voie rénale (59%-88% de la dose) sous forme de médicament inchangé ou de métabolites. La demi-vie plasmatique est d’environ 35 heures. Les produits d’excrétion urinaire comprennent la molécule mère (environ 3,6 % de la dose), l’acide 5-isobutyl-5-(2,3-dihydroxypropyl) barbiturique (environ 24 % de la dose), l’acide 5-allyl-5-(3-hydroxy-2-méthyl-1-propyl) barbiturique (environ 4,8 % de la dose), les produits dont le cycle barbiturique est hydrolysé avec excrétion d’urée (environ 14 % de la dose), ainsi que des matières non identifiées. Parmi les matières excrétées dans les urines, 32 % étaient conjuguées.
- La biodisponibilité du composant butalbital du butalbital, de l’aspirine et de la caféine est équivalente à celle d’une solution à l’exception d’une diminution de la vitesse d’absorption. Une concentration maximale de 2020 ng/mL est obtenue environ 1,5 heure après une dose de 100 mg.
- La liaison in vitro du butalbital aux protéines plasmatiques est de 45% sur la plage de concentration de 0,5 à 20 mcg/mL. Ceci se situe dans la gamme de liaison aux protéines plasmatiques (20 % à 45 %) rapportée avec d’autres barbituriques tels que le phénobarbital, le pentobarbital et le sécobarbital sodique. Le rapport entre la concentration plasmatique et la concentration sanguine était presque unitaire, ce qui indique qu’il n’y a pas de distribution préférentielle du butalbital dans le plasma ou les cellules sanguines. (voir SURDOSAGE pour des informations sur la toxicité).
- Comme la plupart des xanthines, la caféine est rapidement absorbée et distribuée dans tous les tissus et liquides de l’organisme, y compris le SNC, les tissus fœtaux et le lait maternel.
- La caféine est éliminée rapidement par métabolisme et excrétion dans l’urine. La demi-vie plasmatique est d’environ 3,0 heures. La biotransformation hépatique avant l’excrétion donne lieu à des quantités à peu près égales de 1-méthyl-xanthine et d’acide 1-méthylurique. Sur les 70 % de la dose qui ont été récupérés dans les urines, seuls 3 % étaient du médicament inchangé.
- La biodisponibilité du composant caféine pour le butalbital, l’aspirine et la caféine est équivalente à celle d’une solution, à l’exception d’un temps de pic légèrement plus long. Une concentration maximale de 1660 ng/mL a été obtenue en moins d’une heure pour une dose de 80 mg
- Les comprimés de butalbital, d’aspirine et de caféine, USP 50 mg/325 mg/40 mg sont des comprimés compressés blancs, ronds, non sécables, portant l’impression « West-ward 785 ».
- Réserver à 20-25oC (68-77oF) . Protéger de la lumière et de l’humidité.
- Dispenser dans un contenant étanche et résistant à la lumière tel que défini dans l’USP en utilisant une fermeture à l’épreuve des enfants.
- L’interaction alcool-Butalbital n’a pas été établie. Discutez avec votre médecin des effets de la prise d’alcool avec ce médicament.
Pharmacodynamique
Il existe des informations limitées concernant la pharmacodynamique du butalbital dans la notice du médicament.
Pharmacocinétique
Aspirine:
Butalbital:
Caféine:
Toxicologie non clinique
Il y a des informations limitées concernant la toxicologie non clinique du Butalbital dans la notice du médicament.
Etudes cliniques
Il y a des informations limitées concernant les études cliniques du Butalbital dans la notice du médicament.
Comment se présenter
Bouteilles de 30 comprimésBouteilles de 50 comprimésBouteilles de 100 comprimésBouteilles de 500 comprimésBouteilles de 1000 comprimésDose unitaire Boîtes de 100 comprimés
Stockage
Il existe des informations limitées concernant le stockage du butalbital dans l’étiquette du médicament.
Images
Images du médicament
Nom du médicament : Butalbital, acétaminophène et caféine
Ingrédient(s) : BUTALBITAL, ACETAMINOPHEN, CAFEINE
Impression : West;ward;787
Dosage : 50 mg
Couleur(s) : Bleu
Forme : Rond
Taille (mm) : 11
Score : 1
NDC:01431787
Étiquette du médicament Auteur : West-Ward Pharmaceutical Corp
Cette image de pilule est fournie par le PillBox de la National Library of Medicine.

Nom du médicament : Butalbital, Aspirine et Caféine
Ingrédient(s) : BUTALBITAL, ASPIRINE, CAFÉINE
Impression : Westward;785
Dosage : 50 mg
Couleur(s) : Blanc
Forme : Rond
Taille (mm) : 11
Score : 1
NDC:01431785
Étiquette du médicament Auteur : West-ward Pharmaceutical Corp
Cette image de pilule est fournie par le PillBox de la National Library of Medicine.

Nom du médicament : Butalbital, Aspirine et Caféine
Ingrédient(s) : BUTALBITAL, ASPIRINE, CAFÉINE
Impression : WATSON;3219
Dosage: 50 mg
Couleur(s) : Vert, jaune
Forme : Capsule
Taille (mm) : 22
Score : 1
NDC:05913219
Étiquette du médicament Auteur : Watson Laboratories, Inc.
Cette image de pilule est fournie par le PillBox de la National Library of Medicine.
Nom du médicament : Comprimés de butalbital, d’aspirine et de caféine
Ingrédient(s) : ASPIRINE, BUTALBITAL, CAFÉINE
Impression : West;ward;785
Dosage : 50 mg
Couleur(s) : Blanc
Forme : Rond
Taille (mm) : 7
Score : 1
NDC:06032548
Auteur de l’étiquette du médicament : Qualitest
Cette image de pilule est fournie par le PillBox de la National Library of Medicine.
Panneau d’affichage des emballages et des étiquettes
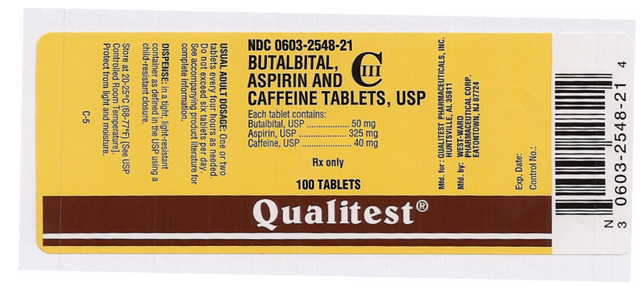
Cette image de l’étiquette de la FDA est fournie par la National Library of Medicine.

Cette image de l’étiquette de la FDA est fournie par la National Library of Medicine.
Information sur les conseils aux patients
Il y a des informations limitées concernant les conseils aux patients du Butalbital dans la notice du médicament.
Précautions avec l’alcool
Noms de marque
Il y a des informations limitées concernant les noms de marque du Butalbital dans la notice du médicament.
Noms de médicaments similaires
Il y a des informations limitées concernant les noms de médicaments similaires au Butalbital dans la notice du médicament.
État de pénurie de médicaments
.