Science >Chimie >Éléments de troisième rang >Concept de liaison métallique et solides métalliques
Dans cet article, nous étudierons le concept de liaison métallique et les liaisons métalliques dans les cristaux de sodium, magnésium et aluminium.
Concept de liaison métallique:
La liaison métallique est définie comme la force d’attraction qui lie les cations métalliques à un certain nombre d’électrons mobiles ou délocalisés dans sa sphère d’influence qui maintient les cations métalliques ensemble dans un modèle défini. De nombreuses théories ont été proposées pour expliquer la nature de la liaison métallique. La théorie de l’électron libre ou théorie de la mer électronique est l’une des théories les plus simples proposées par Drude et Lorentz. Certains des postulats importants de cette théorie sont les suivants :
Théorie de l’électron libre de la liaison métallique :
Les atomes métalliques ont moins d’électrons de valence donc ils ont beaucoup d’orbitales de valence vacantes. Na, Mg et Al ont des orbitales 3p vacantes.
| Nom | Symbole | N° atomique. | Configuration électronique | Configuration détaillée |
| Sodium | Na | 11 | 2, 8, 1 | 1s2, 2s2 2p6, 3s1 |
| Magnésium | Mg | 12 | 2 , 8, 2 | 1s2, 2s2 2p6, 3s2 |
| Aluminium | Al | 13 | 2, 8, 3 | 1s2, 2s2 2p6, 3s2 3p1 |
Les valeurs du potentiel d’ionisation des métaux sont faibles, donc les électrons de valence sont faiblement retenus et peuvent être facilement retirés. La structure étroitement emballée du cristal métallique est constituée des atomes du métal qui sont identiques à tous égards.
Les orbitales inoccupées des atomes étroitement emballés du métal se chevauchent avec l’orbitale similaire des atomes adjacents à travers le réseau cristallin. Les électrons de valence retirés de leurs orbitales et peuvent se déplacer librement des orbitales de valence vacantes d’un atome à l’autre. Comme ces électrons de valence n’appartiennent pas à un seul atome mais au cristal dans son ensemble, ils sont appelés électrons délocalisés ou mobiles. Les ions métalliques (cations) produits en raison de la délocalisation sont appelés noyaux. Les ions métalliques ont des positions fixes dans le réseau cristallin tandis que les électrons délocalisés sont libres de se déplacer dans le réseau cristallin. Ainsi, le métal peut être considéré comme une agrégation de cations métalliques immergés dans une mer d’électrons mobiles.
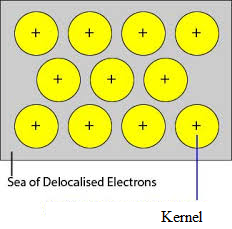
Puisque les électrons dans les métaux sont délocalisés, et qu’ils sont supposés être distribués uniformément dans le réseau cristallin. Les forces d’attraction entre les ions métalliques et les électrons délocalisés sont uniformes dans toutes les directions. Par conséquent, la liaison métallique est non directionnelle.
Les unités occupant les points du réseau dans le Sodium, le Magnésium, l’Aluminium sont des ions positifs de ceux-ci respectivement et sont entourés d’électrons mobiles. Ainsi, le Sodium, le Magnésium et l’Aluminium sont des solides métalliques.
A mesure que l’on va de gauche à droite c’est-à-dire du Sodium vers l’Aluminium, le nombre d’électrons de valence augmente et donc la force de la liaison augmente du Sodium vers l’Aluminium.
Les propriétés comme la conductivité électrique et thermique, l’éclat métallique, la malléabilité et la ductilité peuvent être expliquées sur la base de la théorie des électrons libres.
Caractéristiques des liaisons métalliques:
- La liaison métallique est définie comme la force d’attraction qui lie les cations métalliques à un certain nombre d’électrons mobiles ou délocalisés dans sa sphère d’influence qui maintient les cations métalliques ensemble dans un modèle défini.
- La liaison métallique est non directionnelle.
- Elles sont plus faibles que la liaison covalente mais plus fortes que les forces de van der Waal.
- Les liaisons ne sont pas rigides.
- La force de la liaison métallique est directement liée à la charge positive de l’ion métallique. Ainsi, la force de la liaison métallique augmente lorsque Na < Mg < Al.
Solides métalliques:
Les solides métalliques sont des solides cristallins dans lesquels les unités occupant les points du réseau sont des ions positifs entourés d’un pool d’électrons. (Concept de liaison métallique)
Structures cristallines des métaux:
L’analyse aux rayons X de différents cristaux métalliques a montré que les métaux adoptent l’une ou l’autre des structures cristallines suivantes.
- Structure cubique centrée sur le corps. (BCC)
- Structure cubique centrée sur la face. (FCC)
- Structure hexagonale en paquet serré. (HCP)
Sodium (Na):
Le sodium métallique a une structure cristalline cubique centrée (BCC) à paquet ouvert. La liaison est une liaison métallique non directionnelle.
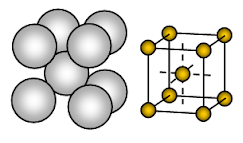
L’arrangement des ions dans un plan- réseau cubique – structure ouverte ou tassée carrée. Dans cette disposition, chaque ion métallique touche quatre ions adjacents dans un plan. La séquence des couches est AB, AB, AB, ……….
Le sodium est un solide métallique. Dans la cellule unitaire du sodium, chaque ion sodium est entouré de huit autres ions sodium équidistants. Ces ions sodium sont disposés aux coins d’un cube imaginaire et au centre du cube, un ion sodium est présent. Il y a 2 ions présents dans une cellule unitaire de sodium.
Les ions sodium occupent seulement environ 68% de l’espace disponible dans une cellule unitaire. Donc 32% de la cellule unitaire reste vide (void). Comme cette structure comporte plus d’espace vide les métaux qui adoptent cette structure sont mous. Le sodium est donc un métal mou en raison de plus d’espace vide (environ 32% ) dans sa structure cristalline et d’une liaison métallique plutôt faible due à un seul électron de valence par atome de Na dans son cristal.
Magnésium (Mg):
Le magnésium a une structure cristalline hexagonale serrée (HCP). La liaison est une liaison métallique non directionnelle.
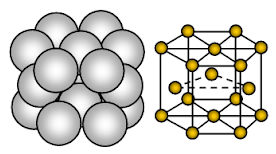
Le magnésium est un solide métallique. Les unités qui occupent les sites du réseau sont les ions Mg et ces ions sont entourés d’électrons mobiles ou délocalisés.
La disposition des ions dans un plan la disposition des ions est un réseau hexagonal ou une couche tassée fermée. Ainsi, chaque ion métallique touche six ions adjacents dans un plan. Chaque ion magnésium touche six ions magnésium dans sa propre couche, trois dans la couche au-dessus et trois dans la couche au-dessous. Dans la structure hexagonale, les couches fermées d’ions sont empilées dans une séquence alternée généralement appelée AB ABA …… Chaque troisième couche d’ions est exactement la même que la première et se trouve directement au-dessus de celle-ci.
Chaque atome de Mg est entouré de 12 autres ions de Mg équidistants. Le nombre de coordination est donc de 12. Dans la cellule unitaire, environ 26% de l’espace disponible est vide (void). Cette structure est plus étroitement emballée. En raison de la diminution de l’espace vide dans la structure cristalline, de l’augmentation du nuage d’électrons dû au Mg+2 et de la forte liaison métallique, le magnésium est plus dur que le sodium. Il est plus malléable et ductile que le sodium.
Aluminium (Al):
L’aluminium a une structure cristalline cubique à faces centrées (FCC). La liaison est une liaison métallique non directionnelle.

L’aluminium est un solide métallique. Les unités occupant les sites du réseau sont des ions Al et ces ions sont entourés d’électrons mobiles ou délocalisés.
La disposition des ions dans un plan la disposition des ions est un réseau hexagonal ou une couche tassée fermée. Ainsi, chaque ion métallique est en contact avec six ions adjacents dans un plan.
Dans une structure cristalline cubique tassée ou à faces centrées, la séquence de couches d’ions tassées se répète toutes les quatre couches. C’est-à-dire que chaque quatrième couche d’ions est exactement la même que la première couche et se trouve directement au-dessus de celle-ci. Elle est donc appelée ABC, ABC, ABC, ….. structure cristalline cubique. L’empilement serré cubique est également appelé structure d’empilement serré centrée sur la face parce que si on le regarde sous un angle particulier, on peut considérer que les ions se trouvent aux huit coins du cube et au centre de chacune des six faces du cube, c’est-à-dire de la cellule unitaire.
Chaque ion d’aluminium (Al+3) est entouré de 12 autres atomes d’aluminium équidistants. Le nombre de coordination est donc de 12. Dans la cellule unitaire de l’aluminium, environ 26% de l’espace disponible est vide (void). En raison de moins d’espace vide dans la structure cristalline, de la forte liaison métallique, l’aluminium est plus dur, plus malléable et plus ductile que le sodium et le magnésium.
Silicium (Si):
Les solides covalents sont des solides cristallins dans lesquels les points unitaires du réseau sont des atomes. La principale force de liaison est constituée par les liaisons covalentes entre les atomes. Le silicium est un solide covalent dans lequel les points du réseau sont occupés par les atomes de l’élément. Le silicium est un solide en réseau. Il existe un réseau de liaisons covalentes Si-Si.
Le numéro atomique du silicium est 14. La configuration électronique du silicium dans son état fondamental est 1s2, 2s22p6, 3s2 3p2. Il possède quatre électrons de valence dans leurs orbitales de valence. Le silicium subit une hybridation sp3 formant quatre orbitales hybridées sp3 d’énergie égale. Chaque atome de silicium forme quatre liaisons covalentes avec quatre autres atomes de silicium voisins en raison de SP3- SP3 Ainsi se forme une unité tétraédrique Si4 qui s’étend pour former une molécule géante tridimensionnelle.

Les liaisons Si -Si s’étendent de façon continue dans tout le cristal. Ainsi, un cristal de silicium est considéré comme une molécule tridimensionnelle géante ayant un réseau tétraédrique d’atomes de silicium liés entre eux par de fortes liaisons covalentes. Un solide contenant une telle structure est appelé solide de réseau. L’angle de liaison Si-Si est de 109 o 28 ‘ tandis que la longueur de la liaison est de 2,35 o
En raison du chevauchement des orbitales hybrides, les liaisons covalentes Si-Si sont très fortes et sont directionnelles. La présence d’un réseau de liaisons covalentes fortes explique la dureté et son point de fusion élevé.
Les électrons dans la liaison covalente sont localisés donc le silicium n’est pas un bon conducteur d’électricité et de chaleur. Mais c’est un semi-conducteur. En raison de la non-disponibilité d’électrons libres, le silicium est un isolant à la température du zéro absolu. Cependant, le silicium est un semi-conducteur. Si la température augmente, les liaisons covalentes se rompent ; les électrons libres peuvent conduire l’électricité. Ainsi, la conductivité augmente avec l’augmentation de la température.
Science >Chimie >Éléments de troisième rang >Concept de liaison métallique et de solides métalliques
.