L’élément chimique carbone est classé parmi les non-métaux. Il est connu depuis l’Antiquité. Son découvreur et sa date de découverte sont inconnus.

Zone de données
| Classification: | Le carbone est un non-métal |
| Couleur : | noir (graphite), transparent (diamant) |
| Poids atomique: | 12.011 |
| Etat: | solide |
| Point de fusion: | 3550 oC, 3823 K |
| Note : A la pression atmosphérique normale, le carbone ne fond pas sous l’effet de la chaleur, il se sublime. C’est-à-dire qu’il subit un changement de phase directement du solide au gaz. Si la pression est portée à 10 atmosphères, on observe que le carbone (graphite) fond à 3550 °C. | |
| Point d’ébullition: | 3825 oC, 4098 K |
| Le point d’ébullition cité est enregistré lorsque la pression de vapeur du graphite au-dessus du graphite sublimé atteint 1 atmosphère. | |
| Électrons: | 6 |
| Protons: | 6 |
| Neutrons dans l’isotope le plus abondant : | 6 |
| Coquilles électroniques: | 2,4 |
| Configuration électronique: | 1s2 2s2 2p2 |
| Densité à 20oC: | 2.267 g/cm3 (gr), 3,513 g/cm3 (di) |
Afficher plus, y compris : Chaleur, énergies, oxydation, réactions,
Composés, rayons, conductivités
| Volume atomique: | 5,31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Structure: | couches hexagonales (graphite), tétraédriques (diamant) |
| Dureté : | 0,5 mohs (graphite), 10,0 mohs (diamant) |
| Capacité thermique spécifique | 0,71 J g-1 K-1 (graphite), 0.5091 J g-1 K-1 (diamant) |
| Chaleur de fusion | 117 kJ mol-1 (graphite) |
| Chaleur d’atomisation | 717 kJ mol-1 |
| Chaleur de vaporisation | 710.9 kJ mol-1 |
| Première énergie d’ionisation | 1086.5 kJ mol-1 |
| 2ème énergie d’ionisation | 2352.6 kJ mol-1 |
| 3ème énergie d’ionisation | 4620.5 kJ mol-1 |
| Affinité électronique | 121.55 kJ mol-1 |
| Nombre d’oxydation minimal | -4 |
| Nombre d’oxydation minimal commun. | -4 |
| Nombre maximal d’oxydation | 4 |
| Nombre maximal d’oxydation commune. | 4 |
| Electronégativité (échelle de Pauling) | 2,55 |
| Volume de polarisabilité | 1.8 Å3 |
| Réaction avec l’air | vigoureux, ⇒ CO2 |
| Réaction avec 15 M HNO3 | doux, w/ht ⇒ C6(CO2H)6 (acide mellitique/graphitique) |
| Réaction avec 6 M HCl | aucun |
| Réaction avec NaOH 6 M | aucune |
| Oxyde(s) | CO , CO2 |
| Hydrure(s) | CH4 et plusieurs CxHy |
| Chlorure(s) | CCl4 |
| Rayon atomique | 70 pm |
| Rayon ionique (1+ ion) | – |
| Rayon ionique (2+ ion) | – |
| Rayon ionique (3+ ion) | – |
| Rayon ionique (1- ion) | – |
| Rayon ionique (2- ion) | – |
| Rayon ionique (3- ion) | – |
| Conductivité thermique | 25-470 W m-1 K-1 (graphite), 470 W m-1 K-1 (diamant) |
| Conductivité électrique | 0.07 x 106 S m-1 |
| Point de congélation/fusion: | 3550 oC, 3823 K |

Modèles de structure des nanotubes de carbone.

Lavoisier utilisant une lentille géante dans des expériences de combustion
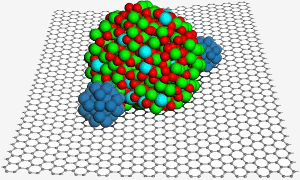
Une surface de graphène accueille une nanoparticule d’oxyde d’indium et d’étain, qui permet de fixer deux nanoparticules de platine (bleu) pour améliorer la catalyse dans une pile à combustible. Image : PNL.
Découverte du carbone
Le carbone est connu depuis l’Antiquité sous forme de suie, de charbon, de graphite et de diamants. Les cultures anciennes ne réalisaient pas, bien sûr, que ces substances étaient différentes formes du même élément
Le scientifique français Antoine Lavoisier a donné un nom au carbone et il a réalisé diverses expériences pour révéler sa nature.
En 1772, il a mis en commun ses ressources avec d’autres chimistes pour acheter un diamant, qu’ils ont placé dans un bocal en verre fermé. Ils ont focalisé les rayons du soleil sur le diamant à l’aide d’une remarquable loupe géante et ont vu le diamant brûler et disparaître.
Lavoisier a noté que le poids global du bocal était inchangé et que lors de la combustion, le diamant s’était combiné avec l’oxygène pour former du dioxyde de carbone. (1), (2) Il en conclut que le diamant et le charbon de bois étaient constitués du même élément : le carbone.
En 1779, le scientifique suédois Carl Scheele a montré que le graphite brûlait pour former du dioxyde de carbone et qu’il devait donc être une autre forme de carbone.(3)
En 1796, le chimiste anglais Smithson Tennant a établi que le diamant était du carbone pur et non un composé du carbone ; il brûlait pour former uniquement du dioxyde de carbone.
Tennant a également prouvé que lorsque des poids égaux de charbon de bois et de diamants étaient brûlés, ils produisaient la même quantité de dioxyde de carbone. (4)
En 1855, le chimiste anglais Benjamin Brodie a produit du graphite pur à partir de carbone, prouvant que le graphite était une forme de carbone.(4)
Bien que cela ait été tenté auparavant sans succès, en 1955, le scientifique américain Francis Bundy et ses collègues de General Electric ont finalement démontré que le graphite pouvait être transformé en diamant à haute température et à haute pression.(5)
En 1985, Robert Curl, Harry Kroto et Richard Smalley ont découvert les fullerènes, une nouvelle forme de carbone dans laquelle les atomes sont disposés en forme de ballon de football. Le fullerène le plus connu est le buckminsterfullerène, également connu sous le nom de C60, composé de 60 atomes de carbone. Il existe une grande famille de fullerènes, qui commence à C20 et va jusqu’à C540. (6), (7)
L’allotrope de carbone le plus récemment découvert est le graphène, qui consiste en une seule couche d’atomes de carbone disposés en hexagones. Si ces couches étaient empilées les unes sur les autres, on obtiendrait du graphite. Le graphène a une épaisseur d’un seul atome.
La découverte du graphène a été annoncée en 2004 par Kostya Novoselov et Andre Geim, qui ont utilisé du ruban adhésif pour détacher une seule couche d’atomes du graphite afin de produire le nouvel allotrope.
Faits intéressants sur le carbone
- Environ 20% du poids des organismes vivants est constitué de carbone.
- On connaît plus de composés qui contiennent du carbone que ceux qui n’en contiennent pas.
- Le carbone est le quatrième élément le plus abondant dans l’univers.
- Malgré sa grande abondance, nous devons l’existence du carbone à un ensemble improbable de circonstances
- Le diamant est un excellent abrasif car c’est le matériau commun le plus dur et il possède également la plus grande conductivité thermique. Il peut broyer n’importe quelle substance, tandis que la chaleur générée par la friction est rapidement évacuée.
- Les atomes de carbone de votre corps faisaient tous autrefois partie de la fraction de dioxyde de carbone de l’atmosphère.
- Le graphène est le matériau le plus fin et le plus résistant jamais connu.
- Le graphène est constitué de cristaux atomiques bidimensionnels, la première fois que de telles structures ont été vues.
- Le graphite d’un porte-mine typique a un diamètre de 0,7 mm. Cela équivaut à 2 millions de couches de graphène.
- Les pneus de voiture sont noirs parce qu’ils contiennent environ 30% de noir de carbone, qui est ajouté au caoutchouc pour le renforcer. Le noir de carbone aide également à protéger les pneus contre les dommages causés par les UV.(8)
- Le carbone est fabriqué à l’intérieur des étoiles lorsqu’elles brûlent de l’hélium dans des réactions de fusion nucléaire. Le carbone fait partie des « cendres » formées par la combustion de l’hélium.
- Le carbone subit des réactions de fusion nucléaire dans les étoiles lourdes pour fabriquer du néon, du magnésium et de l’oxygène.




Gauche : Combustion de charbon (principalement du carbone amorphe) dans l’air. Droite : Les diamants (carbone cristallin). Nous avons pensé à prendre une photo de diamants en combustion – ils brûlent à environ 800oC – mais nous ne pouvions pas nous le permettre !

Les formes de vie à base de carbone, telles que celles-ci, dominent notre planète.

L’ADN. La célèbre molécule à double hélice est rendue possible par la capacité du carbone à former de longues chaînes moléculaires.
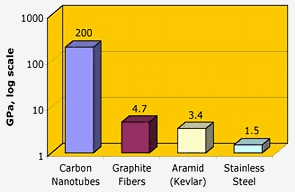
Nasa : Les nanotubes de carbone ont une résistance à la traction exceptionnelle – deux ordres de grandeur plus élevés que les fibres de graphite, le kevlar ou l’acier.
Voisinage du carbone dans le tableau périodique
| Groupe 13 |
Groupe 14 |
Groupe 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
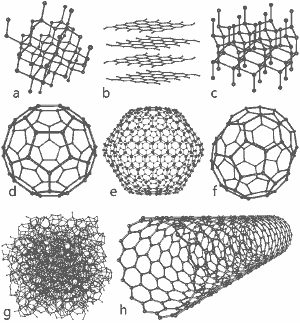
Une image magnifique publiée par Michael Ströck sous la licence de documentation libre GNU : Les structures de huit allotropes de carbone : a) le diamant b) le graphite c) la lonsdaleite d) le C60 (Buckminsterfullerène) e) le fullerène C540 f) le fullerène C70 g) le carbone amorphe h) le nanotube de carbone à paroi unique. Cliquez ici pour une image plus grande.
Apparence et caractéristiques
Effets nocifs :
Le carbone pur a une très faible toxicité. L’inhalation de grandes quantités de poussière de noir de carbone (suie/poussière de charbon) peut provoquer une irritation et des dommages aux poumons.
Caractéristiques :
Le carbone peut exister avec plusieurs structures tridimensionnelles différentes dans lesquelles ses atomes sont disposés différemment (allotropes).
Trois allotropes cristallins courants sont le graphite, le diamant et (généralement) les fullerènes. Le graphène a une structure cristalline 2D.(Les fullerènes peuvent parfois exister sous forme amorphe.)(9)
Le carbone peut également exister à l’état amorphe. Cependant, de nombreux allotropes communément décrits comme amorphes, tels que le carbone vitreux, la suie ou le noir de carbone, ont généralement suffisamment de structure pour ne pas être réellement amorphes. Bien que des nanotubes cristallins aient été observés, ils sont généralement amorphes.(10)
Les structures de huit allotropes sont présentées au bas de cette page.
Il est intéressant de noter que le graphite est l’une des substances les plus molles et que le diamant était considéré, jusqu’à récemment, comme la substance naturelle la plus dure.
Un allotrope extrêmement rare du carbone, la lonsdaleite, a été calculé, sous forme pure, pour être 58% plus fort que le diamant. La lonsdaleite est un réseau de carbone semblable au diamant qui possède la structure hexagonale du graphite. Elle est produite lorsque des météorites contenant du graphite frappent un autre corps, comme la Terre. Les hautes températures et pressions de l’impact transforment le graphite en lonsdaleite.
Le carbone a le point de fusion/sublimation le plus élevé de tous les éléments et, sous forme de diamant, il a la conductivité thermique la plus élevée de tous les éléments.
La conductivité thermique élevée du diamant est à l’origine du terme argotique « glace ». À des températures ambiantes typiques, la température de votre corps est supérieure à celle de la pièce – y compris celle des gros diamants que vous pouvez avoir par hasard à portée de main. Si vous touchez l’un de ces diamants, sa conductivité thermique élevée évacue la chaleur de votre peau plus rapidement que tout autre matériau. Votre cerveau interprète ce transfert rapide d’énergie thermique loin de votre peau comme signifiant que vous touchez quelque chose de très froid – ainsi les diamants à température ambiante peuvent être ressentis comme de la glace.
Utilisations du carbone
Le carbone (sous forme de charbon, qui est principalement du carbone) est utilisé comme combustible.
Le graphite est utilisé pour les pointes de crayons, les creusets à haute température, les piles sèches, les électrodes et comme lubrifiant.
Les diamants sont utilisés en bijouterie et – en raison de leur dureté – dans l’industrie pour la coupe, le forage, le meulage et le polissage.
Le noir de carbone est utilisé comme pigment noir dans l’encre d’imprimerie.
Le carbone peut former des alliages avec le fer, dont le plus courant est l’acier au carbone.
L’isotope radioactif 14C est utilisé dans la datation archéologique.
Les composés du carbone sont importants dans de nombreux domaines de l’industrie chimique – le carbone forme un vaste nombre de composés avec l’hydrogène, l’oxygène, l’azote et d’autres éléments.
Abondance et isotopes
Abondance croûte terrestre : 200 parties par million en poids, 344 parties par million en moles
Abondance système solaire : 3000 parties par million en poids, 300 parties par million en moles
Coût, pur : 2,4 $ par 100g
Coût, en vrac : $ par 100g
Source : Le carbone peut être obtenu en brûlant des composés organiques avec une quantité insuffisante d’oxygène. Les quatre principaux allotropes du carbone sont le graphite, le diamant, le carbone amorphe et les fullerènes.
Les diamants naturels se trouvent dans la kimberlite provenant d’anciens volcans.
Le graphite peut également être trouvé dans des dépôts naturels.
Les fullerènes ont été découverts comme sous-produits d’expériences sur les faisceaux moléculaires dans les années 1980.
Le carbone amorphe est le principal constituant du charbon de bois, de la suie (noir de carbone) et du charbon actif.
Isotopes : 13 dont les demi-vies sont connues, avec des numéros de masse de 8 à 20. Le carbone naturel est un mélange de deux isotopes et on les trouve dans les pourcentages indiqués : 12C (99%) et 13C (1%).
L’isotope 14C, dont la demi-vie est de 5730 ans, est largement utilisé pour dater les matériaux carbonés tels que le bois, les spécimens archéologiques, etc. pour des âges allant jusqu’à environ 40 000 ans.

- Robert E. Krebs, L’histoire et l’utilisation des éléments chimiques de notre terre : un guide de référence…, (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, La découverte des éléments. I. Éléments connus dans le monde antique, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Minéraux industriels &roches : produits, marchés et utilisations, (2006) p507. SME.
- Amanda S. Barnard, La formule du diamant : synthèse du diamant – une perspective gemmologique., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, The diamond makers., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Prix Nobel de chimie, 1996
- De quoi avons-nous besoin pour fabriquer un pneu ?
- Ming Gao et Hui Zhang, Préparation d’un film amorphe de fullerène, Physics Letters A Volume 213, Issues 3-4, 22 avril 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , 16 avril 2001 Volume 79, Number 16 CENEAR 79 16 pp.6..
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
ou
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.
.