A szén kémiai elemet a nem fémekhez sorolják. Már az ókor óta ismert. Felfedezője és felfedezésének időpontja ismeretlen.

Adatok zónája
| Besorolás: | A szén nem fém |
| Szín: | fekete (grafit), átlátszó (gyémánt) |
| Atomsúly: | 12.011 |
| Állapot: | szilárd |
| Olvadáspont: | 3550 oC, 3823 K |
| Megjegyzés: Normál légköri nyomáson a szén melegítéskor nem olvad, hanem szublimál. Vagyis közvetlenül fázisátalakuláson megy keresztül szilárdból gázzá. Ha a nyomást 10 atmoszférára növeljük, a szén (grafit) 3550 °C-on megfigyelhető, hogy megolvad. | |
| Fulladási pont: | 3825 oC, 4098 K |
| A megadott forráspontot akkor regisztráljuk, amikor a szublimáló grafit feletti grafitgőznyomás eléri az 1 atmoszférát. | |
| Elektronok: | 6 |
| Protonok: | 6 |
| Neutronok a leggyakoribb izotópban: | 6 |
| Elektronhéjak: | 2,4 |
| Elektronkonfiguráció: | 1s2 2s2 2p2 |
| Sűrűség 20oC-on: | 2.267 g/cm3 (gr), 3.513 g/cm3 (di) |
Mutasd még, többek között: Mutasd még! Hő, energiák, oxidáció, reakciók,
Vegyületek, sugarak, vezetőképességek
| Atomi térfogat: | 5.31 cm3/mol (gr), 3.42 cm3/mol (di) |
| Szerkezet: | hexagonális rétegek (grafit), tetraéderes (gyémánt) |
| Keménység: | 0,5 mohs (grafit), 10,0 mohs (gyémánt) |
| Specifikus hőkapacitás | 0,71 J g-1 K-1 (grafit), 0.5091 J g-1 K-1 (gyémánt) |
| Fúziós hő | 117 kJ mol-1 (grafit) |
| Porlasztási hő | 717 kJ mol-1 |
| Gőzölési hő | 710.9 kJ mol-1 |
| 1. ionizációs energia | 1086.5 kJ mol-1 |
| 2. ionizációs energia | 2352,6 kJ mol-1 |
| 3. ionizációs energia | 4620,5 kJ mol-1 |
| Elektronaffinitás | 121.55 kJ mol-1 |
| Minimális oxidációs szám | -4 |
| Min. gyakori oxidációs szám. | -4 |
| Maximális oxidációs szám | 4 |
| Max. közös oxidációs szám. | 4 |
| Elektronegativitás (Pauling-skála) | 2,55 |
| Polarizálhatósági térfogat | 1.8 Å3 |
| Reakció levegővel | heves, ⇒ CO2 |
| Reakció 15 M HNO3 | enyhe, w/ht ⇒ C6(CO2H)6 (mellites/grafitosav) |
| Reakció 6 M HCl-lal | nincs |
| Reakció 6 M NaOH-val | nincs |
| Oxid(ok) | CO , CO2 |
| Hidrid(ek) | CH4 és sok CxHy |
| Klorid(ok) | CCl4 |
| Atomsugár | 70 pm |
| Ionsugár (1+ ion) | – |
| Ionsugár (2+ ion) | – |
| Ionsugár (3+ ion) | – |
| Ionsugár (1- ion) | – |
| Ionsugár (2-ion) | – |
| Ionsugár (3-ion) | – |
| Hővezető képesség | 25-470 W m-1 K-1 (grafit), 470 W m-1 K-1 (gyémánt) |
| Elektromos vezetőképesség | 0.07 x 106 S m-1 |
| Fagyás/olvadáspont: | 3550 oC, 3823 K |

A szén nanocső szerkezetének modelljei.

Lavoisier egy óriáslencsét használ égési kísérletekben
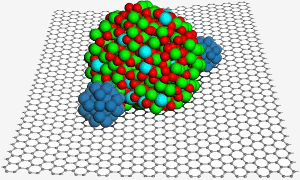
A grafén felülete egy indium-ón-oxid nanorészecskét fogad, amely segít két platina nanorészecskét (kék) rögzíteni a jobb katalízis érdekében egy üzemanyagcellában. Kép: PNL.
A szén felfedezése
A szén már ősidők óta ismert korom, faszén, grafit és gyémánt formájában. Az ősi kultúrák természetesen nem tudták, hogy ezek az anyagok ugyanannak az elemnek különböző formái
Antoine Lavoisier francia tudós nevet adott a szénnek, és számos kísérletet végzett annak feltárására. 1772-ben más kémikusokkal összefogva megvásárolt egy gyémántot, amelyet egy zárt üvegedénybe helyeztek. Egy figyelemre méltó óriás nagyítóval a gyémántra irányították a napsugarakat, és látták, ahogy a gyémánt elég és eltűnik.
Lavoisier megállapította, hogy a befőttesüveg össztömege nem változott, és hogy égéskor a gyémánt az oxigénnel szén-dioxiddá egyesült. (1), (2) Arra a következtetésre jutott, hogy a gyémánt és a faszén ugyanabból az elemből – szénből – áll.
1779-ben Carl Scheele svéd tudós kimutatta, hogy a grafit égéskor szén-dioxidot képez, tehát a szén egy másik formájának kell lennie.(3)
1796-ban Smithson Tennant angol kémikus megállapította, hogy a gyémánt tiszta szén, és nem a szén valamely vegyülete; égéskor csak szén-dioxidot képez.(3)
Tennant azt is bizonyította, hogy azonos tömegű faszén és gyémánt égésekor ugyanannyi szén-dioxid keletkezik. (4)
1855-ben Benjamin Brodie angol kémikus szénből tiszta grafitot állított elő, bebizonyítva, hogy a grafit a szén egyik formája. 1855-ben Benjamin Brodie angol kémikus szénből tiszta grafitot állított elő, bebizonyítva, hogy a grafit a szén egyik formája. 1855-ben Benjamin Brodie angol kémikus szénből tiszta grafitot állított elő, bebizonyítva, hogy a grafit a szén egyik formája. 1955-ben Francis Bundy amerikai tudós és munkatársai a General Electricnél végre bebizonyították, hogy a grafitot magas hőmérsékleten és nagy nyomáson gyémánttá lehet alakítani.(5)
1985-ben Robert Curl, Harry Kroto és Richard Smalley felfedezte a fulleréneket, a szén egy új formáját, amelyben az atomok focilabda alakban helyezkednek el. A legismertebb fullerén a bakminsterfullerén, más néven C60, amely 60 szénatomból áll. A fullerének nagy családja létezik, a C20-tól kezdve egészen a C540-ig. (6), (7)
A szén legújabban felfedezett allotípusa a grafén, amely hatszögekbe rendezett szénatomok egyetlen rétegéből áll. Ha ezeket a rétegeket egymásra helyeznénk, grafitot kapnánk. A grafén vastagsága mindössze egy atom.
A grafén felfedezését 2004-ben jelentette be Kosztya Novoselov és Andre Geim, akik ragasztószalaggal egyetlen réteg atomot váltottak le a grafitról, hogy előállítsák az új allotropot.
Érdekes tények a szénről
- Az élő szervezetek tömegének mintegy 20%-a szén.
- Több olyan vegyületet ismerünk, amely szenet tartalmaz, mint amennyi nem.
- A szén a negyedik leggyakoribb elem a világegyetemben.
- Nagy gyakorisága ellenére a szén létezését valószínűtlen körülményeknek köszönhetjük
- A gyémánt kiváló csiszolóanyag, mert a legkeményebb közönséges anyag, és a legnagyobb a hővezető képessége is. Bármilyen anyagot képes lecsiszolni, miközben a súrlódás során keletkező hőt gyorsan elvezeti.
- A testében lévő szénatomok egykor mind a légkör szén-dioxid-frakciójának részei voltak.
- A grafén a valaha ismert legvékonyabb és legerősebb anyag.
- A grafén kétdimenziós atomkristályokból áll, először láttak ilyen struktúrákat.
- A grafit egy tipikus mechanikus ceruzában 0,7 mm átmérőjű. Ez 2 millió grafénrétegnek felel meg.
- Az autógumik azért fekete színűek, mert kb. 30%-ban szénfeketét tartalmaznak, amelyet a gumi erősítése céljából adnak hozzá. A szénfekete segít megvédeni a gumiabroncsokat az UV-károsodástól is.(8)
- A szén a csillagokban keletkezik, amikor azok héliumot égetnek el a magfúziós reakciókban. A szén a hélium égése során keletkező “hamu” része.
- A szén a nehéz csillagokban nukleáris fúziós reakciókban neont, magnéziumot és oxigént alkot.




Balra: Szén (főként amorf szén) égése levegőben. Jobbra: Gyémánt (kristályos szén). Gondoltunk rá, hogy lefényképezzük az égő gyémántokat – kb. 800oC-on égnek -, de nem engedhettük meg magunknak!

A szénalapú életformák, mint például ezek, uralják bolygónkat.

DNS. A híres kettős spirál molekulát az teszi lehetővé, hogy a szén képes hosszú molekulaláncokat alkotni.
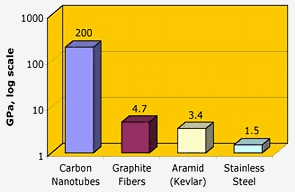
Nasa: A szén nanocsövek kiemelkedő szakítószilárdsággal rendelkeznek – két nagyságrenddel nagyobb, mint a grafitszálak, a kevlár vagy az acél.
A szén periódusos rendszer szomszédsága
| csoport 13 |
csoport 14 |
Group 15 |
|
| 2 | 5 B |
6 C |
7 N |
| 3 | 13 Al |
14 Si |
15 P |
| 4 | 31 Ga |
32 Ge |
33 As |
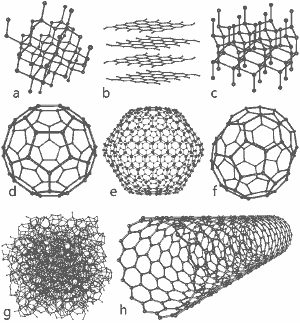
A csodálatos képet Michael Ströck adta ki a GNU Free Documentation License alatt: A szén nyolc allotropjának szerkezete: a) Gyémánt b) Grafit c) Lonsdaleit d) C60 (Buckminsterfullerén) e) C540 Fullerén f) C70 Fullerén g) Amorf szén h) Egyfalú szén nanocső. Kattintson ide a nagyobb képért.
Megjelenés és jellemzők
Ártalmas hatások:
A tiszta szénnek nagyon alacsony a toxicitása. Nagy mennyiségű korompor (korom/szénpor) belégzése irritációt és tüdőkárosodást okozhat.
Jellemzők:
A szén többféle 3 dimenziós szerkezetben is létezhet, amelyekben az atomjai különbözőképpen vannak elrendezve (allotrópok).
Három gyakori kristályos allotrop a grafit, a gyémánt és (általában) a fullerének. A grafén 2D kristályszerkezetű (A fullerének néha amorf formában is létezhetnek.)(9)
A szén amorf állapotban is létezhet. Sok, általában amorfként leírt allotróp azonban, mint például az üvegszerű szén, a korom vagy a korom, általában elégséges szerkezettel rendelkezik ahhoz, hogy ne legyen valóban amorf. Bár megfigyeltek kristályos nanocsöveket is, ezek általában amorf állapotúak. 10.
Nyolc allotrop szerkezetét az oldal alján mutatjuk be. 10.
Érdekes módon a grafit az egyik legpuhább anyag, a gyémántot pedig egészen a közelmúltig a legkeményebb természetesen előforduló anyagnak tartották.
A szén egy rendkívül ritka allotípusa, a lonsdaleit, a számítások szerint tiszta formában 58%-kal erősebb a gyémántnál. A lonsdaleit egy gyémántszerű szénhálózat, amely a grafit hatszögletű szerkezetével rendelkezik. Akkor keletkezik, amikor grafitot tartalmazó meteoritok csapódnak egy másik égitestbe, például a Földbe. A becsapódáskor fellépő magas hőmérséklet és nyomás a grafitot lonsdaleit-té alakítja át.
A szénnek az összes elem közül a legmagasabb az olvadási/szublimációs pontja, és gyémánt formájában a legmagasabb a hővezető képessége az összes elem közül.
A gyémánt nagy hővezető képessége az eredete a szlengben használt “jég” kifejezésnek. A tipikus szobahőmérsékleten az Ön testhőmérséklete magasabb, mint a szoba hőmérséklete – beleértve az esetlegesen épp itt heverő nagyméretű gyémántokat is. Ha bármelyik ilyen gyémántot megérinted, a nagy hővezető képességük gyorsabban vezeti el a hőt a bőrödről, mint bármely más anyag. Az agyad úgy értelmezi ezt a gyors hőenergia-elvezetést a bőrödről, hogy valami nagyon hideghez érsz – így a szobahőmérsékletű gyémántokat jégnek érezheted.
A szén felhasználása
A szenet (szén formájában, amely főként szénből áll) üzemanyagként használják.
A grafitot ceruzahegyekhez, magas hőmérsékletű tégelyekhez, szárazelemekhez, elektródákhoz és kenőanyagként használják.
A gyémántot ékszerekben és – mivel nagyon kemény – az iparban vágásra, fúrásra, csiszolásra és polírozásra használják.
A szénfeketét a nyomdafesték fekete pigmentjeként használják.
A szén ötvözeteket képezhet a vassal, amelyek közül a leggyakoribb a szénacél.
A 14C radioaktív izotópot a régészeti kormeghatározásban használják.
A szénvegyületek a vegyipar számos területén fontosak – a szén rengeteg vegyületet alkot hidrogénnel, oxigénnel, nitrogénnel és más elemekkel.
Bőség és izotópok
Bőség Földkéreg: 200 rész/millió tömeg, 344 rész/millió mol
Bőség Naprendszer: Szén nyerhető szerves vegyületek elégtelen oxigén mellett történő elégetésével. A szén négy fő allotropja a grafit, a gyémánt, az amorf szén és a fullerének.
A természetes gyémántokat az ősi vulkánokból származó kimberlitben találjuk.
A grafit is megtalálható természetes lelőhelyeken.
A fulleréneket az 1980-as években molekulasugaras kísérletek melléktermékeként fedezték fel.
Az amorf szén a faszén, a korom (korom) és az aktív szén fő alkotórésze.
Izotópok: 13, amelyek felezési ideje ismert, tömegszámuk 8-tól 20-ig. A természetben előforduló szén két izotóp keveréke, és a feltüntetett százalékos arányban fordulnak elő: 12C (99%) és 13C (1%).
A 14C izotópot, amelynek felezési ideje 5730 év, széles körben használják szénalapú anyagok, például fa, régészeti leletek stb. kormeghatározására kb. 40 000 éves korig.

- Robert E. Krebs, The history and use of our earth’s chemical elements: a reference guide., (2006) p192. Greenwood Publishing Group
- Mary Elvira Weeks, Az elemek felfedezése. I. Az ókorban ismert elemek, J. Chem. Educ., 1932, 9 (1), p4
- Jessica Elzea Kogel, Industrial minerals & rocks: commodities, markets, and uses., (2006) p507. SME.
- Amanda S. Barnard, The diamond formula: Diamond synthesis-a gemological perspective., (2000) p3. Butterworth-Heinemann
- Robert M. Hazen, A gyémántkészítők., (1999) p145. Cambridge University Press.
- Jonathan W. Steed, Jerry L. Atwood, Supramolecular Chemistry., (2009) p423. Wiley.
- Kémiai Nobel-díj, 1996
- Mi kell a gumiabroncshoz?
- Ming Gao and Hui Zhang, Preparation of an amorphous fullerene film., Physics Letters A Volume 213, Issues 3-4, 22 April 1996, Pages 203-206
- Ron Dagani, Nanotube Magic, Materials Research , April 16, 2001 Volume 79, Number 16 CENEAR 79 16 pp.6..
Cite this Page
Online hivatkozáshoz, kérjük, másolja be az alábbiak egyikét:
<a href="https://www.chemicool.com/elements/carbon.html">Carbon</a>
vagy
<a href="https://www.chemicool.com/elements/carbon.html">Carbon Element Facts</a>
Az oldal tudományos dokumentumban való idézéséhez, kérjük, használja a következő MLA-konform idézést:
"Carbon." Chemicool Periodic Table. Chemicool.com. 25 July. 2014. Web. <https://www.chemicool.com/elements/carbon.html>.
.